Monòxid de nitrogen
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 29,998 Da |
| Trobat en el tàxon | |
| Rol | nitric oxide donors (en) |
| Estructura química | |
| Fórmula química | NO |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Velocitat del so | 325 m/s (10 ℃, gas) |
| Solubilitat | 5 g/100 g (aigua, 20 ℃) |
| Moment dipolar elèctric | 0,159 D |
| Punt de fusió | −164 ℃ −163,6 ℃ |
| Punt d'ebullició | −152 ℃ (a 760 Torr) −151,74 ℃ (a 101,325 kPa) |
| Moment dipolar elèctric | 0,159 D |
| Entalpia estàndard de formació | 81 kJ/mol |
| Pressió de vapor | 34,2 atm (a 20 ℃) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 30 mg/m³ (10 h, Estats Units d'Amèrica) |
| IDLH | 123 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
No s'ha de confondre amb el monòxid de dinitrogen (N₂O), amb el diòxid de dinitrogen (N₂O₂), amb el diòxid de nitrogen (NO₂) o amb qualsevol de la resta dels òxids de nitrogen existents.
El monòxid de nitrogen, antigament anomenat òxid nítric, és un compost binari de nitrogen i oxigen de fórmula . És un gas incolor d'un punt d'ebullició de -151,8 °C i un punt de fusió de -163 °C, poc soluble en aigua. És present en petites quantitats en els mamífers i també a l'aire produït principalment pels motors de combustió dels vehicles i centrals elèctriques. Se'l considera un agent tòxic.
És una molècula altament inestable a l'aire perquè s'oxida ràpidament en presència d'oxigen convertint-se en diòxid de nitrogen, , de color marró. La seva inestabilitat és deguda al fet que és un radical lliure, és a dir, té un electró desaparellat.
Compleix simultàniament un paper beneficiós i perjudicial en l'home. La presència d' a l'atmosfera per raons antropogèniques contribueix al problema de la pluja àcida, la formació de pol·lució urbana i la destrucció de la capa d'ozó. Però, en petites quantitats en el cos, l' actua com a neurotransmissor, ajudant a dilatar els vasos sanguinis i participa en altres canvis fisiològics.[1]
Estructura
[modifica]La molècula de monòxid de nitrogen està formada per un àtom de nitrogen i un d'oxigen, les configuracions electròniques dels quals són les següents:
els electrons de valència dels quals es troben en la capa 2 (2s 2p).[2] Es tracta d'11 electrons, nombre imparell que farà que la molècula tingui un electró desaparellat i que, per tant, es tracti d'un radical. Pel fet d'estar format per només dos àtoms és una molècula lineal.
Obtenció i procedència
[modifica]Industrialment, el monòxid de nitrogen s'obté per oxidació catalítica de l'amoníac:[1]
Al laboratori es prepara per reducció de nitrit mitjançant un reductor lleu com ara el iodur:[1]
També per oxidació de coure, estany o plom amb àcid nítric:
Les altes temperatures a motors d'explosió o en travessar l'aire un llamp fan que aquesta combinació sigui possible a partir del dinitrogen i del dioxigen de l'aire:[3]
A l'estratosfera les molècules d'òxid de dinitrogen, , poden reaccionar amb el radical oxigen procedent del trencament de la molècula d' per l'efecte de la llum ultraviolada procedent del Sol:
El també es pot formar per reacció de nitrogen atòmic, procedent del trencament per llum solar ultraviolada, i dioxigen:
Reaccions generals
[modifica]En contacte amb un agent oxidant, com l'oxigen, el reacciona obtenint-se diòxid de nitrogen, :[3]
El reacciona amb els halògens com el fluor, el clor i el brom per formar halurs de nitrosil, . La reacció amb iode forma un producte poc estable que retorna a formar els reactius.
També participa en moltes reaccions de coordinació com a lligand per obtenir algun complex de coordinació.
Determinació atmosfèrica
[modifica]A causa de la seva natura (és molt reactiu), determinar la concentració de a l'atmosfera no és fàcil. La forma de fer-ho es basa en prediccions de models computacionals que inclouen totes les reaccions químiques, els fluxos radiatius i l'estratificació vertical com una funció de la latitud; i la comparació d'aquestes amb mesures (per reaccions de quimioluminescència implicant l'ozó, , o per electroanàlisi).[4]
La llum es mesura en un fotodetector i és proporcional a la quantitat d' a la mostra.
L' és un dels òxids de nitrogen amb més impacte ambiental. Principalment, les emissions d'aquest òxid provenen de la crema de combustibles fòssils. Les altes temperatures als motors dels automòbils provoquen que els gasos presents a l'aire (nitrogen i oxigen, i ) reaccionin formant . Aquest pot formar altres òxids de nitrogen que també poden produir un impacte ambiental.
Destrucció de la capa d'ozó
[modifica]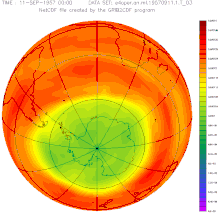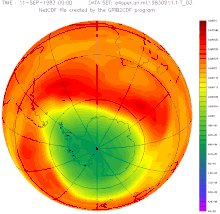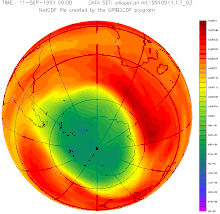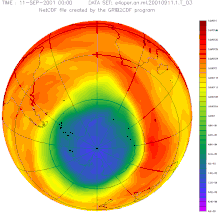
El monòxid de nitrogen contribueix a la destrucció de la capa d'ozó. Encara que la majoria de l' format a la superfície no arriba a l'estratosfera, una petita part hi arriba i, a més, s'hi pot formar a partir del o del per reaccions fotoquímiques. L', per la seva naturalesa de radical, catalitza la reacció de destrucció d'ozó, , podent una molècula d', d'aquesta manera, destruir moltes molècules d'ozó.
Reacció global: També es donen cicles que no destrueixen l'ozó, però hi participen espècies que per altres reaccions el destruirien. Aquests cicles fan que els cicles catalítics de la destrucció d' tinguin un impacte menor.
Reacció global:
Els productes d'aquest cicle poden reaccionar entre ells per formar altre cop (reacció inversa).
Pluja àcida
[modifica]
També el monòxid de nitrogen té un paper important en el fenomen de la pluja àcida. Per una sèrie de reaccions pot formar cristalls d'àcid nítric que pot precipitar dissolt en aigua donant-li el pH àcid. Les reaccions implicades són:
Els cristalls de (àcid nítric) formats poden ser transportats pel vent llargues distàncies, formar altre cop els radicals i entrar en el cicle de destrucció d' lluny d'allà on s'han format. Aquests cristalls també poden ser transportats (i dissolts) per les gotes d'aigua de la precipitació o fer la funció de punts de condensació de l'aigua i precipitar cap a la superfície de la Terra, generant la pluja àcida.
Boirum fotoquímic
[modifica]
Per acabar, el monòxid de nitrogen, juntament amb altres espècies com els hidrocarburs dels escapaments dels cotxes, provoca el fenomen del boirum fotoquímic, que es dona en la troposfera (capa més propera a la superfície de l'atmosfera). És un cicle que es pot repetir diàriament i té diverses etapes diferenciades en el dia:
Matinada: increment d' per part dels automòbils
Mig matí: passa a per mitjà de diverses reaccions:
Migdia: reacciona de forma fotoquímica generant radicals que ataca als hidrocarburs procedents dels tubs d'escapament que no s'han cremat i formen aldehids, responsables del boirum.
Tarda - nit: la falta de llum fa que no es generi més i que s'aturin la resta de reaccions.
Funcions biològiques
[modifica]Als anys 1970 el farmacòleg Ferid Murad va descobrir que els nitrats utilitzats en el tractament de dolors de pit i algunes indicacions cardiovasculars alliberen monòxid de nitrogen en condicions fisiològiques. Aquest té al mateix temps efectes dilatadors pels vasos sanguinis. També va trobar que indueix a una relaxació de la capa muscular en els endotelis.
L'any 1987 es va descobrir que el cos humà produeix petites quantitats d' a partir de l'aminoàcid arginina. Això va ajudar a entendre el mecanisme d'actuació de diversos nitrats orgànics usats com medicaments en atacs d'angina de pit que igualment alliberen en el cos humà. Fins i tot el tractament de pacients amb arterioesclerosi amb arginina sembla tenir el mateix principi. En el cervell el monòxid de nitrogen pot tenir el paper d'un transmissor.
Tots aquests descobriments van culminar en l'atorgament del premi Nobel a Robert Furchgott, Ferid Murad i Louis José Ignarro l'any 1998 i la revista Science anomenà l' molècula de l'any 1992.[5]

La síntesi d' es realitza per acció d'un enzim, l'òxid nítric sintasa (NOS) a partir de l'aminoàcid L-arginina que produeix i L-citrulina, requerint la presència de dos cofactors, l'oxigen i el fosfat dinucleòtid adenina nicotinamida (NADPH).
L' és produït per una àmplia varietat de tipus de cèl·lules que inclouen cèl·lules epitelials, nervioses, endotelials i inflamatòries. Existeixen tres formes de NOS, dues denominades constitutives i dependents del calci (cNOS), que són l'endotelial i la neuronal, les quals sintetitzen en condicions normals, i una induïble i independent del calci (iNOS), que no s'expressen o ho fan molt dèbilment en condicions fisiològiques.
És sintetitzat per les cèl·lules endotelials, macròfags i cert grup de neurones del cervell. Té un mecanisme d'acció paracrina sobre la cèl·lula que actua induint el fosfat de guanosina cíclic (GMPc) que produeix entre altres efectes, relaxació de múscul llis, cosa que provoca accions biològiques, vasodilatació i broncodilatació. La seva presència en les concentracions fisiològiques normals inhibeix l'activació plaquetària, produint-se un viratge cap a la trombofília en cas de depleció de l'.
Tot això ha fet que tingui grans aplicacions directes a la medicina.
Finalment, l' també serveix com conservant. És alliberat del nitrit que s'utilitza en la conservació de la carn. De fet, alguns virus i microorganismes alliberen per a matar cèl·lules.
Vegeu també
[modifica]Referències
[modifica]- ↑ 1,0 1,1 1,2 ATKINS, P. W.; JONES, LORETTA. Principios de química : los caminos del descubrimiento. 3a. Buenos Aires: Médica Panamericana, 2006. ISBN 978-950-06-0080-4.
- ↑ «http://www.periodni.com/es/configuracion_electronica_de_los_elementos.html».
- ↑ 3,0 3,1 «http://www.rebeccapaton.net/pollution/pages/chemistry.htm».
- ↑ 4,0 4,1 SEINFELD, JOHN H.; PANDIS, SPYROS N.. Atmospheric chemistry and physics : from air pollution to climate change. Nova York: Wiley & Sons, 1998.
- ↑ Koshland, D. E. «The molecule of the year» (en anglès). Science, 258, 5090, 18-12-1992, pàg. 1861–1861. DOI: 10.1126/science.1470903. ISSN: 0036-8075. PMID: 1470903.





![{\displaystyle {\ce {4NH3\;+\;5O2\;->[1000\,^{\circ }C,\,Pt]\;4NO\;+\;6H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dde617c1f8cf754e3219a6f65d805fc527634b05)





![{\displaystyle {\ce {O_2 \; ->[llum \; \lambda \, < \, 240 \, nm] \; O \; + \, O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/21a4161334560b875c86a2c1b5e691f3d3b046d1)

![{\displaystyle {\ce {N_2 \; ->[llum \; \lambda \, < \, 126 \, nm] \; N \; + \, N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1fe08b888cce043d507ad172e898bd8454ec4d2)














![{\displaystyle {\ce {NO2 ->[llum] NO + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/56a4de4e008b325dbd0c874b90ac759ed13af6ac)
![{\displaystyle {\ce {O3 ->[llum] O2 + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0151bd5038bb3392459bf40d3e0ce641b5b01fd7)



