Corba de refredament
Una corba de refredament és una línia en una gràfica d'una funció que representa la transició de fase de la matèria, en general a partir de gas a sòlid o líquid a sòlid. Aquestes corbes s'utilitzen àmpliament en química i física, i poden ser aplicades (erròniament) a la matèria ja sia per descriure l'escalfament o ja sia per descriure el refredament.
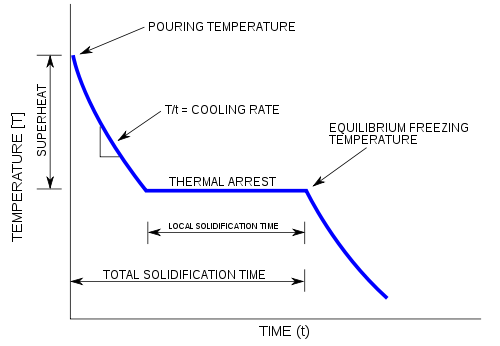
La variable independent (eix X, horitzontal) és el temps i la variable dependent (eix Y, vertical) és la temperatura.[1] A sota i ha un exemple de corba de refredament utilitzada en la fosa.
Aquests gràfics són útils perquè mostren clarament els fenòmens de transició de fase del material. Per a explicar això es pot utilitzar l'aigua com a exemple. En primer lloc, es comença amb un contenidor segellat ple de vapor, les molècules es mouen a gran velocitat, ja que la temperatura és al voltant de 150 °C. Mentre mesurem la temperatura del gas, que es refreda ràpidament, podem veure que la temperatura descendeix a un ritme que és típic de la calor específica del vapor d'aigua fins que arriba a 100 °C, que és quan la temperatura roman constant encara que segueix traient calor del sistema. Després que s'ha format una certa quantitat d'aigua líquida la temperatura comença a baixar, en proporció a la calor específica de l'aigua, i no ja més del vapor, (els dos tenen diferents calors específiques), fins que la temperatura torna a estabilitzar de nou, aquesta vegada a 0 °C. Un cop completada fins a la transició de fase, la temperatura comença a baixar.
L'explicació rau en el fet que les diferents fases de la matèria corresponen a diferents nivells d'energia. El vapor d'aigua a 100 °C té la mateixa temperatura, però té un energia tèrmica molt més gran que l'aigua líquida a 100 °C. El mateix s'aplica a la transició de l'aigua a gel a 0 °C. Això és perquè les molècules d'aigua són molt més lliures per moure's i expandir-se com un gas en lloc d'un líquid, i aquesta llibertat de moviment significa que hi ha una major energia cinètica associada amb cada molècula, i és aquesta energia que es transfereix durant la fase de transició la que explica per què l'energia aparentment desapareix al bullir l'aigua.

1) Substància pura sense transició de fase
2) Substància pura o eutètica, amb solidificació a la temperatura Tf
3) Aliatge a miscibilitat completa, amb solidificació en l'interval de temperatura Tl-Ts
4) Aliatge a miscibilitat parcial, amb solidificació en l'interval de temperatura Tl-TE
Referències
[modifica]- ↑ Garland, Nibler, and Shoemaker. Experiments in Physical Chemistry (7th ed.)