Espectroscòpia infraroja

L'espectroscòpia infraroja, o espectroscòpia IR, és la branca de l'espectroscòpia que treballa en les longituds d'ona de la zona corresponent a l'infraroig de l'espectre electromagnètic. S'utilitza, sola o en combinació amb altres tècniques, per a identificar un compost o investigar la composició d'una mostra, ja que dona informació dels tipus d'enllaç presents en aquesta. Els fotons de la radiació infraroja no tenen energia suficient per a provocar transicions electròniques en els àtoms, però sí que poden aconseguir vibracions dels enllaços covalents de les molècules orgàniques.
La regió de l'infraroig de l'espectre correspon a longituds d'ona que van des de 8 x 10-5 cm a 8 x 10-2 cm o, cosa que és equivalent, de 14 000 a 10 cm-1, si s'expressa en nombre d'ona. La porció infraroja de l'espectre electromagnètic es divideix en tres regions, l'infraroig proper, el mitjà i el llunyà, així anomenats per la seva relació amb l'espectre visible. D'aquest tres, l'infraroig mitjà (aproximadament 4000-400 cm-1) és el que s'usa per estudiar les vibracions fonamentals i l'estructura rotacional/vibracional en l'espectroscòpia IR.
Història
[modifica]El físic anglès William Herschel fou el primer per reconèixer l'existència de la radiació infraroja el 1800. Tanmateix l'interès per aquest tipus de radiació electromagnètica no fou explorat fins al període 1882-1900. El 1882[1] els anglesos William de Wiveleslie Abney i Edward Robert Festing fotografiaren l'espectre infraroig d'absorció de 52 compostos i correlacionaren bandes d'absorció amb la presència de determinats grups funcionals en les molècules, treball que ampliaren en posteriors articles.[2][3] El 1892[4] Willem Henri Julius obtingué l'espectre de 20 compostos orgànics observant que els grups metil absorbien en una longitud d'ona característica.[5]
El 1903 el físic nord-americà William Weber Coblentz, de la Universitat Cornell, començà a investigar l'espectre d'infraroig de centenars de substàncies, tant orgàniques com inorgàniques, estenent la zona de l'infraroig emprada fins aquells moments.[6] Hagué de dissenyar i construir els seus instruments i obtenir els espectres de forma tediosa requerint 3-4 hores o més per a cada espectre. Després dels avenços assolits durant Segona Guerra Mundial en electrònica és fer possible obtenir un espectre en només 1-2 hores. El resultat final d'aquesta feina primerenca era el reconeixement que cada compost tenia un únic espectre d'infraroig, una marca d'identitat, i que grups funcionals, fins i tot quan eren en molècules diferents, donaven bandes d'absorció a la mateixa longitud d'ona.[5]
Vibracions dels enllaços
[modifica]Els àtoms no es troben estàtics dins d'una molècula sinó que estan en moviment constant uns respecte als altres, vibrant a freqüències constants entorn dels enllaços covalents que els uneixen. L'espectroscòpia infraroja es basa en el fet que les molècules tenen freqüències concretes a les quals roten i vibren, és a dir, els moviments de rotació i vibració moleculars tenen nivells d'energia discrets (modes normals vibracionals). Les freqüències ressonants o freqüències vibracionals són determinats bàsicament per la forma de les molècules, la força dels enllaços i les masses dels àtoms. Així, la freqüència de les vibracions pot ser associada amb un tipus particular d'enllaç. En tot cas, perquè una forma vibracional en una molècula sigui activa a l'IR, ha d'estar associada amb canvis en el dipol permanent, de manera que molècules simètriques difícilment absorbiran radiació IR.
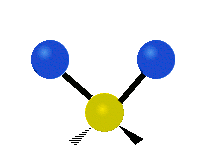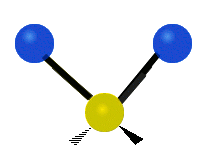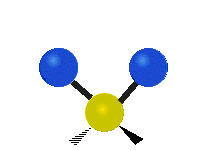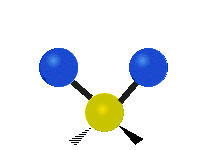
Les molècules diatòmiques simples tenen només un enllaç, que només es pot estirar i encongir. Les molècules més complexes poden tenir molts enllaços, i les diferents formes en les quals vibren es poden combinar, portant a absorcions en l'infraroig a freqüències característiques que poden relacionar-se amb grups químics. Per exemple, els àtoms en un grup CH₂, que es troba en molts compostos orgànics poden vibrar de sis formes diferents, com són estiraments simètrics i asimètrics, flexions simètriques i asimètriques en el pla (tisores i balanceig, respectivament), i flexions simètriques i asimètriques fora del pla (bellugament i torsió, respectivament), com es mostra en els dibuixos a continuació:
 |
 |
 |
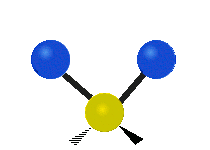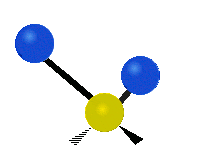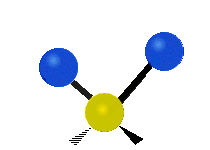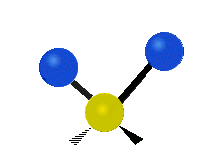 |
 |
 |
Referències
[modifica]- ↑ Abney, W; Festing, E.R Phil. Trans., 172, 1882, pàg. 887.
- ↑ Abney, W; Festing, E.R «Intensity of Radiation through Turbid Media». Proceedings of the Royal Society of London, 40, 1886, pàg. 378–380.
- ↑ Abney, W; Festing, E.R «Colour Photometry. Part III». Proceedings of the Royal Society of London, 50, 1892, pàg. 369–372. DOI: 10.1098/rsta.1892.0014.
- ↑ Julius, W.H Verhandl. Konikl. Acad. Wetenschappen Amsterdam, 1, 1892, pàg. 1.
- ↑ 5,0 5,1 Duerst, R.W; Duerst, M.D; Stebbings, W. «Transmission Infrared Spectroscopy». A: Mirabella, F.M. (ed). Modern techniques in applied molecular spectroscopy. Wiley-IEEE, 1998 (Techniques in analytical chemistry series, vol. 14). ISBN 9780471123590.
- ↑ Coblentz, W.W. Investigations of Infra-Red Spectra. Washington, DC: Carnegie Institution of Washington, 1905.
