Forces de van der Waals
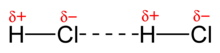
Les forces de van der Waals són forces atractives o repulsives febles entre entitats moleculars, o entre grups dins d'una mateixa entitat molecular, diferents de les de formació d'enllaç químic (covalent, iònic o metàl·lic) o de les interaccions electroestàtiques entre ions o grups d'ions i molècules neutres. Es divideixen en tres tipus:
Les forces de van der Waals són més febles que els enllaços químics que uneixen àtoms en els composts químics. Tanmateix, tenen un paper fonamental en moltes substàncies, per exemple, determinen el caràcter químic dels composts orgànics i la seva solubilitat en dissolvents polars i no polars. Són emprades a molts camps de la ciència i de la tecnologia: química orgànica, química inorgànica, química supramolecular, biologia estructural, ciència dels materials, ciència de les superfícies, nanotecnologia, física de la matèria condensada, etc.
Història
[modifica]El químic holandès Johannes Diderik van der Waals en la seva tesi doctoral sobre la compressió dels gasos descobrí que els gasos reals no seguien el comportament predit per la llei dels gasos ideals. Atribuí el desviament al volum de les molècules de gas, considerades puntuals en els gasos ideals, i a l'existència d'algun tipus de forces intermoleculars,[2] per la qual cosa avui s'anomenen forces de van der Waals.
El 1912 el físic neerlandès Willem Hendrik Keesom, deixeble de van der Waals, presentà un estudi teòric per explicar les interaccions entre molècules polars, això és, les que presenten dipols permanents, com ara el clorur d'hidrogen, HCl,[3] que després amplià en un article el 1921,[4] per la qual cosa aquestes interaccions s'anomenen sovint forces de Keesom.
El científic neerlandès Peter J. W. Debye explicà, per la seva part, les interaccions dipol-dipol induït el 1920,[5] forces entre molècules que presenten un dipol permanent i molècules apolars (Cl₂, CO₂…) Debye imaginà que les molècules podien desplaçar la seva distribució electrònica en l'escorça atòmica en un principi homogènia (esfèrica) per efecte de la interacció d'una molècula dipolar. S'anomenen també forces de Debye.
Les foces més febles, les dipol instantani-dipol induït, foren descrites pels físics alemanys Robert Karl Eisenschitz i Fritz London el 1930.[6][7][8][9] i pel rus Evgenii Mikhailovich Lifshitz.[10][11] Generalment s'anomenen forces de London.
Interaccions dipol-dipol
[modifica]

Són interaccions d'atracció i repulsió entre molècules polars, molècules que tenen un moment dipolar. Si un dipol se situa dintre d'un camp elèctric, intenta orientar-se i alinear-se d'acord amb el gradient del camp. Si el camp és produït per un altre dipol molecular, el dipol s'orientarà de forma que quedin enfrontats els extrems de densitat de càrrega oposada. Hi ha dues maneres, anomenades configuració "cap-cua" i configuració antiparal·lela. Són interaccions direccionals, d'elles depenen l'associació i estructura dels líquids i sòlids polars, com ara el clorur d'hidrogen, HCl. En estat gasós i a temperatures elevades, el moviment dels dipols degut a l'energia tèrmica impedeix una orientació ordenada. És una interacció dèbil que disminueix ràpidament amb la distància (1/r³).
L'energia d'aquesta interacció ve donada per:
on:
- μ1 : moment dipolar del dipol 1.
- μ₂ : moment dipolar del dipol 2.
- ε0 = 8,854·10-12 C²·J-1·m-1 : Permitivitat dielèctrica del buit.
- r : Distància mitjana entre els dipols (m).[12]
Interaccions dipol-dipol induït
[modifica]
Si una molècula amb moment dipolar s'aproxima a una molècula apolar, sense moment dipolar, deformarà el seu nigul electrònic. La polarització de l'espècie neutra dependrà de la seva capacitat de polarització o polaritzabilitat, α, i del moment dipolar, μ, del dipol. és una interacció molt dèbil, a causa del fet que les polaritzabilitats són baixes. Només són importants a distàncies molt curtes, ja que la seva energia depèn d'1/r⁶. La seva importància química es veu limitada a situacions de dissolucions de composts polars en dissolvents apolars. L'energia d'aquesta interacció ve donada per l'equació:
on:
- μ : moment dipolar del dipol.
- α : polaritzabilitat de la molècula apolar.
- r : Distància mitjana entre els dipols (m).[12]
Interaccions dipol instantani-dipol induït
[modifica]
En les molècules apolars es poden produir dipols instantanis com a resultat d'un desequilibri momentani en la distribució electrònica. Aquests dipols instantanis poden induir un dipol en una molècula veïna també inicialment apolar i produir-se una atracció electroestàtica. Són les forces intermoleculars més dèbils, només són eficaces a distàncies molt curtes, ja que depenen d'1/r⁶. Augmenta la seva intensitat amb la massa molecular, car també augmenta el volum molecular i, per tant, la polaritzabilitat de la molècula. L'energia es pot representar per l'equació:
on:
- I : energia d'ionització de les molècules.
- α : polaritzabilitat de les molècules.
- r : Distància mitjana entre els dipols (m).[12]
Aquestes interaccions són importants per explicar la condensació de gasos en líquids i la formació de sòlids de substàncies amb molècules apolars, com ara els gasos nobles, els halògens, el diòxid de carboni, l'oxigen i el nitrogen.
Referències
[modifica]- ↑ McNaught, A.D.; Wilkinson, A. IUPAC. Compendium of Chemical Terminology, the "Gold Book" (en anglès). 2a edició. Oxford: Blackwell Scientific Publications, 1997. DOI 10.1351/goldbook.V06597. ISBN 0-9678550-9-8 [Consulta: 11 novembre 2030].
- ↑ Van der Waals, J.D «Over de Continuiteit van den Gas- en Vloeistoftoestand». Tesi doctoral Universitat de Leiden, 1873.
- ↑ Keesom, W.H Proc. K. Akad. Wetenschappen Amsterdam, 15, 1912, pàg. 417.
- ↑ Keesom, W.H «Die van der waalsschen Kohäsionskräfte». Physikalische Zeitschrift, 22, 129-41, 1921, pàg. 643-644.
- ↑ Debye, P.J.W «Die van der Waalsschen Kohäsionskräfte». Physikalische Zeitschrift, 21, 1920, pàg. 178-187.
- ↑ Eisenschitz, R; London, F «Über das Verhältnis der van der Waalsschen Kräfte zu den homöopolaren Bindungskräften» (en alemany). Zeitschrift für Physik A Hadrons and Nuclei, 60, 1930, pàg. 491–527. DOI: 10.1007/BF01341258.[Enllaç no actiu]
- ↑ London, F «Zur Theorie und Systematik der Molekularkräfte» (en alemany). Zeitschrift für Physik A Hadrons and Nuclei, 63, 3-4, 1930, pàg. 245-279. DOI: 10.1007/BF01421741.[Enllaç no actiu]
- ↑ London, F «Über einige Eigenschaften und Anwendungen der Molekularkräften» (en alemany). Zeitschrift für Physikalische Chemie, B11, 1930, pàg. 222-251.
- ↑ London, F «The general theory of molecular forces». Transactions of the Faraday Society, 33, 0, 1937, pàg. 8b-26. DOI: 10.1039/TF937330008B.
- ↑ Lifshitz, E.M J. Expl. Theor. Phys. USSR, 29, 1955, pàg. 94.
- ↑ Lifshitz, E.M «The Theory Of Molecular Attractive Forces Between Solids». J. Expl. Theor. Phys. USSR, 2, 1956, pàg. 73-83.
- ↑ 12,0 12,1 12,2 Huheey, J.E. Química Inorgànica. Principios de estructura y reactividad. México: Harla, 1981. ISBN 968-6034-13-7.



