Proti
| Aquest article tracta sobre la física de l'àtom d'hidrogen. Si cerqueu la química de l'hidrogen, vegeu «hidrogen». |
 | |
| Nombre màssic | 1 |
|---|---|
| Símbol | ¹H |
| Neutrons | 0 |
| Protons | 1 |
| Abundància natural | 0,999885 |
| Massa isotòpica | 1,00782503224 Da |
| Espín | 0,5 |
| Energia d'enllaç | 0 |
| Paritat | 1 |
| Productes de desintegració | cap valor |
| Sèrie | |
deuteri | |
El proti, o ¹H, és un àtom de l'element hidrogen. És l'isòtop més comú de l'hidrogen. És estable. Està compost d'un únic electró amb càrrega negativa voltant el nucli, amb una sola càrrega positiva, de l'àtom d'hidrogen. A diferència de la resta d'elements químics, els isòtops de l'hidrogen s'anomenen d'una manera específica: així es parla de proti (H), fent referència a l'isòtop més comú, compost per un sol protó; de deuteri, isòtop que conté un protó, i un neutró; o de triti, que té un neutró més que el deuteri. El nucli de l'hidrogen-1 només té un únic protó. També pot contenir un o més neutrons (en aquest cas parlaríem de deuteri, triti, o altres isòtops). L'electró està lligat al nucli per la força de Coulomb.
L'àtom d'hidrogen té una significació especial en mecànica quàntica i teoria de camps quàntics com un sistema físic que forma un problema de dos cossos simple en el que ha produït moltes solucions simples analítiques en forma tancada.
L'any 1913, Niels Bohr obtingué les freqüències espectrals de l'àtom d'hidrogen després de fer una sèrie de suposicions simplificadores. Aquestes suposicions no eren completament correctes, però donaren per resposta l'energia correcta (vegeu: Model atòmic de Bohr). Els resultats de Bohr per les freqüències i els valors de les energies subjacents fou confirmat per a completa anàlisi mecànica-quàntica que usa l'equació de Schrödinger, com es mostra en el bienni 1925/26. La solució de l'equació de Schrödinger per l'hidrogen és analítica. A partir d'aquesta solució, es poden calcular els nivells d'energia de l'hidrogen i, per tant, les freqüències de les línies espectrals de l'hidrogen. La solució de l'equació de Schrödinger va més enllà que el model de Bohr de totes maneres, perquè proporciona la forma de la funció d'ona ("òrbita") de l'electró per als diferents estats mecànics quàntics possibles—per tant explica el caràcter anisotròpic dels lligams atòmics.
L'equació de Schrödinger també s'aplica a àtoms més complicats i molècules, de totes maneres, en la majoria d'aquests casos la solució no és analítica i o bé és necessari fer càlculs amb un ordinador, o bé assumir solucions simplificades.
La solució de l'equació de Schrödinger: revisió dels resultats
[modifica]La solució de l'equació de Schrödinger per l'àtom d'hidrogen parteix del fet que el potencial de Coulomb produït pel nucli és isotròpic (és radialment simètric en l'espai i només depèn de la distància al nucli). De totes maneres les funcions pròpies de l'energia (els "orbitals") no són necessàriament isotròpiques per elles mateixes, La seva dependència de les coordenades angulars depèn completament i en la seva generalitat de la isotropia del potencial subjacent: Els estats propis del hamiltonià (=energia dels estats propis) poden ser escollits com a estats propis simultanis de l'operador de moment angular.
Això correspon al fet que el moment angular es conserva en el moviment orbital de l'electró entorn del nucli. Per consegüent, l'energia dels estats propis pot ser classificada segons dos nombres quàntics de moment angular, l i m (nombres enters). El nombre quàntic del "moment angular" l = 0, 1, 2, ... determina la magnitud del moment angular. El nombre quàntic "magnètic" m = −l, .., +l determina la projecció del moment angular sobre un l'eix z (escollit arbitràriament).
Per afegiment a les expressions matemàtiques pel moment angular i la projecció del moment angular de funcions d'ona, es pot trobar una expressió per la dependència radial de les funcions d'ona. És només aquí que els detalls de potencial de Coulomb 1/r entren (portant als polinomials de Laguerre en r). Això porta a un tercer nombre quàntic, el nombre quàntic principal n = 1, 2, 3, ... El nombre quàntic principal de l'hidrogen està relacionat amb l'energia total de l'àtom.
El valor màxim del nombre quàntic del moment angular està limitat pel nombre quàntic principal: només pot arribar fins a n − 1, i. e. 1 = 0, 1, ..., n − 1.
A causa de la conservació del moment angular, els estats del mateix l però diferent m té la mateixa energia (això és vàlid per tots els problemes amb simetria rotacional). A més a més, per l'àtom d'hidrogen, els estats del mateix n però diferent l són també degenerats (això és, poden tenir la mateixa energia). De totes maneres això és una propietat específica de l'hidrogen i no es manifesta en els àtoms més complicats que tenen un potencial (efectiu) diferent de la forma 1/r (a causa de la presència dels electrons interiors que apantallen el potencial del nucli).
Tenint en compte l'espín de l'electró afegit al darrer nombre quàntic, la projecció del moment angular de l'espín de l'electró al llarg de l'eix z, pot prendre dos valors.
Per tant, qualsevol estat propi de l'electró en l'àtom d'hidrogen es pot descriure per quatre nombres quàntics. D'acord amb les normes usuals de la mecànica quàntica, l'estat real de l'electró pot ser qualsevol superposició d'aquests estats. Això explica també perquè l'elecció de l'eix z per la quantització direccional del vector del moment angular és insignificant: Un orbital dat l i m' obtingut per un altre eix z' preferit pot sempre ser representat com a superposició apropiada dels diferents estats de diferents m (però el mateix l) que han estat obtinguts per z.
Sumari matemàtic dels estats propis de l'àtom d'hidrogen
[modifica]Els nivells d'energia de l'hidrogen, incloent-hi l'estructura fina venen donats per
on
- és la constant d'estructura fina
- j és un enter que és el valor propi del moment angular
El valor de -13,6 eV pot ser trobat de simple model de Bohr, i està relacionat amb la massa, m, i la càrrega de l'electró, q:
inclús de forma més elegant està connectat amb la constant d'estructura fina
Funció d'ona
[modifica]La funció d'ona de posició normalitzada, donada en coordenades esfèriques és:
on:
- és el radi de Bohr.
- són els polinomials de Laguerre generalitzats de grau n-l-1.
- és un harmònic esfèric.
Moment angular
[modifica]Els valors propis de l'operador de moment angular:
Visualitzant els orbital de l'electró de l'hidrogen
[modifica]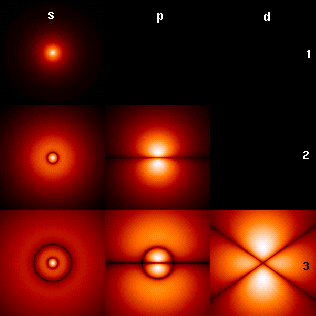
La imatge de le dreta mostra els primers orbitals de l'àtom de l'hidrogen (funcions pròpies d'energia). Són representacions de la densitat de probabilitat que han estar codificades per colors (negre=zero densitat, blanc=màxima densitat). El nombre quàntic de moment angular l es mostra a cada columna, usant el codi de lletres usual en espectroscòpia ("s" significa l = 0; "p": l = 1; "d": l = 2). El nombre quàntic principal n (=1, 2, 3, ...) està marcat a la dreta de cada filera. Per tots el dibuixos el nombre quàntic magnètic m ha estat posat a 0, i el pla de la secció és el pla- xz (z és l'eix vertical). La densitat de probabilitat en un espai de tres dimensions es pot obtenir rotant la imatge mostrada aquí al voltant de l'eix- z.
L'estat fonamental, és a dir, l'estat de més baixa energia, en el que l'electró es troba usualment, és el primer, el "1s" estat (n = 1, l = 0).
Es pot aconseguir una imatge amb més orbitals (fins als nombres n i l més alts).
És de destacar el nombre de línies negres que es produeixen en cada fila, però no en el primer orbital. Això són "línies nodals" (que són realment superfícies nodals en tres dimensions). El seu nombre total és sempre igual a n-1, que és la suma del nombre de nodes radials (igual a n-l-1) i el nombre de nodes angular (igual a l).
Més enllà de la solució de Schröndinger
[modifica]Hi ha molts d'efectes importats que no han s'han tingut en compte per l'equació de Schrödinger i que són responsables de certes petites però mesurables desviacions de les línies espectrals reals respecte a les prediccions.
- Si bé la rapidesa de l'electró a l'hidrogen és només 1/137 de la rapidesa de la llum hi ha un augment del moment de l'electró que no és completament lineal amb la velocitat, com es prediu per la relativitat especial. La massa relativista de l'electró es pot dir que augmenta. Com que la longitud d'ona de l'electró es determina pel seu moment, els orbitals que contenen electrons que abasten altes rapideses mostren contraccions diferencials a causa d'una longitud d'ona més curta. Per elements amb nombre atòmic Z més elevat, aquest efecte és més pronunciat, i especialment pels electrons s, que es mouen a velocitats relativistes, ja que es fan endins els electrons que apantallen el nucli dels àtoms de Z elevat. Aquesta massa relativista posada en marxa pels electrons causa una contracció dels orbitals 6s relativa als orbitals 5d (en comparació als corresponents electrons s i d dels elements més lleugers en la mateixa columna de la taula periòdica); això dona per resultat que els electrons de valència 6s esdevenen d'energia menor. Exemples de resultats físics significatius d'aquest efecte poden ser la baixa temperatura de fusió del mercuri (que és el resultat de què els electrons 6s no que estan disponibles per fer sòlid el metall) i el color daurat de l'or i del cesi (per causa de l'angosta transició de l'energia dels 6s als 5d fins al punt que la llum visible és absorbida). Vegeu [1] i [2] Arxivat 2007-09-26 a Wayback Machine.).
- Inclús quan no hi ha un camp magnètic extern, en el sistema inercial de l'electró que es mou, el camp electromagnètic del nucli té un component magnètic. L'espín de l'electró té un moment magnètic associat que interacciona amb el camp magnètic. Aquest efecte s'explica també per la relativitat especial, i porta a l'anomenat acoblament espín-òrbita, això és, una interacció entre els moviments orbitals de l'electró voltant el nucli, i el seu espín.
Aquests dos fets (i altres) han estat incorporats per l'equació de Dirac, amb prediccions molt pròximes als resultats dels experiments. També l'equació de Dirac pot ser resolta analíticament en el cas especial del sistema de dos cossos, com en el cas de l'àtom d'hidrogen. Els estats quàntics de la solució resultant ara poden ser classificats pel nombre de moment angular total j (que prové de l'acoblament entre l'espín de l'electró i el moment angular orbital). Els estats del mateix j i el mateix n són encara degenerats.
- Hi ha sempre les fluctuacions del buit del camp electromagnètic, d'acord amb la mecànica quàntica. Degut en aquestes fluctuacions de degeneració entre estats del mateix j però diferent l és eliminat, donant-los energies lleugerament diferents. Això ha estat demostrat en el famós experiment de Lamb-Retherford i fou el punt de començament del desenvolupament de la teoria de l'electrodinàmica quàntica (que és capaç de tractar amb aquestes fluctuacions del buit i utilitza els famosos diagrames de Feynman per fer aproximacions usant la teoria pertorbativa). Aquest efecte s'anomena avui desplaçament de Lamb.
Per aquest desenvolupaments, és essencial que la solució de l'equació de Dirac per l'àtom d'hidrogen pugui donar resultats exactes, car qualsevol desviació experimental observada hauria de ser presa com un senyal seriós de fallada de la teoria.
A causa de l'alta precisió de la teoria també es necessita una alta precisió dels experiments, que usen una pinta de freqüència.
Vegeu també
[modifica]- Hidrogen
- mecànica quàntica
- Qímica quàntica
- Teoria dels camps quàntics
- Estat quàntic
- Justificació teòrica i experimental de l'equació de Schrödinger
| (no n'hi ha) | Isòtops de Hidrogen | Hidrogen-2 |
| Produced from: Vegeu emissió d'un protó |
Cadena de desintegració | Desintegració en: Estable |
Referències
[modifica]- Griffiths, David J. Introduction to Quantum Mechanics. Upper Saddle River, NJ: Prentice Hall, 1995. ISBN 0-13-111892-7.
Section 4.2 deals with the hydrogen atom specifically, but all of Chapter 4 is relevant.
- Bransden, B.H.; C.J. Joachain. Physics of Atoms and Molecules. London: Longman, 1983. ISBN 0-582-44401-2.
Enllaços externs
[modifica]- L'espectre de l'àtom d'hidrogen Arxivat 2009-12-22 a Wayback Machine. (català)
- El model de Bohr Arxivat 2007-09-29 a Wayback Machine. (català)





![{\displaystyle \psi _{nlm}(r,\theta ,\phi )={\sqrt {{\left({\frac {2}{na_{0}}}\right)}^{3}{\frac {(n-l-1)!}{2n[(n+l)!]}}}}e^{-\rho /2}\rho ^{l}L_{n-l-1}^{2l+1}(\rho )\cdot Y_{l,m}(\theta ,\phi )}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0c69d0a09aeb218e5e747d2938e58602e7661ece)





