Histopatologia
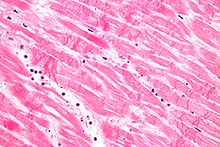
La histopatologia (mot compost per tres mots grecs: ἱστός histos "teixit", πάθος pathos "patiment o dany", i -λογία -logia "estudi de") es refereix a l'observació al microscopi de cèl·lules i teixits afectats per una malaltia.[1]
Més en concret, en el camp de la medicina clínica, el terme histopatologia fa referència a l'examen d'una biòpsia per un patòleg, un cop la mostra ha estat processada (tractaments amb productes químics, realització de seccions primes de teixit i col·locació en un portaobjectes per al posterior estudi).[2] En canvi, la citopatologia examina cèl·lules aïllades o petits blocs de cèl·lules provinents de teixits o exsudats.[3]
Recol·lecció dels teixits
[modifica]El primer pas abans de l'examinació histopatològica dels teixits comença amb una intervenció quirúrgica, una biòpsia o una autòpsia.[4] Es retira el teixit de la persona, animal o planta, i a continuació, sovint després d'una delicada dissecció de la mostra en fresc a mans d'un expert, s'hi afegeix un fixador químic per prevenir la descomposició química de la mostra. Els fixadors més comuns són la formalina (formaldehid al 10% en agua tamponada).[5]
Preparació de les mostres per histologia
[modifica]Un cop preservat, el teixit es prepara per a l'observació al microscopi. Es pot fer servir una fixació química, o bé fer servir una secció congelada. Si es disposa d'una mostra relativament gran, per exemple provinent d'una intervenció quirúrgica, llavors un patòleg inspecciona la mostra i selecciona la part més adient de cara a un bon diagnòstic. Aquesta part es retira per a ser examinada. La mostra pot tallar-se en fragments més petits que encaixin en el recipient adequat. Algunes mostres, especialment les biòpsies, poden ser embegudes en agar o en un altre polímer per facilitar l'acció de tallar-les i permetre la desitjada exposició de les seves estructures histològiques.[5] La resina epoxi s'utilitza, per exemple, en teixits destinats a ser observats amb MET,[6] fragments ossis sense descalcificar[7] o a l'hora de preparar els cilindres de moll d'os obtinguts mitjançant un tròcar.[8]
Fixació química
[modifica]A més de la formalina, també es poden fer servir altres fixadors químics.[9] No obstant, amb l'adveniment del marcatge amb immunohistoquímica i del diagnòstic mitjançant procediments biomoleculars com a tècniques per l'anàlisi de les mostres, l'aplicació de formalina ha esdevingut el tractament químic de fixació estàndard en el diagnòstic histopatològic en humans.[10] Si les mostres són petites, els temps de fixació són més petits. Quan són molt delicades pot emprar-se alcohol de 70° o glutaraldeid. Existeixen protocols estàndard que estableixen la duració en cada cas.[5]
Processament de les mostres
[modifica]Per deshidratar les mostres, se sotmeten a successius tractaments amb concentracions creixents d'etanol.[11] En la darrera fase de deshidratació es fa servir xilè en lloc d'etanol, ja que la cera que es farà servir més endavant és soluble en xilè i no en etanol. Amb això, es facilita la seva infiltració en la mostra i s'eviten canvis artefactuals.[12] Aquest procediment és generalment automàtic, i es porta a terme durant tota una nit. Llavors se situa la mostra en un petit contenidor, al qual s'hi afegeix parafina líquida. Un cop refredada aquests, s'ha aconseguit un bloc sòlid que permetrà una orientació adequada en l'obtenció de seccions molt primes amb un micròtom.[11]
A partir del bloc sòlid amb la mostra embeguda en parafina, se'n tallen seccions i se situen en un bany d'aigua perquè s'estenguin completament. Per aquest procés calen les mans acurades de personal especialitzat, que també ha de prendre decisions sobre quines parts de la mostra són les millors per ésser analitzades posteriorment al microscopi. Habitualment, es preparen diverses mostres que ocupen un bon gruix del bloc de parafina per si cal revisar-les o efectuar tincions especials.[13] És llavors quan es munten aquestes seccions primes en un portaobjectes, es tenyeixen i es protegeixen amb un cobreobjectes. Amb la majoria de colorants, el procediment de tinció és automàtic, però si el colorant és poc freqüent, pot precisar-se un protocol a mà.[11]
Processament de les seccions congelades
[modifica]El segon mètode histològic de processament fa servir com a material de partida seccions de mostres congelades. És un mètode delicat, en què s'empra un micròtom a l'interior d'un criostat (un aparell que mantè la temperatura sota zero), amb l'objectiu de mantenir tant el texit com les seccions congelades durant tot el procés.[14] Una vegada incloses formant un bloc homogeni fent servir un material adequat (OCT, CBS o Cryogel), les mostres es tallen en làmines primes amb el micròtom, es monten en un portaobjectes, es fixen immediatament i molt ràpid en un líquid de fixació, i es tenyeixen seguint un procés similar al tractament de les seccions que venen de mostres embegudes en parafina.[15] Els avantatges d'aquest mètode és la rapidesa en processar la mostra, que es precisa menys equipament i que no cal una bona ventilació del laboratori (la formalina és volàtil i tòxica). El major desavantaje és que la qualitat de les seccions finals sol ser menor.[16] Es fa servir, per exemple, en diagnòstics durant una operació, en els quals la velocitat és vital per poder prendre una decisió sobre quin serà el següent pas en la intervenció d'un pacient (per exemple, per determinar si els marges de l'extirpació d'un tumor contenen o no cèl·lules tumorals).[17]
Tinció de les seccions histològiques processades
[modifica]Les mostres, tant si han estat fixades químicament com si són seccions congelades, es sotmeten a una tinció amb un o més pigments, abans de ser observades al microscopi, amb l'objectiu de revelar els components cel·lulars. Es fan servir també contratincions com a contrast. Els pigments més comuns són una combinació d'hematoxilina i eosina (abreujades sovint com tinció d'H&E). L'hematoxilina tenyeix els nuclis cel·lulars en blau, mentre que l'eosina marca el citoplasma i la matriu de teixit connectiu extracel·lular en rosa. Hi ha moltes més tècniques de tinció selectiva de cèl·lules, en què es fan servir colorants com safranina, oli vermell O,[18] vermell congo,[19] tetraòxid d'osmi,[20] sals de plata i mescles de colorants artificials elaborades amb propòsits específics.
La Histoquímica es refereix a la utilització de compostos químics per produir reaccions químiques a l'interior d'un teixit. Una tècnica d'histoquímica que es fa servir habitualment és la reacció del blau de Prússia (tinció de Perls), que permet mostrar la presència de dipòsits de ferro en malalties com l'hemocromatosi.[21]
Recentment, s'han fet servir anticossos per marcar determinades proteïnes, lípids o carbohidrats. Aquesta tècnica s'anomena immunohistoquímica, i ha aconseguit augmentar enormement la capacitat d'identificar de manera específica determinades categories de cèlules amb l'ajut d'un microscopi. Altres tècniques avançades inclouen la hibridació in situ per identificar seqüències específiques a les molècules d'ADN o ARN.[22] Aquests mètodes de tinció amb anticossos sovint requereixen l'ús de mostres histològiques congelades. I en totes aquestes tècniques avançades, es necessita personal de laboratori amb una experiència específica. A més, es fan servir càmares digitals per la captura de les imatges observades al microscopi.[23]
Interpretació
[modifica]Les seccions histològiques les examina al microscopi un anatomopatòleg, que és un especialista mèdic qualificat. El seu diagnòstic mèdic es formula com un informe patològic que descriu les observacions histològiques i l'opinió del professional. En el cas de mostres de pacients amb càncer, cal indicar si els límits al voltant del tumor extret estan lliures o no de cèl·lules canceroses, per assegurar l'extracció total del teixit afectat.[24]
Referències
[modifica]- ↑ «Histopatología» (en castellà). Diccionario de càncer, Instituto Nacional del Cáncer de EE. UU.. [Consulta: 20 agost 2018].
- ↑ Ponsoda Martí, Xavier. Pràctiques de Citologia i Histologia. València: Universitat de València, 2000, p. 224. ISBN 84-370-4702-1.
- ↑ «Cytology». A: Collection Development Guidelines of the National Library of Medicine -Internet-. Bethesda (MD): National Library of Medicine, National Institutes of Health, U.S. Department of Health and Human Services; 2019-, 2003 Oct 29; NBK518827 (rev).
- ↑ Lau, G; Lai, SH «Forensic Histopathology» (en anglès). Forensic Pathology Reviews, 2008; 5, pp: 239–265. DOI: 10.1007/978-1-59745-110-9_13. PMC: 7122801 [Consulta: 6 abril 2021].
- ↑ 5,0 5,1 5,2 Orchard, Guy; Nation, Brian. «What is Histopathology?». A: Histopathology (en anglès). Nova York: Oxford University Press, 2012, p. 396. ISBN 978-0-19-957434-6.
- ↑ Megías M, Molist P, Pombal MA «Inclusión en resina» (en castellà). A: Atlas de histología vegetal y animal: Técnicas histológicas. Facultad de Biología, Universidad de Vigo, 2020; Gen 24 (rev), pàgs: 3 [Consulta: 29 abril 2021].
- ↑ García-Donas, JG; Dalton, A; Chaplin, I; Kranioti, EF «A revised method for the preparation of dry bone samples used in histological examination: Five simple steps» (en anglès). Homo, 2017 Ag; 68 (4), pp: 283-288. DOI: 10.1016/j.jchb.2017.07.001. ISSN: 1618-1301. PMID: 28764853 [Consulta: 30 abril 2021].
- ↑ Krenacs, T; Bagdi, E; Stelkovics, E; Bereczki, L; Krenacs, L «How we process trephine biopsy specimens: epoxy resin embedded bone marrow biopsies» (en anglès). J Clin Pathol, 2005 Set; 58 (9), pp: 897-903. DOI: 10.1136/jcp.2004.023788. PMC: 1770834. PMID: 16126867 [Consulta: 30 abril 2021].
- ↑ Singh, H; Bishen, KA; Garg, D; Sukhija, H; et al «Fixation and Fixatives: Roles and Functions — A Short Review» (en anglès). Dent J Adv Stud, 2019 Ag; 07 (02), pp: 051-055. DOI: 10.1055/s-0039-1693098. ISSN: 2321-1482 [Consulta: 6 abril 2021].
- ↑ Howat, WJ; Wilson, BA «Tissue fixation and the effect of molecular fixatives on downstream staining procedures» (en anglès). Methods, 2014 Nov; 70 (1), pp: 12-19. DOI: 10.1016/j.ymeth.2014.01.022. PMC: 4240801. PMID: 24561827 [Consulta: 6 abril 2021].
- ↑ 11,0 11,1 11,2 «Welcome mwap.co.uk - Justhost.com». Arxivat de l'original el 2016-08-13. [Consulta: 20 agost 2018].
- ↑ Lerch, ML; Bauer, DR; Theiss, A; Chafin, D; et al «Monitoring Dehydration and Clearing in Tissue Processing for High-Quality Clinical Pathology» (en anglès). Biopreserv Biobank, 2019 Ag; 17 (4), pp: 303-311. DOI: 10.1089/bio.2018.0122. PMC: 6703239. PMID: 31107113 [Consulta: 23 març 2021].
- ↑ DiaPath «Special Stains Handbook» (en anglès). DIAPATH S.p.A., 2013; Mar 1 (rev), pàgs: 66 [Consulta: 23 març 2021].
- ↑ Brender, E; Burke, A; Glass, RM «Frozen section biopsy» (en anglès). JAMA, 2005 Des 28; 294 (24), pp: 3200. DOI: 10.1001/jama.294.24.3200. ISSN: 1538-3598. PMID: 16380598 [Consulta: 23 març 2021].
- ↑ Wallace, J «Frozen section procedure» (en anglès). Methods (molecular, IHC, frozen). PathologyOutlines, 2020; Des 23 (rev), pàgs: 5. Arxivat de l'original el 18 de gener 2021 [Consulta: 6 abril 2021]. Arxivat 18 de gener 2021 a Wayback Machine.
- ↑ Peters, S «The Art of Frozen Tissue Sectioning» (en anglès). Knowledge Pathway Tutorial, Leica Biosystems, 2020; Jun (rev), pàgs: 13 [Consulta: 6 abril 2021].
- ↑ Derek C Allen. Histopathology Reporting: Guidelines for Surgical Cancer. Springer Science & Business Media, 29 juny 2013. ISBN 978-1-4471-3671-2.
- ↑ Ellis, R «Oil Red O Staining Protocol» (en anglès). Protocol Database. IHC World, 2011, pàgs: 3 [Consulta: 21 març 2021].
- ↑ PubChem «Congo red» (en anglès). Compound Summary. NCBI, US National Library of Medicine, 2021 Mar 17; CID 11313 (rev), pàgs: 43 [Consulta: 21 març 2021].
- ↑ Zrihan, O «Osmium Tetroxide Staining for Cells» (en anglès). QuantomiX, 2005 Jun 20; QXP005 V1.0, pàgs: 2. Arxivat de l'original el 18 d’abril 2021 [Consulta: 21 març 2021].
- ↑ Parry, N «Prussian Blue- A Histology Stain For Iron» (en anglès). Bitesize Bio, 2013; Maig 7, pàgs: 3 [Consulta: 23 març 2021].
- ↑ Jensen, E «Technical review: In situ hybridization» (en anglès). Anat Rec (Hoboken), 2014 Ag; 297 (8), pp: 1349-1353. DOI: 10.1002/ar.22944. ISSN: 1932-8494. PMID: 24810158 [Consulta: 23 març 2021].
- ↑ Hayat, M.A.. Handbook of Immunohistochemistry and in situ Hybridization of Human Carcinomas: Molecular Genetics, Gastrointestinal Carcinoma, and Ovarian Carcinoma, Vol. 4. Elsevier Science, 23 maig 2006, p. 282. ISBN 978-0-08-045787-1.
- ↑ Damjanov, Ivan. Atlas of Histopathology (en anglès). 1a Ed. New Delhi (India): Jaypee Brothers Medical Publishers, 2012, p. 399. ISBN 978-93-5025-188-1.
Bibliografia
[modifica]- Slaoui, Mohamed; Fiette, Laurence. Histopathology Procedures: From Tissue Sampling to Histopathological Evaluation (en anglès). Methods in molecular biology (Clifton, N.J.), 2011 Gen; 691 (Chap. 4), pp: 69-82. PMID: 20972747. DOI 10.1007/978-1-60761-849-2_4 [Consulta: 1r abril 2021].
- Suvarna, S. Kim; Layton, Christopher; Bancroft, John D. Bancroft’s Theory and Practice of Histological Techniques (en anglès). Elsevier Limited, 2019; 8th Edition, pàgs: 572. ISBN 978-0-7020-6864-5 [Consulta: 6 abril 2021]. Arxivat 7 August 2021[Date mismatch] a Wayback Machine.
- Bauer, Thomas W.; Behling, Cynthia; Miller, Dylan V.; Chang, Bernard S.; et al Precise Identification of Cell and Tissue Features Important for Histopathologic Diagnosis by a Whole Slide Imaging System (en anglès). J Pathol Inform, 2020 Feb 6; 11, pp: 3. PMID: 32154040. DOI 10.4103/jpi.jpi_47_19 [Consulta: 29 abril 2021].
Enllaços externs
[modifica]- Histology World Bellham, S. 2016 Oct (en anglès)
- Histopathology LabsforLifeProject. 2018 Jun (en anglès)
- Histopathologic Techniques Ricare, MSD. 2018 Jul (en anglès)
- What is a Histopathologist? The Royal College of Pathologists. 2018 Nov (en anglès)
- Histopatología: Definición e Historia Peralta, J. 2020 Gen (en castellà)
