Empalmament alternatiu
|
|
Aquest article o secció necessita millorar una traducció deficient. |
L'empalmament alternatiu (empalmament diferencial) és un procés mitjançant el qual els exons de l'ARN que es produeixen per la transcripció genètica (una transcripció gènica primària o pre-RNAm) es tornen a connectar de moltes maneres durant l'empalmament de l'ARN. Els diferents ARNm resultants poden traduir-se en diferents isoformes de la proteïna. Per tant, un sol gen pot «r múltiples proteïnes.[1]
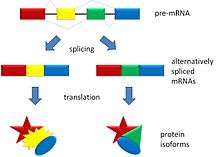
L'empalmament alternatiu es presenta com un fenomen normal en les cèl·lules eucariotes, on s'incrementa en gran manera la diversitat de les proteïnes que poden ser codificades pel genoma.[1] En els éssers humans, un 95% dels gens multiexònics són empalmats alternativament.[2] S'han observat nombroses formes d'empalmament alternatiu, de les quals la més comuna és l'omissió de l'exó. En aquest procés, un exó en particular pot ser inclòs en el ARNm sota certes condicions o en determinats teixits, i omès en l'ARNm en situacions diferents.[1] La producció d'ARNm d'empalmament alternatiu està regulada per proteïnes d'acció trans unides a zones d'acció cis del mateix ARNm. Aquestes proteïnes inclouen activadors d'empalmament que promouen la utilització d'un lloc d'acoblament en particular i repressors d'empalmament que redueixen l'ús d'un altre lloc en particular. Els mecanismes d'empalmament alternatiu són molt variables, i contínuament se'n troben nous exemples, especialment a través de la utilització de tècniques d'alt rendiment. Els investigadors esperen dilucidar plenament els sistemes reguladors que participen en l'empalmament, per poder predir els productes d'empalmament alternatiu d'un determinat gen en unes determinades condicions amb un “codi d'acoblament».[3][4] Les variacions anormals en l'empalmament estan implicades en l'aparició de malalties, ja que són causa d'una gran part dels trastorns genètics humans.[3] També es possible que aquestes variacions anormals en l'empalmament contribueixin al desenvolupament de càncer,[5][6][7] encara que tals productes anormals d'empalmament són generalment salvaguardats i eliminats per un mecanisme de control de qualitat posttranscripcional.[8]
Descobriment
[modifica]L'empalmament alternatiu es va observar per primera vegada el 1977.[9][10] Els adenovirus produeixen dos transcripcions primàries diferents, una al principi del cicle de vida i una més tard, després de la replicació de l'ADN. Els investigadors van trobar que la transcripció primària d'ARN produïda per adenovirus tipus 2 en l'última fase era «tallada» de diverses maneres, donant lloc a varios ARNm que codificaven proteïnes virals diferents. Tant el lloc d'acoblament 3′ com el 5′ variaven i, a més, la transcripció contenia diversos llocs de poliadenilació, donant diferents extrems 3′ als ARNm processats.[11][12][13] El 1981 va ser caracteritzat el primer exemple d'empalmament alternatiu en la transcripció d'un gen normal i endogen.[11] Es va trobar que el gen que codifica l'hormona tiroidal calcitonina era «tallat» alternativament en cèl·lules de mamífers. El pre-mRNA d'aquest gen conté 6 exons, mentres que l'ARNm de la calcitonina conté els exons 1-4, i acaba després d'un lloc de poliadenilació en l'exó 4. També es produeix un altre ARNm diferent a partir d'aquest pre-ARNm per l'omissió de l'exó 4, que inclou els exons 1-3, 5 i 6. Aquest ARNm codifica una proteïna coneguda com a CGRP (pèptid relacionat amb el gen de calcitonina).[14][15] També es van observar exemples d'empalmament alternatiu a les transcripcions de gens d'immunoglobulines en els mamífers a la dècada del 1980.[11][16] Des de llavors, s'ha descobert que l'empalmament alternatiu és un procediment present en totes les cèl·lules eucariotes.[1] El «rècord» d'empalmament alternatiu és un gen de Drosophila melanogaster anomenat DSCAM, que podria tenir 38.016 variants d'acoblament.[17]
Formes d'empalmament alternatiu
[modifica]
Generalment es reconeixen cinc formes diferents d'empalmament.[1][2][3][18]
- L'omissió d'exó o exons casset: en aquest cas, un exó pot ser tallat de l'ARN original o retingut a la cadena. Aquesta és la manera més comuna d'empalmament als pre-ARNm dels mamífers.[18]
- Exons mútuament excloents: solament un dels dos exons es manté en l'ARNm després de l'empalmament, però mai els dos a l'hora.
- Lloc donant alternatiu: s'utilitza una unió 5′ (lloc donant) diferent, canviant l'extrem 3′ de l'exó upstream.
- Lloc acceptor alternatiu: s'utilitza una unió 3′ (lloc acceptor) diferent, canviant l'extrem 5′ de l'exó downstream.
- Retenció d'intró: una seqüència pot ser tallada com un intró o simplement retinguda. Això es distingeix de l'omissió d'exó perquè la seqüència retinguda no es troba flanquejada per introns. Si l'intró retingut és a la zona de codificació, l'intró ha de codificar els aminoàcids amb els exons veïns, o un codó de parada o un canvi en el marc de lectura farà que la proteïna no sigui funcional. Aquesta és la manera més rara d'empalmament en els mamífers.[18]
A més d'aquestes formes principals d'empalmament alternatiu, hi ha dos mecanismes principals pels quals es poden generar diferents ARNm a partir d'un mateix gen: els promotors múltiples i múltiples llocs de poliadenilació. L'ús de promotors múltiples es descriu més aviat com un mecanisme de regulació transcripcional que no d'empalmament alternatiu, ja que. al començar la transcripció d'ADN a ARNm en diferents punts (promotors), es poden generar la majoria dels exons (transcripcions amb diferents extrems 5′). D'altra banda, els diversos llocs de poliadenilació permeten obtenir diferents punts 3' finals per a la transcripció. Aquests dos mecanismes es troben combinats amb l'empalmament alternatiu i proporcionen encara més varietat als ARNm derivats d'un gen.[1][3]
Aquestes formes descriuen els mecanismes bàsics d'empalmament, però poden ser inadequats per descriure els esdeveniments més complexes. Per exemple, la figura de la dreta mostra tres formes del gen 3-hialuronidasa del ratolí. Al comparar l'estructura exònica de la primera línia (verda) amb la segona (groga), es veu una retenció d'intró, mentre que la comparació entre la segona i la tercera forma (groc i blau) mostra omissió d'exó. Es va proposar un model de nomenclatura única per designar tots els patrons possibles d'empalmament.[18]
Al comparar l'estructura exònica de la primera línia (verda) amb la segona (groga), es veu una retenció d'intró, mentre que la comparació entre la segona i la tercera forma (groc i blau) mostra omissió d'exó. Es va proposar un model de nomenclatura única per designar tots els patrons possibles d'empalmament.[18]
Mecanismes d'empalmament alternatiu
[modifica]Mecanisme general d'entroncament
[modifica]
Quan el pre-ARNm s'ha transcrit a partir de l'ADN, inclou diversos introns i exons. (En els nematodes, la mitjana és de 4-5 exons i introns, mentre que amb la mosca del vinagre Drosophila hi pot haver més de 100 exons i introns en un pre-mRNA.) Durant el procés d'empalmament es determina quins exons s'han de mantenir a l'ARNm. La regulació i la selecció dels llocs d'acoblament són dutes a terme per proteïnes d'acció trans, tant activadores com represoras. L'intró típic d'una cèl·lula eucariota té seqüències de consens que defineixen regions importants. Cada intró té les bases nitrogenades GU (guanina-uracil) al seu extrem 5′. A prop de l'extrem 3′ hi ha un lloc de ramificació. El nucleòtid de l'extrem de la branca sempre es A (adenina), però la seqüència de consens al voltant d'aquesta seqüència varia. Als humans, la seqüència de consens de la branca és yUnAy.[19] Després del lloc de ramificació es troben una sèrie de pirimidines, i després els nucleòtids AG (adenina-guanina) a l'extrem 3′.[3] l'empalmament de l'ARNm es realitza per un complex de proteïnes i ARN conegut com a complex de tall i unió, (o spliceosoma) que conté diversos snRNPs anomenats U1, U2, U4, U5 i U6 (U3 no està involucrat en aquest procés).[20] L'U1 s'uneix als nucleòtids GU de l'extrem 5′ i l'U2 s'uneix al lloc de ramificació A amb l'ajuda dels factors proteics U2AF. En aquesta etapa el complex rep el nom de «complex spliceosoma A». La formació d'aquest complex és normalment el pas clau en la determinació dels extrems de l'intró per on es tallarà, i la definició dels extrems de l'exó que s'ha de mantenir.[3] Els complexos U4, U5, U6 s'uneixen, i U6 substitueix a U1 a la seva posició. U1 i U4 se'n van. A continuació, el complex que queda duu a terme dues reaccions de trans-esterificació. A la primera trans-esterificació, l'extrem 5′ de l'intró s'escindeix de l'exó upstream i es va unir al lloc de ramificació A a través d'un enllaç 2′, 5′-fosfodièster. A la segona trans-esterificació, l'extrem 3′ de l'intró s'escindeix de l'exó downstream, i els dos exons s'uneixen mitjançant un enllaç fosfodièster. L'intró s'allibera en forma de llaç i es degrada.[1]
Elements reguladors i proteïnes
[modifica]
L'enllaç està regulat per proteïnes d'acció trans (repressores i activadores), els corresponents llocs reguladors d'acció cis en l'ARNm (silenciadors i potenciadors), i altres característiques de l'ARN que tenen influència en com es farà l'empalmament, igual que altres estructures secundàries. En conjunt, aquests elements formen un «codi d'acoblament» que regeix la forma en què es fa l'empalmament segons les diferents condicions cel·lulars.[21][22]

Els factors determinants de l'empalmament actuen d'una manera interdependent, però en molts casos només un d'aquests factors tindrà una influència constant en l'entroncament. Entre aquests casos, hi ha dos tipus principals de sequències d'acció cis als pre-ARNm, que tenen les seves proteïnes d'acció trans corresponents. Els silenciadors d'acoblament són llocs als quals s'uneixen les proteïnes repressores d'empalmament, la qual cosa redueix la probabilitat que un lloc proper sigui utilitzat com a lloc d'unió. Aquests silenciadors poden estar ubicats en el mateix intró (silenciadors intrònics d'acoblament, ISS) o en un exó veí (silenciadors exònics acoblament, ESS). Poden variar en seqüència, així com en els tipus de proteïnes que s'uneixen a ells. La majoria dels repressors d'empalmament són ribonucleoproteïnes nuclears heterogènies (hnRNPs) com per exemple l'hnRNPA1.[3][21] Els potenciadors d'acoblament són llocs als que s'uneixen les proteïnes activadores d'empalmament, que augmenten la probabilitat que un lloc proper sigui utilitzat com a lloc d'unió. Aquests també poden aparèixer a l'intró (potenciadors intrònics d'acoblament, ISE) o a l'exó (potenciadors exònics d'acoblament, ESE). La majoria de les proteïnes activadores que s'uneixen als ISE i als ESE són de la família de proteïnes SR. Aquestes proteïnes contenen zones de reconeixement d'ARN i dominis rics en arginina i serina (SR).[3][21] El significat adaptatiu dels silenciadors i els potenciadors d'acoblament és acreditat per un estudi que mostra que hi ha una forta selecció als gens humans en contra de les mutacions que produeixen nous silenciadors o que interrompen potenciadors existents.[23] En general, els factors determinants treballen de manera interdependent que varia segons el context, de manera que les normes que regeixen la regulació de l'empalmament formen un codi d'empalmament.[22] La presència d'una determinada seqüència d'ARN d'acció cis pot incrementar la probabilitat que un lloc proper sigui utilitzat com a lloc d'unió en alguns casos, però en altres situacions la pot disminuir, depenent del context. El context en què actuen els elements reguladors inclou un context d'acció cis determinat per la presència d'altres característiques de la seqüència d'ARN, i un context d'acció trans determinat per les condicions cel·lulars. Per exemple, algunes seqüències d'ARN d'acció cis només influeixen a l'empalmament si nombrosos elements estan presents a la mateixa zona per tal d'establir el context adequat. Un altre cas és el dels elements cis que poden tenir efectes contraris sobre l'empalmament, en funció de les proteïnes presents a la cèl·lula (per exemple la proteïna PTB neuronal davant la no neuronal).
Exemples
[modifica]Omissió d'exó: Drosophila DSX
[modifica]
El preARN del gen dsx de Drosophila melanogaster conté 6 exons. En els mascles, els exons 1, 2, 3, 5 i 6 s'uneixen per formar l'ARNm definitiu, que codifica una proteïna de regulació transcripcional necessària per al desenvolupament masculí. En les femelles, els exons 1, 2, 3, i 4 estan units, i un senyal de poliadenilació en l'exó 4 causa la separació de l'ARNm en aquest punt. L'ARNm resultant codifica una proteïna de regulació transcripcional necessària per al desenvolupament femení.[24] Aquest és un exemple d'omissió d'exó. L'intró que precedeix al quart exó té un tram de polipirimidina que no coincideix amb la seqüència de consens, de manera que les proteïnes U2AF no s'uneixen correctament a aquest intró sense l'ajuda dels activadors d'unió. Per tant, aquest acceptor d'empalmament no és utilitzat als mascles. En canvi, les femelles produeixen l'activador d'empalmament transformador (Tra). La proteïna SR Tra2 es produeix en ambdós sexes i s'uneix a una ESE en l'exó 4, i si Tra està present, s'uneix a Tra2 i, juntament amb una altra proteïna SR, forma un complex de proteïnes que ajuda a U2AF a unir-se al tram feble de pirimidines. L'U2 s'associa al punt de ramificació, i això condueix a la inclusió de l'exó 4 en l'ARNm.[24][25]
Llocs alternatius d'acceptors: Drosophila Transformer
[modifica]
El Pre-ARNm del transformador (TRA) de gens de Drosophila melanogaster pateix un empalmament alternatiu mitjançant la via del lloc alternatiu de l'acceptor. El gen TRA codifica una proteïna que només s'expressa en femelles. El transcriptor primari del gen conté un intró amb dos llocs acceptors possibles. En mascles s'utilitza l'acceptor upstream. Això fa que una versió més llarga de l'exó 2 sigui inclosa en el procés de transcripció, incloent-hi un codó de parada. L'ARNm resultant codifica una proteïna truncada que està inactiva. Les femelles produeixen la proteïna patró de la determinació del sexe Sex Lethal (SXL). La proteïna Sxl és un repressor d'empalmament que s'uneix a un ISS a l'ARN de la proteïna Tra a prop del lloc d'unió upstream, impedint que la proteïna U2AF s'uneixi al tram de polipirimidina. Això evita l'ús d'aquesta unió, canviant el complex de tall i unió i unint-se al lloc acceptor downstream. En aquest punt, l'empalmament passa per alt el codó d'aturada, que és extirpat com una part dels introns. L'ARN resultant codifica una proteïna Tra activa, que és reguladora de l'empalmament alternatiu d'un altre gen sexual.
Definició d'exó: receptor Fas
[modifica]
Múltiples isoformes de la proteïna receptora Fas són produïdes per l'empalmament alternatiu. Dues isoformes que tenen lloc normalment en humans són produïdes per un mecanisme d'omissió d'exons. Un ARNm que inclou l'exó 6 codifica l'estructura d'unió a la membrana del receptor Fas, que promou l'apoptosi o la mort programada de cèl·lules. L'augment de l'expressió del receptor Fas en les cèl·lules de la pell crònicament exposades al sol i l'absència de l'expressió en cèl·lules de càncer de pell, suggereix que aquest mecanisme pot ser important per a l'eliminació de cèl·lules humanes pre-canceroses.[26] Si l'exó 6 se salta, l'ARNm resultant codifica la proteïna Fas soluble que no promou l'apoptosi. La inclusió o el salt de l'exó depèn de dues proteïnes antagonistes, TIA-1 i la proteïna d'unió al tram de polipirimidinas.
- El lloc donador 5' en l'intró "downstream" des de l'exó 6 en el pre-ARNm té una unió dèbil amb la seqüència de consens i normalment no està unit al U1 snRNP. Si U1 no s'uneix, l'exó se salta.
- La unió de la proteïna TIA-1 a un potenciador d'empalmament intrònic estabilitza la unió d'U1 snRNP.[3] El complex donador 5 'resultant participa en la unió del factor U2AF a l'entroncament "upstream" 3' de l'exó a través d'un mecanisme que encara no es coneix.[27]
- L'exó 6 conté un ESS ric en pirimidina, URE 6, on es pot unir PTB. Si PTB s'uneix, s'inhibeix l'efecte del complex donador 5' en la unió d'U2AF al lloc acceptor, tenint com a resultat el salt de l'exó.
Aquest mecanisme és un exemple de la definició d'exó a l'empalmament. Un spliceosoma reuneix un intró i la subunitat snRNP porta l'ARN perquè els extrems 5' i 3' dels introns s'uneixin. No obstant això, estudis recents com aquest mostren que també hi ha interaccions entre els extrems. En aquest cas particular, aquestes interaccions de defició d'exó són necessàries per a permetre la unió dels factors centrals d'entroncament abans de l'acoblament del spliceosoma als dos introns que l'envolten.[27]
Competició represor-activador: exó 2 HIV-1
[modifica]
El VIH, el retrovirus que causa el SIDA en humans, produeix una única còpia primària d'ARN, que s'empalma de diferentes maneres per produir uns 40 ARNm diferents.[28] L'equilibri entre transcripcions diferentment empalmades proporciona múltiples ARNm, codificant diferents productes, necessaris per a la multiplicació viral.[29] Una de les transcripcions diferencialment empalmada conté el gen tat, en el qual l'exó 2 és un exó "Casset" que pot ser saltat o inclòs. L'addició de l'exó 2 tat en l'ARN està regulat per una competició entre el repressor d'entroncament hnRNP A1 i la proteïna SR SC35. Dins de l'exó 2 se superposen una seqüència silenciadora (ESS) i una seqüència potenciadora (ESE). Si la proteïna repressora A1 s'uneix al ESS, s'inicia la unió cooperativa de múltiples molècules A1, estenent l'extrem donador 5' '"upstream" de l'exó 2 prevenint la unió del factor d'acoblament central U2AF35 al tram de pirimidines. Si SC35 s'uneix a la ESE, evita que A1 s'uneixi i mantingui l'extrem donador 5 'en un estat accessible perquè s'ensambli el spliceosoma. La competició entre l'activador i el repressor assegura la producció dels dos tipus d'ARNm (amb exó 2 i sense).[28]
Significat adaptatiu
[modifica]l'empalmament alternatiu és una de les excepcions de la idea original que una seqüència d'ADN codifica un polipèptid (la hipòtesi d'un gen, un enzim). Ara seria més correcte dir "un gen, molts polipèptids".[30] Cal informació externa per decidir quins polipèptids es produeix, donada una seqüència d'ADN i un ARNm. Els mecanismes de regulació són heretats, això proporciona noves mutacions que afecten a l'expressió de gens.[7]
S'ha proposat que per eucariotes, l'empalmament alternatiu va ser un pas molt important per aconseguir una major eficiència, ja que la informació es pot emmagatzemar de manera més econòmica. Diverses proteïnes poden ser codificades per un gen únic, en lloc de necessitar un gen separat per a cadascun, permetent així, una major varietat proteòmica d'un genoma de grandària limitada.[1] També proporciona flexibilitat evolutiva. Un únic punt de mutació pot donar lloc al fet que un exó donat sigui inclòs o exclòs d'una transcripció durant l'empalmament, permetent la producció d'una isoforma de la nova proteïna sense la pèrdua de la proteïna original.[1] Estudis comparatius indiquen que l'empalmament alternatiu és anterior a la pluricelularidad en l'evolució i suggereixen que aquest mecanisme podria haver estat escollit per contribuir al desenvolupament d'organismes pluricel·lulars.[31]
Les investigacions basades en el Projecte Genoma Humà i la seqüenciació del genoma han demostrat que els éssers humans només tenen un 30% més de gens en comparació amb el cuc Caenorhabditis elegans, i només el doble que la mosca Drosophila melanogaster. Aquesta troballa fa pensar que l'aparent complexitat dels éssers humans, o dels vertebrats en general, podria ser causa de l'augment de l'empalmament alternatiu en els éssers humans.[32][33] No obstant això, un estudi de cada 100.000 ESTs d'humans, ratolins, rates, vaques, mosques (D. melanogaster), cucs (C. elegans) i la planta Arabidopsis thaliana, no va trobar grans diferències en la freqüència dels gens empalmats alternativament entre els éssers humans i qualsevol dels altres animals testats.[34] No obstant això, un altre estudi va proposar que aquests resultats van ser un artefacte dels diferents números d'ESTs disponibles per als diferents mecanismes. Quan van comparar les freqüències d'empalmament alternatiu en subgrups a l'atzar de gens de cada organisme, els autors van concloure que els vertebrats tenen taxes més altes d'empalmament alternatiu que els invertebrats.[35]
Empalmament alternatiu i malalties
[modifica]Canvis en la maquinària de processament de l'ARN poden conduir a errors d'acoblament de múltiples transcripcions, mentre que una única alteració en el nucleòtid en els llocs d'entroncament o en els llocs d'unió regulador cis poden donar lloc a diferències en l'entroncament d'un sol gen, i per tant en l'ARNm produït per agents mutants transcrits. Un estudi probabilístic indica que més del 60% de les malalties que causen mutacions en humans afecten més a l'entroncament que directament a la seqüència de codificació.[36]
Es poden trobar ARNm empalmats anormalment en altes concentracions en cèl·lules canceroses.[5][6] Fins fa poc, no estava clar si aquests patrons d'acoblament influïen en el creixement cancerós, o només eren una conseqüència d'alteracions cel·lulars associades al càncer. S'ha demostrat que hi ha una reducció de l'empalmament alternatiu en les cèl·lules canceroses en comparació amb les normals, i els tipus d'empalmament es diferencien; per exemple, les cèl·lules canceroses mostren majors nivells d'introns retinguts que les cèl·lules normals, però menys omissions d'exons.[37] Algunes de les diferències en l'empalmament de les cèl·lules canceroses poden ser conseqüència de canvis en la fosforilació de factors d'acoblament d'acció trans. Altres poden ser produïdes per canvis en les quantitats dels factors d'acoblament produït, per exemple, les cèl·lules del càncer de mama han mostrat un augment en els nivells del factor d'acoblament SF2/ASF.[38] Un estudi va trobar que un percentatge relativament petit (383 dels més de 26.000) de les variants d'empalmament alternatiu van ser més freqüents en cèl·lules tumorals que en cèl·lules normals, el que suggereix que hi ha un nombre limitat de gens que, en ser empalmats de forma incorrecta, contribueixen al desenvolupament del tumor.[39] No obstant això, es creu que els efectes nocius de les transcripcions mal empalmades solen ser salvaguardades i eliminades per un mecanisme cel·lular del contrast de qualitat, denominat "Nonsense-mediated decay" [NMD].[8]
Un exemple de la variant específica d'entroncament associada al càncer es troba en un dels gens humans DNMT. Tres gens DNMT codifiquen enzims encarregats d'afegir grups metil a l'ADN, una modificació que sovint té efectes reguladors. Diversos ARNm DNMT313 empalmats anormalment es troben en tumors i línies cel·lulars de càncer. En dos estudis independents, l'expressió de dos d'aquests ARNm empalmats anormalment en cèl·lules de mamífers podien produir alteracions en els patrons de metilació de l'ADN en aquestes cèl·lules. Les cèl·lules amb un dels ARNm anormals també va créixer dues vegades més ràpid que les cèl·lules de control, el que indica una contribució directa al desenvolupament de tumors per aquest producte.[7]
Un altre exemple és el protooncogèn Ron (MST1R). Una propietat important de les cèl·lules canceroses és la seva capacitat per moure i envair el teixit normal. La producció d'una transcripció anormal d'entroncament de Ron s'associa amb l'augment dels nivells de la SF2/ASF en les cèl·lules de càncer de mama. La isoforma anormal de la proteïna Ron codificada per aquest ARNm porta a la motilitat cel·lular.[38]
Estudis recents apunten a una funció clau en la modificació de l'estructura de la cromatina i de les histones en la regulació dl'empalmament alternatiu. Aquestes reflexions suggereixen que parts del genoma no només s'expressen, sinó també la forma en què s'empalmen.[40]
Anàlisi de l'empalmament alternatiu de tot el genoma
[modifica]L'anàlisi de l'empalmament alternatiu de tot el genoma és una tasca difícil. En general, les transcripcions de l'empalmament alternatiu s'han trobat mitjançant la comparació de seqüències EST, però això requereix la seqüenciació d'un gran nombre d'ESTs. La majoria de les biblioteques EST provenen d'un nombre molt limitat de teixits, per la qual cosa es perd la informació de les variants específiques de cada teixit. S'utilitzen tres tipus de tècniques d'alt rendiment per investigar l'empalmament alternatiu: microarray d'ADN basats en anàlisi, CLIP i assajos en viu del gen reporter.[21]
En l'anàlisi de microarray, s'han fet servir les matrius del fragment d'ADN que representen els exons individuals (per exemple, l'exó Affymetrix de microrayos) o exons límits (per exemple, les matrius de ExonHit o Jivan). La matriu és llavors investigada amb ADNc dels teixits d'interès. La sonda d'ADNc s'uneix a l'ADN dels exons que s'inclouen en l'ARNm en el teixit d'origen, o l'ADN de la frontera d'unió entre dos exons. Això pot revelar la presència de determinats ARNm empalmats alternativament. Les tecnologies de seqüenciació profunda també s'estan utilitzant per dur a terme tota l'anàlisi del genoma de la variació de la transcripció. CLIP, Cross-Linking and immunoprecipitació (entrecreuament i immunoprecipitació), utilitza la radiació UV per vincular les proteïnes d'una molècula d'ARN a un teixit durant l'empalmament.[2] Una proteïna d'acció trans reguladora de l'entroncamen, precipita utilitzant anticossos específics. Quan l'ARN unit a una proteïna està aïllat i clonat, revela les dianes de la seqüència de proteïnes.[4]
Finalment, és possible trobar proteïnes d'acoblament involucrades en un cas específic d'empalmament alternatiu mitjançant la construcció de gens reporters que expressaran una de les dues proteïnes fluorescents depenent de l'entroncament que passi. Aquest mètode ha estat usat per aïllar mutants que afecten a l'entroncament i així identificar les noves proteïnes reguladores d'unió inactives en aquests mutants.[4]
Referències
[modifica]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Black, Douglas L. (2003). "Mechanisms of alternative pre-messenger RNA splicing". Annual Reviews of Biochemistry 72 (1): 291–336. doi:10.1146/annurev.biochem.72.121801.161720. PMID: 12626338
- ↑ 2,0 2,1 2,2 Pan, Q; Shai O, Lee LJ, Frey BJ, Blencowe BJ (Dec 2008). "Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing". Nature Genetics 40 (12): 1413–1415. doi:10.1038/ng.259. PMID: 18978789
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 Matlin, AJ; Clark F, Smith, CWJ (May 2005). "Understanding alternative splicing: towards a cellular code". Nature Reviews 6 (5): 386–398. doi:10.1038/nrm1645. PMID: 15956978
- ↑ 4,0 4,1 4,2 David, C. J.; Manley, J. L. (2008). "The search for alternative splicing regulators: new approaches offer a path to a splicing code". Genes & Development 22 (3): 279–85. doi:10.1101/gad.1643108. PMC 2731647. PMID: 18245441
- ↑ 5,0 5,1 Skotheim, R I and Nees, M (2007). "Alternative splicing in cancer: noise, functional, or systematic?". The international journal of biochemistry & cell biology 39 (7-8): 1432–49. doi:10.1016/j.biocel.2007.02.016. PMID: 17416541
- ↑ 6,0 6,1 Bauer, Joseph Alan; He, Chunjiang; Zhou, Fang; Zuo, Zhixiang; Cheng, Hanhua; Zhou, Rongjia (2009). Bauer, Joseph Alan. ed. "A Global View of Cancer-Specific Transcript Variants by Subtractive Transcriptome-Wide Analysis". PLoS ONE 4 (3): e4732. Bibcode 2009PLoSO...4.4732H. doi:10.1371/journal.pone.0004732. PMC 2648985. PMID: 19266097
- ↑ 7,0 7,1 7,2 Fackenthal, Jd; Godley, La (2008). "Aberrant RNA splicing and its functional consequences in cancer cells" (Free full text). Disease models & mechanisms 1 (1): 37–42. doi:10.1242/dmm.000331. PMC 2561970. PMID: 19048051
- ↑ 8,0 8,1 Danckwardt S, Neu-Yilik G, Thermann R, Frede U, Hentze MW, Kulozik AE (2002). "Abnormally spliced beta-globin mRNAs: a single point mutation generates transcripts sensitive and insensitive to nonsense-mediated mRNA decay". Blood 99 (5): 1811–6. doi:10.1182/blood.V99.5.1811. PMID: 11861299
- ↑ Chow LT, Gelinas RE, Broker TR, Roberts RJ (1977). "An amazing sequence arrangement at the 5' ends of adenovirus 2 messenger RNA". Cell 12 (1): 1–8. doi:10.1016/0092-8674(77)90180-5. PMID: 902310
- ↑ Berget SM, Moore C, Sharp PA (1977). "Spliced segments at the 5' terminus of adenovirus 2 late mRNA". Proc. Natl. Acad. Sci. U.S.A. 74 (8): 3171–5. doi:10.1073/pnas.74.8.3171. PMC 431482. PMID: 269380
- ↑ 11,0 11,1 11,2 Leff SE, Rosenfeld MG, Evans RM (1986). "Complex transcriptional units: diversity in gene expression by alternative RNA processing". Annu. Rev. Biochem. 55 (1): 1091–117. doi:10.1146/annurev.bi.55.070186.005303. PMID: 3017190
- ↑ Chow LT, Broker TR (1978). "The spliced structures of adenovirus 2 fiber message and the other late mRNAs". Cell 15 (2): 497–510. doi:10.1016/0092-8674(78)90019-3. PMID: 719751
- ↑ Nevins JR, Darnell JE (1978). "Steps in the processing of Ad2 mRNA: poly(A)+ nuclear sequences are conserved and poly(A) addition precedes splicing". Cell 15 (4): 1477–93. doi:10.1016/0092-8674(78)90071-5. PMID: 729004
- ↑ Rosenfeld MG, Amara SG, Roos BA, Ong ES, Evans RM (1981). "Altered expression of the calcitonin gene associated with RNA polymorphism". Nature 290 (5801): 63–5. doi:10.1038/290063a0. PMID: 7207587
- ↑ Rosenfeld MG, Lin CR, Amara SG, et al (1982). "Calcitonin mRNA polymorphism: peptide switching associated with alternative RNA splicing events". Proc. Natl. Acad. Sci. U.S.A. 79 (6): 1717–21. doi:10.1073/pnas.79.6.1717. PMC 346051. PMID: 6952224
- ↑ Maki R, Roeder W, Traunecker A, et al (1981). "The role of DNA rearrangement and alternative RNA processing in the expression of immunoglobulin delta genes". Cell 24 (2): 353–65. doi:10.1016/0092-8674(81)90325-1. PMID: 6786756
- ↑ Schmucker D, Clemens JC, Shu H, Worby CA, Xiao J, Muda M, Dixon JE, Zipursky SL (2000). "Drosophila Dscam is an axon guidance receptor exhibiting extraordinary molecular diversity". Cell 101 (6): 671–84. doi:10.1016/S0092-8674(00)80878-8. PMID: 10892653
- ↑ 18,0 18,1 18,2 18,3 Michael Sammeth; Sylvain Foissac; Roderic Guigó (2008). Brent, Michael R.. ed. "A general definition and nomenclature for alternative splicing events". PLoS Comput Biol. 4 (8): e1000147. doi:10.1371/journal.pcbi.1000147. PMC 2467475. PMID: 18688268
- ↑ Gao, K.; Masuda, A.; Matsuura, T.; Ohno, K. (2008). "Human branch point consensus sequence is yUnAy". Nucleic Acids Research 36 (7): 2257–67. doi:10.1093/nar/gkn073. PMC 2367711. PMID: 18285363
- ↑ Clark, David (2005). Molecular biology. Amsterdam: Elsevier Academic Press.SBN 0-12-175551-7.
- ↑ 21,0 21,1 21,2 21,3 Wang, Z; Burge, Cb (2008). "Splicing regulation: from a parts list of regulatory elements to an integrated splicing code" (Free full text). RNA 14 (5): 802–13. doi:10.1261/rna.876308. PMC 2327353. PMID: 18369186
- ↑ 22,0 22,1 Barash, Y; et al (2010). "Deciphering the splicing code". Nature 465 (7294): 53–59. doi:10.1038/nature09000. PMID: 20445623
- ↑ Ke S, Zhang XH, Chasin LA (2008). "Positive selection acting on splicing motifs reflects compensatory evolution". Genome Res. 18 (4): 533–43. doi:10.1101/gr.070268.107. PMC 2279241. PMID: 18204002
- ↑ 24,0 24,1 Lynch KW, Maniatis T (1996). "Assembly of specific SR protein complexes on distinct regulatory elements of the Drosophila doublesex splicing enhancer". Genes Dev. 10 (16): 2089–101. doi:10.1101/gad.10.16.2089. PMID: 8769651
- ↑ Graveley BR, Hertel KJ, Maniatis T (2001). "The role of U2AF35 and U2AF65 in enhancer-dependent splicing". RNA 7 (6): 806–18. doi:10.1017/S1355838201010317. PMC 1370132. PMID: 11421359
- ↑ Filipowicz, Ewa; Adegboyega, P.; Sanchez, R. L.; Gatalica, Zoran (2002). "Expression of CD95 (Fas) in sun-exposed human skin and cutaneous carcinomas". Cancer 94 (3): 814–9. doi:10.1002/cncr.10277. PMID: 11857317
- ↑ 27,0 27,1 Izquierdo JM, Majós N, Bonnal S, et al (2005). "Regulation of Fas alternative splicing by antagonistic effects of TIA-1 and PTB on exon definition". Mol. Cell 19 (4): 475–84. doi:10.1016/j.molcel.2005.06.015. PMID: 16109372
- ↑ 28,0 28,1 Zahler, A. M.; Damgaard, CK; Kjems, J; Caputi, M (2003). "SC35 and Heterogeneous Nuclear Ribonucleoprotein A/B Proteins Bind to a Juxtaposed Exonic Splicing Enhancer/Exonic Splicing Silencer Element to Regulate HIV-1 tat Exon 2 Splicing". Journal of Biological Chemistry 279 (11): 10077–84. doi:10.1074/jbc.M312743200. PMID: 14703516
- ↑ Jacquenet, S.; M�reau, A; Bilodeau, PS; Damier, L; Stoltzfus, CM; Branlant, C (2001). "A Second Exon Splicing Silencer within Human Immunodeficiency Virus Type 1 tat Exon 2 Represses Splicing of Tat mRNA and Binds Protein hnRNP H". Journal of Biological Chemistry 276 (44): 40464–75. doi:10.1074/jbc.M104070200. PMID: 11526107
- ↑ "HHMI Bulletin September 2005: Alternative Splicing". www.hhmi.org. Retrieved 2009-05-26.
- ↑ Irimia, Manuel; Rukov, Jakob; Penny, David; Roy, Scott (2007). "Functional and evolutionary analysis of alternatively spliced genes is consistent with an early eukaryotic origin of alternative splicing". BMC Evolutionary Biology 7: 188. doi:10.1186/1471-2148-7-188. PMC 2082043. PMID: 17916237
- ↑ Ewing, B; Green P (June 2000). "Analysis of expressed sequence tags indicates 35,000 human genes". Nature Genetics 25 (2): 232–234. doi:10.1038/76115. PMID: 10835644
- ↑ Crollius, HR; et al. (2000). "Estimate of human gene number provided by genome-wide analysis using Tetraodon nigroviridis DNA sequence". Nature Genetics 25 (2): 235–238. doi:10.1038/76118. PMID: 10835645
- ↑ David Brett; Heike Pospisil; Juan Valcárcel; Jens Reich; Peer Bork (2002). "Alternative splicing and genome complexity". Nature Genetics 30 (1): 29–30. doi:10.1038/ng803. PMID: 11743582
- ↑ Kim, E.; Magen, A.; Ast, G. (2006). "Different levels of alternative splicing among eukaryotes". Nucleic Acids Research 35 (1): 125–31. doi:10.1093/nar/gkl924. PMC 1802581. PMID: 17158149
- ↑ López-Bigas, Núria; Audit, Benjamin; Ouzounis, Christos; Parra, Genís; Guigó, Roderic (2005). "Are splicing mutations the most frequent cause of hereditary disease?". FEBS Letters 579 (9): 1900–3. doi:10.1016/j.febslet.2005.02.047. PMID: 15792793
- ↑ Kim E, Goren A, Ast G (2008). "Insights into the connection between cancer and alternative splicing". Trends Genet. 24 (1): 7–10. doi:10.1016/j.tig.2007.10.001. PMID: 18054115
- ↑ 38,0 38,1 Ghigna C, Giordano S, Shen H, et al. (2005). "Cell motility is controlled by SF2/ASF through alternative splicing of the Ron proto-oncogene". Mol. Cell 20 (6): 881–90. doi:10.1016/j.molcel.2005.10.026. PMID: 16364913
- ↑ Hui L, Zhang X, Wu X, et al. (2004). "Identification of alternatively spliced mRNA variants related to cancers by genome-wide ESTs alignment". Oncogene 23 (17): 3013–23. doi:10.1038/sj.onc.1207362. PMID: 15048092
- ↑ Luco, RF; Allo, M; Schor, IE; Kornblihtt, AR; Misteli, T. (2011). "Epigenetics in alternative pre-mRNA splicing". Cell 144 (1): 16–26. doi:10.1016/j.cell.2010.11.056. PMC 3038581. PMID: 21215366
Enllaços externs
[modifica]- A General Definition and Nomenclature for Alternative Splicing Events
- AStalavista (Alternative Splicing landscape visualization tool), a method for the computationally exhaustive classification of Alternative Splicing Structures Arxivat 2009-12-11 a Wayback Machine.
- Stamms-lab.net: Research Group dealing with alternative Splicing issues and mis-splicing in human diseases
- Alternative Splicing of ion channels in the brain, connected to mental and neurological diseases
- BIPASS: Web Services in Alternative Splicing Arxivat 2008-07-05 a Wayback Machine.
