Model atòmic de Rutherford
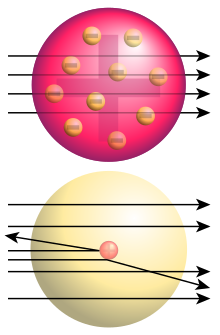
El 1911 Ernest Rutherford va publicar un model atòmic, ja que l'evidència demostrava que el model atòmic de Thomson no podia explicar els resultats que havia trobat en el seu famós experiment.
En aquest experiment es va col·locar una fina làmina d'or i s'hi van fer incidir partícules alfa (carregades positivament i molt denses) provinents d'una font radioactiva. S'esperava que les partícules alfa passarien sense desviar-se a través de la làmina d'or, sense impedir-ho la difusa càrrega positiva repartida pels àtoms que descrivia el model de Thomson. En canvi, algunes de les partícules alfa es desviaven molt o, fins i tot, tornaven enrere, la qual cosa era incompatible amb el model de Thomson.
Rutherford va proposar un model atòmic alternatiu que pogués explicar els resultats de l'experiment. Segons aquest model, la càrrega positiva i la major part de la massa de l'àtom han d'estar concentrades en un volum diminut al centre de l'àtom anomenat nucli atòmic, mentre que els electrons orbiten al voltant d'aquest mitjançant l'atracció electroestàtica. L'àtom és bàsicament espai buit, sent el seu diàmetre d'uns 10-10 m, mentre que el diàmetre del nucli és d'uns 10-15 m.
D'aquesta manera s'explicava que la majoria de partícules alfa travessessin la làmina d'or però que unes poques es poguessin desviar angles molt grans.
No obstant això, el model de Rutherford, basat en principis de la mecànica clàssica, no podia explicar alguns fets que s'havien descobert:
- Donat que la força atractiva de Coulomb proporciona la força centrípeta necessària perquè l'electró es mantingui en òrbita, la teoria electromagnètica clàssica diu que l'àtom en aquestes condicions hauria de ser elèctricament inestable, ja que l'electró accelera quan es mou circularment i per tant irradia energia electromagnètica de freqüència igual a la del seu moviment. Així, l'electró que es mou al voltant del nucli aniria perdent energia i acabaria movent-se en espiral fins a xocar contra el nucli de l'àtom, irradiant cap a l'exterior la seva energia.
- Encara no es podia explicar que l'electró en el seu moviment pogués emetre qualsevol valor d'energia. Per tant, hi hauria una emissió contínua d'energia, que donaria un espectre continu.
Al model de Rutherford li faltava consistència i, per tant, calia elaborar-ne un altre de més satisfactori. Dos anys més tard, Niels Bohr va idear el model atòmic de Bohr, donant solució a aquests problemes.
