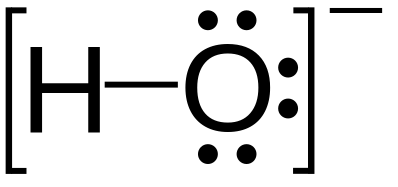
Parell solitari
En química, un parell solitari es refereix a un parell d'electrons de valència que no es comparteixen amb un altre àtom en un enllaç covalent[1] i de vegades s'anomena parell no compartit o parell no enllaçant. Els parells solitaris es troben a la capa d'electrons més externa dels àtoms. Es poden identificar mitjançant una estructura de Lewis. Per tant, els parells d'electrons es consideren parells solitaris si dos electrons estan aparellats però no s'utilitzen en l'enllaç químic. Així, el nombre d'electrons en parells solitaris més el nombre d'electrons en enllaços és igual al nombre d'electrons de valència al voltant d'un àtom.
El parell solitari és un concepte utilitzat en la teoria de repulsió de parells electrònics de la capa de valència (teoria VSEPR) que explica les formes de les molècules. També es fa referència a la química dels àcids i bases de Lewis. Tanmateix, no tots els parells d'electrons no enllaçats són considerats pels químics com a parells solitaris. Alguns exemples són els metalls de transició on els parells no enllaçats no influeixen en la geometria molecular i es diu que són estereoquímicament inactius. En la teoria dels orbitals moleculars (orbitals canònics totalment deslocalitzats o localitzats d'alguna forma), el concepte d'un parell solitari és menys diferent, ja que la correspondència entre un orbital i els components d'una estructura de Lewis sovint no és senzilla. No obstant això, els orbitals ocupats no enllaçants (o orbitals de caràcter majoritàriament no enllaçants) s'identifiquen amb freqüència com a parells solitaris.
-
Parells solitaris (mostrats com a parells de punts) a l'estructura de Lewis de l'hidròxid
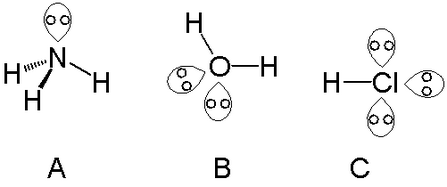
Es pot trobar un parell solitari amb àtoms del grup del nitrogen, com el nitrogen de l'amoníac. Es poden trobar dos parells solitaris amb àtoms del grup del calcogen, com l'oxigen a l'aigua. Els halògens poden portar tres parells solitaris, com el clorur d'hidrogen.
En la teoria VSEPR, els parells d'electrons de l'àtom d'oxigen a l'aigua formen els vèrtexs d'un tetraedre amb els parells solitaris en dos dels quatre vèrtexs. L'angle d'enllaç H–O–H és de 104,5 °, inferior als 109 ° predits per a un angle tetraèdric, i això es pot explicar per una interacció repulsiva entre els parells solitaris.[2][3][4]
S'han proposat diversos criteris computacionals per a la presència de parelles solitàries. Tot i que la densitat electrònica ρ(r) en si mateixa generalment no proporciona una guia útil en aquest sentit, el laplacià de la densitat electrònica és revelador, i un criteri per a la ubicació del parell solitari és on L(r) = –∇2ρ(r) és un màxim local. Els mínims del potencial electroestàtic V(r) és un altre criteri proposat. Un altre considera la funció de localització d'electrons (ELF).[5]
Canvis d'angle
[modifica]Els parells sovint presenten un caràcter polar negatiu amb la seva alta densitat de càrrega i es troben més a prop del nucli atòmic de mitjana en comparació amb el parell d'electrons d'enllaç. La presència d'un parell solitari disminueix l'angle d'enllaç entre el parell d'electrons d'enllaç, a causa de la seva elevada càrrega elèctrica, que provoca una gran repulsió entre els electrons. També estan implicats en la formació d'un enllaç datiu. Per exemple, la creació de l'ió hidroni (H₃O+) es produeix quan els àcids es dissolen a l'aigua i es deu al fet que l'àtom d'oxigen dona un parell solitari a l'ió hidrogen.
-
Estructura tetraèdrica de l'aigua
Això es pot veure amb més claredat quan es mira en dues molècules més comunes. Per exemple, en el diòxid de carboni (CO₂), els àtoms d'oxigen es troben a costats oposats del carboni (geometria molecular lineal), mentre que en l'aigua (H₂O) l'angle entre els àtoms d'hidrogen és de 104,5 ° (geometria molecular angular). La força repulsiva dels parells solitaris de l'àtom d'oxigen allunya més els hidrògens, fins que les forces de tots els electrons sobre l'àtom d'hidrogen estan en equilibri. Aquesta és una il·lustració de la teoria VSEPR.
Moments dipolars
[modifica]Els parells solitaris poden contribuir al moment dipolar d'una molècula. L'NH₃ té un moment dipolar d'1,42 D. Com que l'electronegativitat del nitrogen (3,04) és més gran que la de l'hidrogen (2,2), el resultat és que els enllaços N-H són polars amb una càrrega negativa neta a l'àtom de nitrogen i una càrrega positiva neta més petita. sobre els àtoms d'hidrogen. També hi ha un dipol associat al parell solitari i això reforça la contribució que fan els enllaços covalents polars N-H al moment dipolar de l'amoníac. En contrast amb NH₃, NF₃ té un moment dipolar molt més baix de 0,234 D. El fluor és més electronegatiu que el nitrogen i la polaritat dels enllaços N-F és oposada a la dels enllaços N-H de l'amoníac, de manera que el dipol degut al parell solitari s'oposa. els dipols d'enllaç N-F, donant lloc a un moment dipolar molecular baix.
Parelles solitàries estereogèniques
[modifica]
|
⇌ | 
|
| Inversió d'una molècula d'amina orgànica genèrica en nitrogen | ||
Un parell solitari pot contribuir a l'existència de quiralitat en una molècula, quan altres tres grups units a un àtom difereixen. L'efecte es veu en determinades amines, fosfines,[6] ions sulfoni i oxoni, sulfòxids i fins i tot carbanions.
La resolució d'enantiòmers on el centre estereogènic és una amina normalment es descarta perquè la barrera energètica per a la inversió del nitrogen al centre estèreo és baixa, cosa que permet que els dos estereoisòmers s'interconverteixin ràpidament a temperatura ambient. Com a resultat, aquestes amines quirals no es poden resoldre, tret que els grups de l'amina estiguin restringits en una estructura cíclica (com a la base de Tröger).
Parelles solitàries inusuals
[modifica]També s'espera un parell solitari estereoquímicament actiu per als ions de plom i estany divalents a causa de la seva configuració electrònica formal de ns2. En estat sòlid, això dona lloc a la coordinació metàl·lica distorsionada observada a l'estructura de litargiri tetragonal adoptada tant per PbO com per SnO.
Recentment s'ha demostrat que la formació d'aquests parells solitaris de metalls pesants ns2 que s'atribuïa anteriorment a la hibridació intraatòmica dels estats s i p del metall[7] té una forta dependència anònica.[8] Aquesta dependència dels estats electrònics de l'anió pot explicar per què alguns materials divalents de plom i estany com PbS i SnTe no mostren evidències estereoquímiques del parell solitari i adopten l'estructura cristal·lina simètrica de sal de roca.[9][10]
En els sistemes moleculars, el parell solitari també pot provocar una distorsió en la coordinació dels lligands al voltant de l'ió metàl·lic. L'efecte de parell solitari del plom es pot observar en complexos supramoleculars de nitrat de plom (II), i el 2007 un estudi va relacionar el parell solitari amb la intoxicació per plom.[11] Els ions de plom poden substituir els ions metàl·lics natius en diversos enzims clau, com els cations de zinc de l'enzim ALAD, que també es coneix com a porfobilinogen sintasa, i és important en la síntesi d'hemo, un component clau de la molècula que transporta oxigen hemoglobina. Aquesta inhibició de la síntesi del grup hemo sembla ser la base molecular de la intoxicació per plom (també anomenat «saturnisme»).[12][13][14] Els experiments computacionals revelen que, tot i que el nombre de coordinació no canvia amb la substitució de les proteïnes que s'uneixen al calci, la introducció de plom distorsiona la forma en què els lligands s'organitzen per acomodar un parell solitari emergent; en conseqüència, aquestes proteïnes es veuen pertorbades. Aquest efecte de parell solitari esdevé espectacular per a les proteïnes que s'uneixen al zinc, com la porfobilinogen sintasa esmentada anteriorment, ja que el substrat natural ja no pot unir-se; en aquests casos, la proteïna s'inhibeix.
-
Tendències de parells solitaris en els enllaços triples del grup 14
Als elements del grup 14 (el grup del carboni), els parells solitaris es poden manifestar escurçant o allargant les longituds dels enllaços simples (ordre d'enllaç 1),[15] així com també en l'ordre efectiu dels enllaços triples.[16][17]
Els alquins coneguts tenen un triple enllaç carboni-carboni (ordre d'enllaç 3) i una geometria lineal d'angles d'enllaç de 180° (figura A).[18] Tanmateix, més avall al grup (silici, germani i estany), els enllaços triples formals tenen un ordre d'enllaç efectiu 2 amb un parell solitari (figura B)[18] i geometries trans-doblades. En el plom, l'ordre d'enllaç efectiu es redueix encara més a un únic enllaç, amb dos parells solitaris per a cada àtom de plom (figura C).[18] En el compost d'organogermani (figura D), l'ordre d'enllaç efectiu també és 1, amb complexació dels grups C-N d'isocianur, basat en la interacció amb l'orbital buit 4p del germani.[18][19]
Descripcions diferents per a múltiples parelles solitàries
[modifica]En els cursos de química elemental, els parells solitaris d'aigua es descriuen com a «orelles de conill»: dos parells d'electrons equivalents d'hibridació aproximadament sp3, mentre que l'angle d'enllaç HOH és de 104,5 °, lleugerament més petit que l'angle tetraèdric ideal d'arccosinus (–1/3) ≈ 109,47°. L'angle d'enllaç més petit es racionalitza per la teoria VSEPR atribuint un requisit d'espai més gran per als dos parells solitaris idèntics en comparació amb els dos parells d'enllaç. En cursos més avançats, una explicació alternativa per a aquest fenomen considera la major estabilitat dels orbitals amb un excés de caràcter s utilitzant la teoria de la hibridació isovalent, en la qual es poden construir enllaços i parells solitaris amb híbrids spx on es permeten valors no integrals de x, sempre que ja que es conserva la quantitat total de caràcters s i p (un orbital s i tres p en el cas dels elements de la segona fila del bloc p).
-
Els parells solitaris de H₂O adaptats a la simetria i hibridats
Per determinar la hibridació dels orbitals de l'oxigen utilitzats per formar els parells d'enllaç i els parells solitaris de l'aigua de la imatge de la part superior, s'utilitza la fórmula 1 + x cos θ = 0, que relaciona l'angle d'enllaç θ amb l'índex d'hibridació x. Segons aquesta fórmula, es considera que els enllaços O-H es construeixen a partir d'orbitals d'enllaç O d'hibridació ~sp4.0 (~80% caràcter p, ~20% caràcter s), que deixa enrere orbitals de parells solitaris O d'hibridació ~sp2.3 (~70% caràcter p, ~30% caràcter s). Aquestes desviacions de la hibridació sp3 idealitzada per a la geometria tetraèdrica són consistents amb la regla de Bent: els parells solitaris localitzen més densitat d'electrons més a prop de l'àtom central en comparació amb els parells d'enllaç; per tant, l'ús d'orbitals amb un excés de caràcter s per formar parells solitaris (i, en conseqüència, els que tenen un excés de caràcter p per formar parells d'enllaç) és energèticament favorable.
Tanmateix, els teòrics sovint prefereixen una descripció alternativa de l'aigua que separi els parells solitaris de l'aigua segons la simetria respecte al pla molecular. En aquest model, hi ha dos parells solitaris de l'aigua energèticament i geomètricament diferents que posseeixen una simetria diferent: un (σ) en el pla i simètric respecte al pla molecular i l'altre (π) perpendicular i antisimètric respecte al pla molecular. El parell solitari de simetria σ (σ(exterior)) es forma a partir d'un orbital híbrid que barreja caràcters 2s i 2p, mentre que el parell solitari de simetria π (p) és de parentalitat orbital 2p exclusiva. L'orbital de parell solitari O σ(exterior) ric en caràcters s (també indicat nO(σ)) és un híbrid ~sp0.7 (~40% caràcter p, 60% caràcter s), mentre que l'orbital p del parell solitari (també indicat nO (π)) consta d'un caràcter p 100%.
Tots dos models tenen valor i representen la mateixa densitat electrònica total, amb els orbitals relacionats per una transformació unitària. En aquest cas, podem construir els dos orbitals híbrids de parells solitaris equivalents h i h' prenent combinacions lineals h = c1σ(exterior) + c₂p i h' = c1σ(exterior) – c₂p per a una elecció adequada dels coeficients c1 i c₂. Per a les propietats químiques i físiques de l'aigua que depenen de la distribució global d'electrons de la molècula, l'ús de h i h' és tan vàlid com l'ús de σ(exterior) i p. En alguns casos, aquesta vista és útil de manera intuïtiva. Per exemple, el requisit estereoelectrònic per a l'efecte anomèric es pot racionalitzar utilitzant parells solitaris equivalents, ja que és la donació global de densitat d'electrons a l'orbital antienllaç el que importa. També és vàlid un tractament alternatiu que utilitzi parells solitaris separats σ/π, però requereix aconseguir un equilibri entre la maximització de la superposició nO(π)-σ* (màxim a un angle diedre de 90°) i la superposició nO(σ)-σ* (màxima a un angle diedre de 0°), un compromís que porta a la conclusió que una conformació gauche (angle diedre de 60°) és la més favorable, la mateixa conclusió que el model de parells solitaris equivalents racionalitza d'una manera molt més directa.[20] De la mateixa manera, els enllaços d'hidrogen de l'aigua es formen al llarg de les direccions dels parells solitaris d' «orelles de conill», com a reflex de l'augment de la disponibilitat d'electrons en aquestes regions. Aquesta vista s'admet computacionalment.[5] Tanmateix, com que només els orbitals canònics adaptats a la simetria tenen energies físicament significatives, els fenòmens que tenen a veure amb les energies dels orbitals individuals, com la reactivitat fotoquímica o l'espectroscòpia fotoelectrònica, s'expliquen més fàcilment mitjançant parells solitaris σ i π que respecten la simetria molecular.[Nota 1][20]
A causa de la popularitat de la teoria VSEPR, el tractament dels parells solitaris de l'aigua com a equivalents és freqüent en els cursos d'introducció a la química, i molts químics en pràctiques continuen considerant-lo com un model útil. Una situació similar es produeix quan es descriuen els dos parells solitaris de l'oxigen carbonílic d'una cetona.[21]
Tanmateix, la qüestió de si és conceptualment útil derivar orbitals equivalents a partir d'adaptats a la simetria, des del punt de vista de la teoria de l'enllaç i la pedagogia, encara és controvertida, amb articles recents (2014 i 2015) que s'oposen[22] i donen suport a la pràctica.[23]
Notes
[modifica]- ↑ Si bé el parell solitari nO(π) és equivalent al MO canònic amb l'etiqueta 1b1 de Mulliken, el parell solitari nO(σ) no és del tot equivalent al MO canònic de l'etiqueta 2a1 de Mulliken, ja que l'orbital totalment deslocalitzat inclou la barreja amb la combinació lineal adaptada a la simetria en fase d'orbitals 1s d'hidrogen, la qual cosa fa que el seu caràcter estigui lleugerament enllaçat, en lloc de ser estrictament no enllaçant.
Referències
[modifica]- ↑ «Definition: lone (electron) pair» (en anglès). Gold Book (IUPAC).
- ↑ Fox i Whitesell, 2004.
- ↑ McMurry, 2000.
- ↑ Lee, 1968.
- ↑ 5,0 5,1 Kumar et al., 2014, p. 526-532.
- ↑ Quin, 2000.
- ↑ Dunitz i Orgel, 1960, p. 1-60.
- ↑ Payne, 2006, p. 157403.
- ↑ Walsh, 2005, p. 1422-1428.
- ↑ Walsh, 2005b, p. 18868-18875.
- ↑ Gourlaouen i Parisel, 2007, p. 553-556.
- ↑ Jaffre et al., Dunbrack, p. 1531-1537.
- ↑ Scinicariello et al., Sexton, p. 35-41.
- ↑ Chhabra, 2015.
- ↑ Richards, Brynda i Power, 2004, p. 1592-1593.
- ↑ Power, 1999, p. 3463-3504.
- ↑ Lee i Sekiguchi, 2011, p. 23.
- ↑ 18,0 18,1 18,2 18,3 Spike i Power, 2007, p. 85-87.
- ↑ Power, 2003, p. 2091-101.
- ↑ 20,0 20,1 Albright, Burdett i Whangbo, 2013.
- ↑ Ansyln i Dougherty, 2006, p. 41.
- ↑ Clauss et al., Landis, p. 417-434.
- ↑ Hiberty, Danovich i Shaik, 2015, p. 689-693.
Bibliografia
[modifica]- Albright, Jeremy K.; Burdett; Whangbo, Myung-Hwan. Orbital interactions in chemistry (en anglès), 2013. ISBN 9780471080398. OCLC 823294395.
- Ansyln, E. V.; Dougherty, D. A.. Modern Physical Organic Chemistry (en anglès). Sausalito, CA: University Science Books, 2006. ISBN 978-1-891389-31-3.
- Chhabra, Namrata «Effect of Lead poisoning on heme biosynthetic pathway» (en anglès). Clinical Cases: Biochemistry For Medics, novembre 2015. Arxivat de l'original el 2016-04-03 [Consulta: 18 agost 2023].
- Clauss, Allen D.; Nelsen, Stephen F.; Ayoub, Mohamed; Moore, John W.; Landis, Clark R. «Rabbit-ears hybrids, VSEPR sterics, and other orbital anachronisms» (en anglès). Chemistry Education Research and Practice, 15(4), octubre 2014. DOI: 10.1039/C4RP00057A. ISSN: 1756-1108.
- Dunitz, J. D.; Orgel, L. E.. Stereochemistry of Ionic Solids (en anglès). 2, 1960 (Advan. Inorg. and Radiochem.).
- Fox, M. A.; Whitesell, J. K.. Organic Chemistry (en anglès). Jones and Bartlett Publishers, 2004. ISBN 978-0-7637-2197-8.
- Gourlaouen, Christophe; Parisel, Olivier «Is an Electronic Shield at the Molecular Origin of Lead Poisoning? A Computational Modeling Experiment» (en anglès). Angewandte Chemie International Edition, 46(4), gener 2007. DOI: 10.1002/anie.200603037. PMID: 17152108.
- Hiberty, Philippe C.; Danovich, David; Shaik, Sason «Comment on "Rabbit-ears hybrids, VSEPR sterics, and other orbital anachronisms". A reply to a criticism» (en anglès). Chemistry Education Research and Practice, 16(3), juliol 2015. DOI: 10.1039/C4RP00245H.
- Jaffe, E. K.; Martins, J.; Li, J.; Kervinen, J.; Dunbrack, R. L. «The Molecular Mechanism of Lead Inhibition of Human Porphobilinogen Synthase» (en anglès). Journal of Biological Chemistry, 276(2), octubre 2000. DOI: 10.1074/jbc.M007663200. PMID: 11032836.
- Kumar, Anmol; Gadre, Shridhar R.; Mohan, Neetha; Suresh, Cherumuttathu H. «Lone Pairs: An Electrostatic Viewpoint» (en anglès). The Journal of Physical Chemistry A, 118(2), gener 2014. Bibcode: 2014JPCA..118..526K. DOI: 10.1021/jp4117003. ISSN: 1089-5639. PMID: 24372481.
- Lee, J. D.. Concise Inorganic Chemistry (en anglès). Van Nostrand, 1968 (Student's paperback edition).
- Lee, Vladimir Ya.; Sekiguchi, Akira. Organometallic Compounds of Low-Coordinate Si, Ge, Sn, and Pb: From Phantom Species to Stable Compounds (en anglès). John Wiley & Sons, 2011. ISBN 978-1-119-95626-6.
- McMurry, J. Organic Chemistry (5th Ed.) (en anglès). Ceneage Learning India Pvt Limited, 2000. ISBN 978-81-315-0039-2.
- Payne, D. J. «Electronic Origins of Structural Distortions in Post-Transition Metal Oxides: Experimental and Theoretical Evidence for a Revision of the Lone Pair Model» (en anglès). Physical Review Letters, 96(15), 2006. DOI: 10.1103/PhysRevLett.96.157403. PMID: 16712195.
- Power, Philip P. «π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements» (en anglès). Chemical Reviews, 99(12), desembre 1999. DOI: 10.1021/cr9408989. PMID: 11849028.
- Power, Philip P. «Silicon, germanium, tin, and lead analogues of acetylenes» (en anglès). Chemical Communications, 17, 2003. DOI: 10.1039/B212224C. PMID: 13678155.
- Quin, L. D.. A Guide to Organophosphorus Chemistry (en anglès). John Wiley & Sons., 2000. ISBN 0471318248.
- Richards, Anne F.; Brynda, Marcin; Power, Philip P. «Effects of the alkali metal counter ions on the germanium–germanium double bond length in a heavier group 14 element ethenide salt» (en anglès). Chem. Commun., 14, 2004. DOI: 10.1039/B401507J. PMID: 15263933.
- Scinicariello, Franco; Murray, H. Edward; Moffett, Daphne B.; Abadin, Henry G.; Sexton, Mary J. «Lead and δ-Aminolevulinic Acid Dehydratase Polymorphism: Where Does It Lead? A Meta-Analysis» (en anglès). Environmental Health Perspectives, 115(1), setembre 2006. DOI: 10.1289/ehp.9448. PMC: 1797830. PMID: 17366816.
- Spikes, Geoffrey H.; Power, Philip P. «Lewis base induced tuning of the Ge–Ge bond order in a "digermyne"» (en anglès). Chem. Commun., 1, 2007. DOI: 10.1039/b612202g. PMID: 17279269.
- Walsh, Aron «The origin of the stereochemically active Pb(II) lone pair: DFT calculations on PbO and PbS» (en anglès). Journal of Solid State Chemistry, 178(5), 2005. Bibcode: 2005JSSCh.178.1422W. DOI: 10.1016/j.jssc.2005.01.030.
- Walsh, Aron «Influence of the Anion on Lone Pair Formation in Sn(II) Monochalcogenides: A DFT Study» (en anglès). The Journal of Physical Chemistry B, 109(40), 2005b. DOI: 10.1021/jp051822r. PMID: 16853428.
Vegeu també
[modifica]- Complex de coordinació
- Enllaç covalent
- HOMO/LUMO (orbital molecular més alt ocupat i orbital molecular més baix no ocupat)
- Lligand