Model atòmic de Dalton

El model atòmic de Dalton és una teoria sobre la constitució de la matèria elaborada pel químic anglès John Dalton el 1808 que suposa que la matèria està constituïda per àtoms indivisibles i immutables. Amb ella Dalton pogué interpretar tot un seguit de fets experimentals, com és ara les relacions ponderals senzilles entre els composts químics.
Antecedents
[modifica]La idea de l'existència dels àtoms fou suggerida per primera vegada pels antics filòsofs naturals grecs Leucip (segle v aC) i Demòcrit (460 aC-370 aC). El seu successor, Epicur (341 aC-270 aC), la incorporà a una visió materialista del món sense déus, que fou universalment condemnat pels teòlegs cristians partidaris de les idees d'Aristòtil (384 aC- 322 aC). En conseqüència, les teories atomistes foren oblidades durant segles.
Durant el Renaixement el metge alemany Daniel Sennert (1572-1637) recupera per a l'alquímia algunes de les idees de Demòcrit i Epicur sense apartar-se de l'ortodòxia aristotèlica. Segons Sennert els quatre elements d'Aristòtil estan composts per àtoms diferents. Quan es combinen i reordenen donen lloc a una substància, però mantenen la seva essència fonamental.[1]
Al voltant de mitjan segle xvii s'havien imprès les obres dels atomistes grecs clàssics, traduïdes i comentades pels estudiosos com ara l'astrònom francès Pierre Gassendi (1592-1655), malgrat que encara hi havia una considerable hostilitat des del clergat de totes les tendències del cristianisme. També destaca l'anglès Walter Charleton (1619-1707) que fou l'introductor dels treballs de Gassendi a Anglaterra. Poc temps després el científic irlandès Robert Boyle (1627-1691), devot cristià que havia finançat les traduccions dels Evangelis en molts idiomes, no veié cap raó perquè una deïtat benigna no podria haver creat un univers atòmic i el defensà en el seu llibre El Químic Escèptic del 1661.
El 1789 el químic irlandès William Higgins (1763-1825) publicà el llibre Comparative View of Phlogistic and Antiphlogistic Theories on hi ha representades les partícules últimes i les relacions entre elles, inclosos uns símbols, similars als actuals, per mostrar com les partícules reaccionen i les forces entre elles. Empra com a símbols dels àtoms les inicials dels elements i lliga les lletres amb guions així com es fa actualment per representar els enllaços entre àtoms.[1]
Al 1808, John Dalton publicà les idees que havia anat elaborant els anys anteriors en el llibre A New System of Chemical Philosophy. Dalton era meteoròleg, i estava interessat en el comportament de l'atmosfera i dels gasos en general. En el capítol III, que duu per títol On Chemical Synthesis, Dalton exposa la seva teoria.

El model de Dalton
[modifica]El model de Dalton es pot resumir en les següents idees:
- Els elements químics estan constituïts per partícules discretes, diminutes i indivisibles, anomenades àtoms,[2] (del llatí atŏmus, i aquest, del grec ἄτομον átomon, neutre de ἄτομος átomos ‘que no es pot tallar’, ‘indivisible’)[3] que romanen inalterables en qualsevol procés químic.
- Els àtoms d'un mateix element són tots iguals en massa, mida i en qualsevol altra propietat física o química.
- Els compostos químics estan formats per «àtoms de compost» (molècules), tots iguals entre si, és a dir, quan dos o més àtoms de diferents elements es combinen per formar un mateix compost ho fan sempre en proporcions de massa senzilles, definides i constants.
- A les reaccions químiques, els àtoms ni es creen ni es destrueixen, només canvien la seva distribució.[2]
Justificació de les lleis ponderals
[modifica]La teoria de Dalton permet explicar fàcilment les lleis ponderals de les combinacions químiques, tres lleis empíriques sobre la matèria que s'havien anat descobrint a finals del segle xviii i no existia cap marc teòric a principis del segle xix per explicar-les.
Llei de conservació de la massa
[modifica]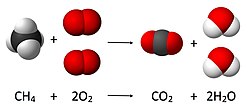
El químic francès Antoine Laurent Lavoisier (1743-1794) enuncià la llei de conservació de la massa en les reaccions químiques el 1782. Amb els seus estudis gravimètrics comprovà que la massa dels productes d'una reacció química (les substàncies que s'obtenen) sempre és igual a la massa dels reactius (les substàncies de partida).[4] Dalton realitzà la hipòtesi que els àtoms eren indivisibles, indestructibles i immutables, que els composts químics eren agrupacions senzilles d'àtoms, i que una reacció química era una reorganització de les unions entre els àtoms que formen els composts. Per tant, en una reacció química no hi pot haver cap variació de massa. La teoria de Dalton explica, doncs, d'una manera simple, la llei de Lavoisier.[5]
Llei de les proporcions definides
[modifica]
La llei de les proporcions definides o llei de Proust és una de les lleis ponderals de la química enunciada el 1794 pel químic francès Joseph Louis Proust (1754-1826), segons la qual si dos o més elements químics es combinen per formar un determinat compost químic ho fan en una relació de masses invariable.[6] La teoria de Dalton permet explicar aquesta llei també d'una manera simple perquè els composts químics resulten de combinacions d'àtoms i, com que aquests són tots iguals per a un mateix element químic i les combinacions han de ser en les mateixes proporcions, els composts químics tenen sempre els mateixos àtoms i en la mateixa proporció.[5]
Llei de les proporcions recíproques
[modifica]La llei de les proporcions recíproques o equivalents o llei de Richter és una llei ponderal enunciada cap al 1792 pel químic alemany Jeremias Benjamin Richter (1762-1807), segons la qual les masses d'elements diferents que es combinen amb una mateixa massa d'un element donat són les masses relatives d'aquells elements quan es combinen entre si, o bé múltiples o submúltiples d'aquestes masses. Existeixen, entre d'altres, el diclorur d'oxigen, , i el triòxid de difòsfor, . Les masses de Cl i de P per cada gram d'oxigen en els seus respectius composts és 4,432 g Cl/g O i 1,291 g P/g O, d'on s'obté una relació de 4,432/1,291 = 3,43 g Cl/g P. Si ara es combinen el clor i el fòsfor entre si s'obté el triclorur de fòsfor, , on la relació de masses és 3,43 g Cl/g P igual que l'expressada abans.[4] És evident que ha de ser així si es consideren els composts formats per combinacions d'àtoms que, si són del mateix element químic tenen una massa característica (massa atòmica) i diferent de la d'altres elements.
Llei de les proporcions múltiples
[modifica]La llei de les proporcions múltiples o llei de Dalton és una llei ponderal de la química enunciada el 1802 pel mateix John Dalton en el decurs del seu programa d'establiment de la teoria atòmica,[7][8] segons la qual les masses d'un mateix element que s'uneix amb una massa fixa d'un altre element per formar en cada cas un compost químic diferent, estan en relació de nombres enters simples.[9] Dalton deduí que havia de complir-se aquesta llei, que apareix en un article que llegí el 1802 i publicà el 1805.[10][11]
Llei de Gay-Lussac dels volums de combinació
[modifica]Per a Dalton, les últimes partícules dels elements gasosos com l'hidrogen, oxigen, clor, etc., eren necessàriament simples i estaven constituïdes per un sol àtom (així, H, O, CI, N…) i que les de compostos gasosos tan corrents com l'aigua o el clorur d'hidrogen eren naturalment composts, però eren naturalment compostes però formades per només dos àtoms diferents (HO, ClH). No obstant això, amb aquestes fórmules no es podien explicar les relacions volumètriques de Gay-Lussac:
La conclusió experimental de Gay-Lussac que un volum de clor s'uneix amb un volum d'hidrogen per donar lloc a dos volums de clorur d'hidrogen va portar Dalton a suposar que en els volums iguals de clor i d'hidrogen haurien d'existir igual nombre d'àtoms. En imaginar que aquests elements s'uneixen àtom a àtom, formaran un mateix nombre d'«àtoms» (avui molècules) de clorur d'hidrogen. En ser aquests «àtoms» i indivisibles, havien d'ocupar, en canvi, un volum doble segons els resultats de Gay Lussac. La hipòtesi que en volums iguals de gasos devien existir igual nombre d'«àtoms» va tenir Dalton que descartar arribant a la conclusió que els resultats de Gay-Lussac eren inexactes.
Per contra, si la llei de Gay-Lussac era certa, estava en contradicció amb els postulats de Dalton i la seva teoria atòmica.
Referències
[modifica]- ↑ 1,0 1,1 Joven Álvárez, E. Dalton. La teoria atómica. RBA, 2012. ISBN 9788447376483.
- ↑ 2,0 2,1 Myers, Richard. The Basics of Chemistry (en anglès). Greenwood Publishing Group, 2003. ISBN 9780313316647.
- ↑ «átomo» (en castellà). Real Academia Española. [Consulta: 17 març 2019].
- ↑ 4,0 4,1 Babor, J.A.; Ibarz, J. Química General Moderna (en castellà). 8a ed.. Barcelona: Marín, 1979. ISBN 84-7102-997-9.
- ↑ 5,0 5,1 Pauling, Linus. General Chemistry (en anglès). Courier Corporation, 2014-11-24. ISBN 9780486134659.
- ↑ «Llei de les proporcions definides | enciclopèdia.cat». [Consulta: 19 novembre 2018].
- ↑ Niaz, Mansoor «How Important are the Laws of Definite and Multiple Proportions in Chemistry and Teaching Chemistry? – A History and Philosophy of Science Perspective» (en anglès). Science and Education, 10, 3, 2001, pàg. 243–266. DOI: 10.1023/a:1008706213939. ISSN: 0926-7220.
- ↑ Pauling, L. General Chemistry (en anglès). San Francisco: Freeman, 1964.
- ↑ «llei de les proporcions múltiples | enciclopèdia.cat». [Consulta: 9 agost 2018].
- ↑ Dalton, John «Experimental Enquiry into the Proportion of the Several Gases or Elastic Fluids, Constituting the Atmosphere». Memoirs of the Literary and Philosophical Society of Manchester, 1, 1805, pàg. 244-258.
- ↑ «Dalton multiple proportions». [Consulta: 9 agost 2018].



