Teoria dels orbitals moleculars

En química, la teoria dels orbitals moleculars (TOM), és un mètode per a determinar l'estructura molecular en la qual els electrons no estan assignats a enllaços individuals entre àtoms, sinó que prenen un moviment que està sota la influència dels nuclis de tota la molècula.[1] En aquesta teoria, cada molècula té un grup d'orbitals moleculars, i s'assumeix que la funció d'ona ψf de l'orbital molecular està escrita com una simple suma entre els n orbitals atòmics constituents χi, d'acord amb la següent equació:[1]
Els coeficients cij poden ser determinats numèricament per substitució d'aquesta equació per la de Schrödinger i l'aplicació del principi variacional. Aquest mètode s'anomena combinació lineal d'orbitals atòmics i s'utilitza en la química computacional. Una transformació unitària addicional pot ser aplicada en el sistema per accelerar la convergència en algunes combinacions computacionals. La teoria dels orbitals moleculars ha estat vista com a competidora de la teoria de l'enllaç de valència en els anys trenta, però es va descobrir després que els dos mètodes estan íntimament relacionats i que quan són estesos són equivalents.
Visió general de la teoria
[modifica]D'acord amb la teoria dels orbitals moleculars, els enllaços covalents de les molècules es formen per superposició d'orbitals atòmics, de manera que els nous orbitals moleculars pertanyen a la molècula sencera i no a un sol àtom. Durant la formació d'un enllaç, els orbitals atòmics s'acosten i comencen a superposar-se, alliberant energia a mesura que l'electró de cada àtom és atret simultàniament per la càrrega positiva del nucli dels dos àtoms. Com més gran sigui la superposició, més gran serà el despreniment d'energia i, per tant, menor serà l'energia de l'orbital molecular. Si el procés d'aproximació dels àtoms continua, els nuclis atòmics poden arribar a repel·lir-se mútuament, cosa que fa que l'energia del sistema augmenti. Això vol dir que la màxima estabilitat (mínima energia) s'assoleix quan els nuclis es troben a una distància determinada que es coneix com a longitud d'enllaç.[2]
La MOT (Molecular orbital theory) proporciona una perspectiva global i deslocalitzada de l'enllaç químic. A la teoria MO, qualsevol electró d'una molècula pot trobar-se a qualsevol lloc de la molècula, ja que les condicions quàntiques permeten als electrons viatjar sota la influència d'un nombre arbitràriament gran de nuclis, sempre que es trobin en estats propis permesos per certes regles quàntiques. Així, quan s'exciten amb la quantitat d'energia necessària mitjançant llum d'alta freqüència o altres mitjans, els electrons poden passar a orbitals moleculars de més energia. Per exemple, en el cas simple d‟una molècula diatòmica d‟hidrogen, la radiació UV pot fer que un electró passi d‟un orbital d‟enllaç a un orbital d'antienllaç. Aquesta promoció debilita l‟enllaç entre els dos àtoms d‟hidrogen i pot provocar la fotodissociació, és a dir, la ruptura d‟un enllaç químic a causa de l'absorció de llum.
Segons la teoria dels orbitals moleculars, el nombre d'orbitals moleculars és igual al nombre d'orbitals atòmics que se solapen. L'orbital molecular de menor energia es forma quan se superposen dos orbitals atòmics que estan en fase. Aquest orbital conté els dos electrons i manté els dos àtoms units, per la qual cosa s'anomena orbital molecular enllaçant. No obstant això, es forma un altre orbital molecular, que té una energia més gran que la suma de les energies dels dos orbitals atòmics separats. Aquest orbital molecular s'anomena antienllaçant i és destructiu, és a dir, si els electrons es trobessin en aquest orbital, els dos àtoms es repel·lirien.[3] L'orbital antienllaçant correspon a la teoria de Lewis a l'orbital ocupat per aquells electrons que no es comparteixen (anomenats "parells no enllaçants" en aquesta teoria). Per exemple, en el cas de la molècula d'oxigen, hi ha dos parells enllaçants i quatre parells no enllaçants. Els parells enllaçants ocupen els orbitals sigma gerade i pi ungerade (al nivell 2 d'energia), els quals són orbitals enllaçants, i els parells no enllaçants ocupen els orbitals 2s (que no es comparteixen) i els orbitals pi gerade, atès que tenen menor energia (són més estables) que els sigma gerade.
La teoria dels orbitals moleculars s'utilitza per interpretar l'espectroscòpia ultraviolada-visible (UV-VIS). Els canvis en l'estructura electrònica de les molècules es poden veure per l'absorbància de la llum a longituds d'ona específiques. Es poden fer assignacions a aquests senyals indicats per la transició d'electrons que es mouen d'un orbital de menor energia a un altre de major energia. El diagrama d'orbitals moleculars per a l'estat final descriu la naturalesa electrònica de la molècula en un estat excitat.
Encara que a la teoria MO "alguns" orbitals moleculars poden contenir electrons que estan més localitzats entre parells específics d'àtoms moleculars, "altres" orbitals poden contenir electrons que estan repartits més uniformement per la molècula. Així, en general, l'enllaç està molt més deslocalitzat a la teoria MO, cosa que la fa més aplicable a molècules ressonants que tenen ordres d'enllaç equivalents no enters que la teoria d'enllaç de valència (VB). Això fa que la teoria MO sigui més útil per a la descripció de sistemes estesos.
Robert S. Mulliken, que va participar activament en l'adveniment de la teoria dels orbitals moleculars, considera que cada molècula és una unitat autosuficient. Afirma al seu article:
...Els intents de considerar una molècula com a formada per unitats atòmiques o iòniques específiques unides per nombres discrets d'electrons d'enllaç o parells d'electrons es consideren més o menys sense sentit, excepte com a aproximació en casos especials, o com a mètode de càlcul [. ..]. Una molècula és considerada aquí com un conjunt de nuclis, al voltant de cadascun dels quals s'agrupa una configuració electrònica molt similar a la d'un àtom lliure en un camp extern, excepte que les parts exteriors de les configuracions electròniques que envolten cada nucli solen pertànyer, en part, conjuntament a dos o més nuclis....[4]
Un exemple és la descripció MO del benzè, C
6H
6, que és un anell hexagonal aromàtic de sis àtoms de carboni i tres dobles enllaços d'enllaç σ (sigma), que es localitzen majoritàriament entre parells d'àtoms (C-C o C-H), de manera similar als electrons de la descripció de l'enllaç de valència deslocalitzats al voltant de l'anell. Dos d'aquests electrons estan en un MO que té contribucions orbitals iguals dels sis àtoms electrons estan en orbitals amb nodes verticals en angles rectes entre si. Com en la teoria VB, aquests sis electrons π deslocalitzats resideixen en un espai més gran que existeix per sobre i per sota del pla de l'anell químicament equivalents. En la teoria MO això és una conseqüència directa del fet que els tres orbitals π moleculars es combinen i reparteixen uniformement els sis electrons extra entre els sis àtoms de carboni.
En molècules com el metà, CH
4, els vuit electrons de valència es troben en quatre LOs que es reparteixen entre els cinc àtoms. És possible transformar els MOs en quatre orbitals sp3 localitzats. Linus Pauling, en 1931, va hibridar els orbitals 2s i 2p del carboni perquè apuntessin directament a les funcions base hidrogen 1s i presentessin una superposició màxim. No obstant això, la descripció de la MO deslocalitzada és més apropiada per predir les energies d'ionització i les posicions de les bandes d'absorció espectrals. Quan el metà s'ionitza, es pren un sol electró de la MO de valència, que pot provenir de l'enllaç s o dels nivells d'enllaç p triplement degenerats, produint dues energies d'ionització. En comparació, l'explicació a la teoria de l'enllaç de valència és més complicada. Quan s'elimina un electró d'un orbital sp3, s'invoca ressonància entre quatre estructures d'enllaç de valència, cadascuna de les quals té un enllaç d'un sol electró i tres enllaços de dos electrons. Els estats ionitzats triplement degenerats T2 i A1 (CH4+) es produeixen a partir de diverses combinacions lineals d'aquestes quatre estructures. La diferència d'energia entre l'estat ionitzat i l'estat bàsic dóna les dues energies d'ionització.
Igual que en el benzè, en substàncies com el betacarotè, la clorofil·la o l'hemo, alguns electrons dels orbitals π es reparteixen en orbitals moleculars al llarg de grans distàncies en una molècula, cosa que dóna lloc a l'absorció de llum en energies més baixes (l'espectre visible), que explica els colors característics d'aquestes substàncies.[5] Aquest i altres dades espectroscòpiques de molècules s'expliquen bé a la teoria MO, amb èmfasi en els estats electrònics associats amb orbitals multicèntrics, incloent-hi la barreja d'orbitals basada en principis de coincidència de simetria orbital.[6] Els mateixos principis MO també expliquen de forma natural alguns fenòmens elèctrics, com l'alta conductivitat elèctrica en la direcció plana de les làmines atòmiques hexagonals que existeixen en el grafit. Això resulta de la superposició contínua de bandes d'orbitals p semiplens i explica la conducció elèctrica. La teoria MO reconeix que alguns electrons a les làmines atòmiques de grafit estan completament deslocalitzats sobre distàncies arbitràries, i resideixen en orbitals moleculars molt grans que cobreixen tota una làmina de grafit, i alguns electrons són així tan lliures de moure's i, per tant, de conduir electricitat al pla de la làmina, com si residissin a un metall.
Història
[modifica]
El 1926, el físic alemany Friedrich H. Hund (1896-1997) especulà sobre l'assignació de nombres quàntics als estats electrònics de molècules diatòmiques, basant les seves assignacions en la correlació entre els estats diatòmics i els de l'àtom unit al límit. L'estatunidenc Robert S. Mulliken (1896-1986), que anteriorment havia considerat el problema d'aquesta assignació emprant la vella teoria quàntica, seguí Hund el 1927 en el marc de la nova teoria quàntica correlacionant els estats d’una molècula diatòmica des de l'àtom unit fins als àtoms separats. El 1932, introduí el terme orbital per referir-se als estats d'un electró en un àtom o molècula, sent el primer a explorar seriosament els orbitals de molècules poliatòmiques (1932).[7]
El físic danès Øyvind Burrau (1896-1979), el 1927, dugué a terme el primer intent reeixit de resoldre l'equació de Schrödinger per al catió H2⁺, i l'estatunidenc Edward U. Condon (1902-1974) assignà dos electrons a l'orbital de Burrau per obtenir una estimació de l'energia d'enllaç de H2. L'anglès John Lennard-Jones (1894-1954) introduí el model de combinació lineal d’orbitals atòmics el 1929 i, seguint el principi d’Aufbau, demostrà que aquest explicava el paramagnetisme del dioxigen O2. El mateix any l'estatunidenc John C. Slater (1900-1976) escriví funcions d’ona de molts electrons com determinants d’espín-orbitals, i Lennard-Jones el 1949 mostrà que amb aquesta formulació els orbitals moleculars podien transformar-se en funcions localitzades d’enllaç; això establí el vincle amb l’enfocament de la teoria d'enllaç de valència i la visió tradicional de l’enllaç químic.[7]
El 1930 l'alemany Erich Hückel (1896-1980) fou el primer a desenvolupar un model semiempíric d'orbitals moleculars per als hidrocarburs aromàtics, que més tard fou ampliat per altres per incloure funcions d’ona de tots els electrons. El químic britànic Samuel F. Boys (1911-1972) el 1950 identificà la implicació de les funcions gaussianes per al càlcul dels integrals de repulsió electrònica necessaris en els càlculs ab initio, i un enfocament posterior de l'austríac-estatunidenc Walter Kohn (1923-2016) i els seus col·laboradors (1964 i 1965) elaboraren una teoria dels orbitals moleculars basada en la funció de densitat, en què la repulsió electrònica es calcula a partir de la densitat electrònica total.[7]
Visió general de la teoria
[modifica]Segons la teoria dels orbitals moleculars, els enllaços covalents de les molècules es formen quan se superposen els orbitals atòmics, de manera que els nous orbitals moleculars pertanyen a la molècula sencera i no a un sol àtom. Durant la formació d'un enllaç, els orbitals atòmics s'acosten i comencen a superposar-se, alliberant energia a mesura que l'electró de cada àtom és atret per la càrrega positiva del nucli de l'altre àtom. Com més gran sigui la superposició, major serà el despreniment d'energia i, per tant, menor serà l'energia de l'orbital molecular. Si el procés d'aproximació dels àtoms continua, els nuclis atòmics poden arribar a repel·lir-se mútuament, el que fa que l'energia del sistema augmenti. Això significa que la màxima estabilitat (mínima energia) s'assoleix quan els nuclis es troben a una distància determinada que es coneix com a longitud d'enllaç.[8]
Segons la teoria dels orbitals moleculars, el nombre d'orbitals moleculars és igual al nombre d'orbitals atòmics que se superposen. L'orbital molecular de menor energia es forma quan se superposen dos orbitals atòmics que estan en fase. Aquest orbital conté els dos electrons i manté als dos àtoms units, per la qual cosa es denomina orbital molecular enllaçant. No obstant això, es forma un altre orbital molecular, que posseeix una energia major que la suma de les energies dels dos orbitals atòmics separats. Aquest orbital molecular s'anomena antienllaçant i és destructiu, és a dir, si els electrons es trobessin en aquest orbital, els dos àtoms es repel·lirien.[3]
El mètode LCAO
[modifica]En el cas d'una molècula diatòmica AB, el mètode LCAO parteix del fet que quan un electró, sota la influència dels dos nuclis, està pròxim al nucli A, és molt probable que pugui ser descrit per l'orbital atòmic del nucli A . De la mateixa manera l'orbital atòmic descriurà l'electró en les proximitats del nucli B. Les funcions i són solucions de l'equació de Schrödinger i se sap que qualsevol combinació lineal seva també n'és solució. Per exemple:
on i són números i és una constant de normalització.[9]
Ara cal cercar quins valors de i donen una energia més baixa, és a dir:
En resoldre aquestes equacions diferencials s'obtenen dues solucions, una per a i una altra per a . Per tant, les combinacions lineals que donen orbitals moleculars de més baixa energia són:[9]

En general, la combinació lineal de dos orbitals atòmics origina sempre dos orbitals moleculars, anomenats enllaçant () i antienllaçant ().
- L'orbital enllaçant és de més baixa energia que els orbitals atòmics que l'originen, i es caracteritza per una acumulació de densitat electrònica al llarg de l'eix d'enllaç entre els dos nuclis; mentre que
- l'antienllaçant és de més alta energia i presenta un pla nodal entre els dos nuclis.
El mètode d'orbitals moleculars, aproximació LCAO, permet una interpretació qualitativa de l'enllaç. Des del punt de vista quantitatiu, la forma de les funcions obtingudes és acceptable, però les energies dels orbitals poden ser afectades d'error notable. Hom l'ha emprat amb èxit per a descriure l'enllaç dels composts de coordinació.
Tipus d'orbitals
[modifica]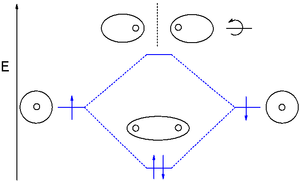
La teoria d'orbitals moleculars (MO) utilitza una combinació lineal d'orbitals atòmics (LCAO) per representar els orbitals moleculars resultants dels enllaços entre àtoms. Sovint es divideixen en tres tipus, d'enllaç, d'antienllaç i de no enllaç. Un orbital d'enllaç concentra la densitat electrònica a la regió entre un determinat parell d'àtoms, de manera que la seva densitat electrònica tendirà a atraure cadascun dels dos nuclis cap a l'altre i mantenir units als dos àtoms.[6] Un orbital antienllaçant concentra la densitat d'electrons "darrere" de cada nucli (és a dir, al costat de cada àtom que està més lluny de l'altre àtom), per la qual cosa tendeix a allunyar cadascun dels dos nuclis de l'altre i, de fet, afebleix l'enllaç entre els dos nuclis. Els electrons en orbitals no enllaçants tendeixen a estar associats amb orbitals atòmics que no interactuen positivament o negativament entre si, i els electrons en aquests orbitals ni contribueixen ni resten força a l'enllaç.[6]
Els orbitals moleculars es divideixen alhora segons els tipus d'orbitals atòmics a partir dels que es formen. Les substàncies químiques formaran interaccions d'enllaç si els orbitals es tornen més baixos en energia quan interactuen entre si. Es distingeixen diferents orbitals d'enllaç que es diferencien per la configuració electrònica (forma del núvol d'electrons) i pel nivell d'energia.
Els orbitals moleculars d'una molècula es poden il·lustrar a diagrames d'orbitals moleculars.
Els orbitals d'enllaç més comuns són els sigma (σ) que són simètrics respecte a l'eix d'enllaç, i els pi (Π) amb un nodal durant l'eix d'enllaç. Menys comuns són els orbitals delta (δ) i phi (φ) amb dos i tres plans nodals respectivament al llarg de l'eix de l'enllaç. Els orbitals antienllaçants s'indiquen amb un asterisc. Per exemple, un orbital pi antienllaçant es pot mostrar com π*.
Referències
[modifica]- ↑ 1,0 1,1 Daintith, J.. Oxford Dictionary of Chemistry. Nova York: Oxford University Press, 2004. ISBN 0-19-860918-3.
- ↑ Biasoli, Weitz, Chandías. Química Orgánica. Buenos Aires: Kapelusz, 1982.
- ↑ 3,0 3,1 Introduction to Molecular Orbital Theory Arxivat 2005-06-21 a Wayback Machine. - Imperial College London
- ↑ Mulliken, R. S. «Análisis de poblaciones electrónicas en funciones de onda moleculares LCAO-MO. I». The Journal of Chemical Physics, vol. 23, 10, 10-1955, pàg. 1833-1840. Bibcode: 1955JChPh..23.1833M. DOI: 10.1063/1.1740588. ISSN: 0021-9606.
- ↑ Griffith, J.S. y L.E. Orgel. "Ligand Field Theory". Arxivat 2017-06-17 a Wayback Machine. Q. Rev. Chem. Soc. 1957, 11, 381-383
- ↑ 6,0 6,1 6,2 Miessler y Tarr (2013), Química Inorgánica, 5ª ed, 117-165, 475-534.
- ↑ 7,0 7,1 7,2 Murrell, John N «The origins and later developments of molecular orbital theory» (en anglès). International Journal of Quantum Chemistry, 112, 17, 05-09-2012, pàg. 2875–2879. Arxivat de l'original el 2023-08-13. DOI: 10.1002/qua.23293. ISSN: 0020-7608 [Consulta: 24 novembre 2024].
- ↑ Biasoli, Weitz, Chandías. Química Orgánica. Buenos Aires: Kapelusz, 1982.
- ↑ 9,0 9,1 Cartmell, E.; Fowles, G. W. A.. Valencia y estructura molecular (en castellà). Reverte, 2022-09-01. ISBN 978-84-291-9169-1.














