Procés d'oxidació avançat
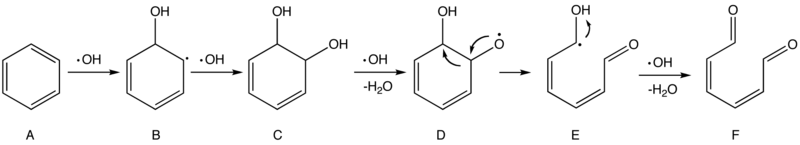
Els Processos d'Oxidació Avançada (PAO) o processos oxidatius avançats són aquells en els que es generen radicals hidroxils amb l'objectiu de degradar tots aquells compostos orgànics i inorgànics que no han estat oxidats mitjançant processos d'oxidació convencionals. La generació d'aquests radicals es pot realitzar a partir de diferents reaccions químiques. Les més comunes són les següents: fotòlisi, ozonització, tractaments electroquímics i ultrasons (US), entre d'altres.[1]
Els radicals hidroxils tenen un gran poder oxidatiu (Eº= 2.80 V), no selectiu per un ampli ventall de compostos orgànics, molt més gran que altres oxidants convencionals; O (Eº= 2.42 V), O₃ (Eº= 2.07 V), H₂O₂ (Eº= 1.78 V). Aquest fet fa que la seva utilització tingui especial rellevància en el tractament d'aigües residuals amb productes químics recalcitrants, productes tòxics i/o materials no biodegradables. D'altra banda, aquests processos poden esdevenir un bon sistema de post-tractament abans de la disposició final de molts residus.
Tipologies de reaccions per a la formació de radicals hidroxils[modifica]
UV- Fotòlisi (directa i indirecta)[modifica]
Quan els fotons UV (150–400 nm) irradien solucions aquoses altament fluides (500–4000 mJ / cm²). Les espècies químiques homogènies o heterogènies (o materials) presents a l'aigua absorbeixen la llum UV incident i se sotmeten a reaccions de foto-transformació per generar radicals hidroxil lliure.
- VUV (UV al buit) / fotòlisi de l'aigua
Aquest procés aprofita la irradiació a longituds d'ona menors que la UV-C (<190 nm). L'ús més important de la radiació UVV és la fotòlisi de l'aigua, que produeix radicals hidroxil i àtoms d'hidrogen amb rendiments quàntics dependents de la longitud d'ona d'irradiació.
H₂O + hv (<190 nm) → H• + HO•
- O₃/UV
La irradiació de l'ozó en aigua produeix H₂O₂ en forma quantitativa: .
El peròxid d'hidrogen així generat es fotolitza al seu torn generant radicals OH•
O₃ + H₂O + hv (254 nm) → 2HO• + O₂
- H2O2/UV
El clivatge de la molècula de H₂O₂ per fotons amb energia superior a la de la unió O–O produeix quantitativament 2 OH •per cada molècula de H2O2
H2O2 + hv (254 nm) → 2HO•
- UV/O3/ H2O2
L'addició de llum al procés H₂O₂ / O₃ produeix un augment net de l'eficiència, especialment per l'acceleració de l'equació: O3 + H2O2 → HO• + O2 + HO2•, que és molt lenta.
2O3 + H2O2+ hv (254 nm) → 2HO• + 3O2
- Foto-Fenton [3]
A causa a la regeneració contínua del Fe2+ per la fotoreducció del Fe3+, el reactiu Fenton es combina amb la radiació UV-Visible amb la generació de nous radicals hidroxil (• OH) a partir de H₂O₂. En aquest procés els complexos de Fe3+ pateixen una transferència de càrrega lligant-metall, donant lloc a la seva dissociació en Fe2+ i el lligand oxidat
Fe3+ + H2O + hv (>300 nm) → Fe2+ + HO• + H+
H2O2+ hv → 2HO•
- Fotocatàlisi /TiO2
Es basa en l'absorció de radiació per part d'una espècie fotosensible que és un catalitzador. La fotocatàlisi heterogènia radica en l'ús d'un sòlid semiconductor (TiO₂) en suspensió sota irradiació per generar una reacció en la interfase sòlid–líquid o sòlid–gas. El catalitzador ha de poder ser reutilitzat després d'actuar en el sistema d'oxidació-reducció. En aprofitar l'energia lumínica, els catalitzadors indueixen la formació de reactius hidroxils (• OH)
TiO2 + hv (>300 nm) → e-cb + h+vb
e-cb + O2 + 2H+→ H2O2
e-cb + H2O2 → HO• + OH-
h+vb + OH-ads → HO•
- Fotocatàlisi Ozó/ TiO2
La catàlisi heterogènia com a mètode d'oxidació avançada ofereix, respecte als sistemes catalítics homogenis, l'avantatge de la facilitat de separació del producte. El principal catalitzador que s'utilitza en ozonització és el TiO2. L'activitat catalítica està directament relacionada amb la capacitat de descomposició de l'ozó dissolt i la consegüent generació de radicals hidroxil. L'eficàcia de l'ozonització depèn en essència de les propietats físiques i químiques de la superfície catalítica i de la seva interacció amb les espècies presents a la dissolució, que en bona part són funció del pH del medi.
TiO2 + hv (> 300 nm) → e-cb + h+vb
e-cb + O3→ O3− → O2 + O−
O− + H2O → HO• + OH-
h+vb + OH-ads→ HO•
Avantatges de la fotòlisi[modifica]
Les velocitats d'oxidació solen ser molt altes, fet que fa reduir les dimensions de molts reactors. Processos com el Foto-Fenton redueixen la presència de fangs secundaris respecte al sistema Fenton convencional.
Inconvenients de la fotòlisi[modifica]
En els processos fotolítics, el cost de generació UV és elevat. A més a més, l'eficàcia de la radiació sol ser baixa, ja que cal que els compostos absorbeixin a una λ concreta. Cal destacar la importància del control pH en el sistema Foto-Fenton.
Ozonització [3][modifica]
L'ús de corrent altern d'alta tensió (20/06 kV) a través d'un espai de descàrrega dielèctrica que conté oxigen pur o aire sec, fa que les molècules d'O₂ es dissociïn en àtoms d'oxigen per formar ozó (O₃). Aquest corrent de gas d'ozó es bombolleja a l'aigua a fi que es descompongui en radicals hidroxil lliures.
- Ozonització en medi alcalí [4]
La descomposició d'ozó en solució aquosa forma OH˙, especialment quan és iniciada per OH–. L'ozó pot reaccionar en forma directa amb un substrat orgànic a través d'una reacció lenta i selectiva, equació (1), o d'una reacció radicalària afavorida en medi alcalí amb la generació de radicals hidroxils (ràpida, no selectiva i sensiblement més eficient), equació (2)
O3 + S → Sox (1)
2 O3 + H2O2 + OH- → OH• + 2 O2 + HO2• (2)
- O3/H2O2 [5]
L'addició de peròxid d'hidrogen al sistema d'ozonització produeix una millora de la tecnologia. El procés combina l'oxidació per ozó directa i indirecta. El H2O2 és un àcid feble, un poderós oxidant i un compost inestable. El H2O2 inicia la descomposició del O3 per transferència d'electrons generant 2 radicals hidroxils.
2O3 + H2O2→ 2HO• + 3O2
- O3/Fe2+ [3]
L'Ozonització catalítica homogènia es basa en l'activació de l'ozó pels ions Fe (II) presents en la solució aquosa. La seva naturalesa catalítica determina no només la velocitat de la reacció, sinó també la selectivitat i el consum d'ozó. La descomposició de l'ozó es millora amb els ions metàl·lics, el que condueix a la generació de radicals lliures, incloent radicals hidroxil.
Fe2+ + O3→ FeO2 + O2
FeO2+ + H2O → Fe3+ + HO• + HO-
Avantatges de l'ozonització[modifica]
Les tecnologies referents a reactors (gas-líquid) són ben conegudes. Els equips són fàcilment automatitzables, podent tractar diferents cabals a diferents concentracions. Les velocitats i eficàcies de degradació són molt altes. Aquest sistema també permet un estalvi en reactius.
Inconvenients de l'ozonització[modifica]
El cost de generació de l'O3 és elevat. En l'ozonització en medi alcalí es poden generar bromats i neutralitzadors com els carbonats.
Tractaments electroquímics [3][modifica]
Quan usem reaccions anòdiques indirectes i / o directes, un vector d'energia elèctrica impulsa la formació in situ d'oxidants (HO • o H2O2 o ambdós) i la seva posterior reacció amb espècies orgàniques a l'aigua.
- Oxidació anòdica
L'oxidació anòdica o electro-oxidació pot ser directa o indirecta. En el primer cas, el contaminant s'oxida directament per transferència de càrrega i en el segon, el contaminant s'oxida gràcies a espècies oxidants generades durant l'oxidació de l'aigua a l'ànode, fet que genera radicals hidroxils i protons.
H2O → H+ + HO•
- Electro-Fenton (EF) [6]
En el mètode d'EF, el Fe3+ soluble pot ser reduït catòdicament a Fe2+, procés que es coneix com a catàlisi electroquímica. Per tant, la ràpida generació de Fe2+ accelera la producció de radicals OH•. Aquest mètode permet un millor control de la generació d'aquests radicals. Els reactius Fenton (Fe2+, H2O2 o Fe2+/ H2O2) són afegits externament al reactor electroquímic.
O2(g) + 2H+ + 2e-→ H2O2 (càtode)
Fe2+ + H2O2 → Fe3+ + HO• + OH-
Avantatges tractaments electroquímics[modifica]
Gran eficàcia respecte altres processos. Disminució o eliminació de reactius.
Inconvenients tractaments electroquímics[modifica]
Cost elevat degut a la generació d'energia i els equips d'elèctrodes.
Radiació d'ultrasons [3][modifica]
Quan les ones sonores d'alta freqüència (20 kHz-1 MHz) generen cavitacions acústiques transitòries o estables en una solució aquosa ens referim a la sonoquímica. La cavitació implica la formació, el creixement i col·lapse de pressió bombolles amb la inducció de la dissociació tèrmica d'aigua en radicals hidroxil.
- US/O3 [7]
Els ultrasons aplicats a l'ozó en una dissolució aquosa permet la fotòlisi de l'aigua amb generació de radicals hidroxil. Al seu torn, l'ozó també en genera en dues reaccions consecutives.
H2O +))) → H• + HO•
O3 +))) → O2(g) + O(3P)
O(3P)(g) + H2O → 2HO•
- US/H2O2 [3]
Quan combinem els ultrasons amb el peròxid d'hidrogen, aquest s'escindeix i genera 2 radicals hidroxils.
H2O2 +))) → 2HO•
- Sono-Fenton
El procés sono-Fenton és la combinació de la sonoquímica produïda per les ones d'ultrasons amb el reactiu Fenton. En aquest procés, es generen un gran nombre de radicals lliures a conseqüència de l'elevada energia que es desprèn.
- H2O +))) → H• + HO•
- 2HO•→ H2O2
- Fe2+ + H2O2→ Fe3+ + HO• + OH-
- Fe3+ + H2O2 +))) → Fe2+ + HOO•
- O2 +))) → 2O•
- O• + H2O → 2HO•
Avantatges dels ultra sons[modifica]
Aquests sistemes no requereixen radiació, per tant, el cost referents als reactius és baix. La radiació amb ultrasons és un sistema que pot combinar-se fàcilment amb altres sistemes oxidatius.
Inconvenients dels ultra sons[modifica]
La radiació amb ultrasons té una important despesa energètica. Actualment encara es tracta d'un sistema en les seves primeres fases de desenvolupament.
Plasma no tèrmic[8][modifica]
S'aplica una descàrrega elèctrica a l'aigua i s'inicien col·lisions entre partícules carregades i molècules d'estat excitació-ionització neutre. Això genera un plasma no tèrmic que conté electrons energètics (e *) i radicals lliures.
Descàrrega elèctrica → e−* H2O + e−* → HO• + H• + e−
Radiòlisi ү [8][modifica]
Ús de les radiacions ionitzants de fonts radioactives (60Co) o acceleradors de partícules, la radiòlisi de l'aigua produeix tant la reducció com l'oxidació de les espècies de radicals.
H2O —ˆV→ H•, HO•, e-, H2O2, H2, H3O+, OH-
Avantatges dels POA[modifica]
- Transformació física i química del contaminant.
- Alta eficiència en la degradació de compostos no biodegradables.
- Possibilitat de degradar productes químics recalcitrants.
- Possibilitat de convertir productes químics recalcitrants en productes biodegradables, tractables, posteriorment, en un reactor biològic.
- Possibilitat de degradació a concentracions molt petites (ppb).
- Possibilitat d'utilització en sistemes de post-tractament d'altres tecnologies.
- No generen subproductes contaminants a diferència d'altres processos oxidatius com és el cas del clor.
- Generalment no es generen fangs residuals.
- Millora de les propietats organolèptiques de l'aigua.
- Gran flexibilitat en el disseny.
- Disponibilitat de realització en espais reduïts.
- Possibilitat d'operació en aigües subterrànies, superficials, aigües de piscina, reciclatge d'aigua i aigües industrials entre d'altres.
Inconvenients[modifica]
- Elevada despesa d'inversió referent a equipaments.
- En la majoria dels sistemes despesa energètica i costos operacionals elevats.
- Addició de reactius de forma constant durant tot el procés oxidatiu.
- No s'assoleix la mineralització total en algunes tecnologies de POA.
- Riscos de seguretat i per la salut.
Aplicacions[modifica]
Aquestes tecnologies es poden aplicar a molts processos industrials i en menys extensió a processos urbans que generen residus gasosos, aquosos i sòlids.
Els àmbits amb més incidència dels POA es troba a:
- Les aigües residuals, així com els lixiviats d'origen industrial i urbà.[8] A tall d'exemple, s'ha comprovat el bon tractament de les aigües provinents del sector tèxtil mitjançant POA.[9]
- Els gasos generats en processos industrials.
- Els sòls contaminats (remediació de sòls amb O₃ / H₂O₂ / UV).
En funció del cas, els objectius finals passen per:[8]
- La mineralització dels contaminants, especialment els contaminants orgànics recalcitrants (compostos alifàtics i aromàtics clorats, PCBs, nitroaromàtics, colorants azo, clorobenzè, PCP, fenols, fenols clorats, octacloro-p-dioxina i formaldehid) fins a la seva completa transformació en diòxid de carboni, aigua i anions inorgànics, evitant la formació de subproductes o residus (processos de caràcter destructiu).
- La degradació de contaminants orgànics en compostos més biodegradables i/o menys tòxics (pretractament abans d'un procés biològic).
- L'eliminació del color de les aigües residuals (en la indústria paperera) i/o l'olor de gasos i aigües residuals industrials.
- La desinfecció de l'aigua i eliminació eficaç de toxines com: policlorodibenzodioxines (PCDD) o policlorodibenzofurans (PCDF), i benzens entre d'altres.[11]
Notes[modifica]
- ↑ RIBEIRO, A. R. (2014). “An overview on the advanced oxidation processes applied for the treatment of water pollutants defined in the recently launched Directive 2013/39/EU”. Environment International; 75, p.33-51.
- ↑ ANDREOZZI, R. (1999). “Advanced Oxidation Process (AOP) for water purification and recovery”.Catalysisi Today; 35, p. 51-59.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 BOKARE, A. D. (2014). “Review of iron-free Fenton-like systems for activating H2O2 in advanced oxidation processes”. Hazarous Materials; 275,p. 121-135.
- ↑ DOMÈNECH,X. JARDIM,W. y LITTER,M. (2012). “Procesos avanzados de oxidación para la eliminación de contaminantes”.Capitulo 1. Minera Sustentable, Valentinuzzi.F
- ↑ CHANGHA, L. (2010). “Oxidative degradation of N-nitrosodimethylamine by conventional ozonation and the advanced oxidation process ozone/hydrogen peroxide”. Water research; 41, p.581-590.
- ↑ 6,0 6,1 6,2 HUANG,Y.J. PRIAMBODO,R. SHIH,Y.J. (2001). Treatment of real wastewater using semi batch (Photo)- Electro-Fenton method. Sustain. Environ. Res.,p. 389-393
- ↑ AYOUB, K. (2010). “Application of advanced oxidation processes for TNT removal: A review”. Hazardous Materials; 178, p.10-28.
- ↑ 8,0 8,1 8,2 8,3 PARSONS,S.(2004). ”Advanced oxidation processes for water and wastewater treatment” IWA Publishing
- ↑ 9,0 9,1 ASGHAR, A. (2014). “Advanced oxidation processes for in-situ production of hydrogen peroxide/hydroxyl radical for textile wastewater treatment: a review”. Cleaner Production.P.1-13.
- ↑ 10,0 10,1 Oller, I. (2008). “Depuración de aguas contaminadas con tóxicos persistentes mediante combinación de fotocatàlisis solar y oxidación biológica”. Tesis doctoral. Universidad de Almeria.
- ↑ VALLEJO, M. (2014). “Overview of the PCDD/Fs degradation potential and formation risk in the application of advanced oxidation processes (AOPs) to wastewater treatment”.Chemosphere; 118, p. 44-56.