Àcid cròmic
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 117,936 Da |
| Rol | carcinogen ocupacional |
| Estructura química | |
| Fórmula química | CrH₂O₄ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Solubilitat | 63 g/100 g (aigua, 20 ℃) |
| Punt de fusió | 197 ℃ |
| Punt de descomposició | 197 ℃ (mínim) 250 ℃ (màxim) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 0,0002 mg/m³ (8 h, cap valor) |
| IDLH | 15 mg/m³ |
El terme àcid cròmic normalment es fa servir per a una mescla feta afegint àcid sulfúric concentrat a un dicromat, el qual pot contenir una varietat de compostos, incloent el triòxid de crom sòlid. Aquest tipus d'àcid cròmic es pot usar com una mescla netejadora pels vidres. Àcid cròmic també es pot referir a l'espècie química molecular, H₂CrO₄ de la qual el triòxid és l'anhídrid. L'àcid cròmic presenta el crom en un estat d'oxidació de +6 (o VI). És un agent oxidant fort i corrosiu.
Àcid cròmic molecular
[modifica]
L'àcid cròmic molecular, H₂CrO₄, té molt en comú amb l'àcid sulfúric, H₂SO₄. Els dos estan classificats com àcids forts, ja que només el primer protó es perd fàcilment.
Àcid dicròmic
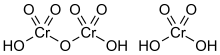
[modifica]L'àcid dicròmic, H₂Cr₂O₇, és la forma completament protonada d'un ió dicromat i també es pot veure com el producte d'afegir triòxid de crom a àcid cròmic molecular.
Seguretat
[modifica]Els compostos de crom hexavalent són tòxics i carcinògens. Per aquesta raó a escala industrial no es fa servir l'oxidació de l'àcid cròmic.
Notes
[modifica]Referències
[modifica]- Alcohols from Carbonyl Compounds: Oxidation-Reduction and Organometallic Compounds[Enllaç no actiu] (PDF)
