Alcohol
 | |
| Substància química | classe estructural d'entitats químiques |
|---|---|
| Rol | depressor |
| Estructura química | |
 | |
| Propietat | |
| Punt d'ebullició | 97,2 ℃ (a 1 atm) |
| Aquest article tracta sobre el compost químic. Vegeu-ne altres significats a «beguda alcohòlica». |

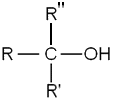
En química, un alcohol és qualsevol compost orgànic que conté un grup funcional hidroxil (-OH) enllaçat a un àtom de carboni i en substitució àtom d'hidrogen d'un grup alquil dels hidrocarburs saturats o alcans. La fórmula dels alcohols simples acíclics és CnH2n+1OH. Tanmateix, quan al llenguatge corrent es parla de l'alcohol, normalment es refereix a l'etanol, CH₃CH₂OH, el tipus d'alcohol que es troba a les begudes alcohòliques, com per exemple la cervesa, el vi, etc.
Història
[modifica]Les begudes amb contingut d'alcohol són conegudes des de la prehistòria, hi ha indicis de la fermentació de begudes al neolític i de la producció de cervesa a gran escala.
Els primers tipus de destil·lació haurien estat utilitzades pels babilonis a Mesopotàmia com a mínim des del segon mil·lenni aC.[1] Les excavacions arqueològiques al nord-oest del Pakistan han mostrat l'evidència que la destil·lació de l'alcohol era coneguda al subcontinent indi des del 500 aC[2] però que no hauria estat habitual fins a algun moment situat dintre del període entre el 150 aC i el 350.[2] Però els mètodes emprats no devien ser gaire efectius.[3] La paraula alcohol té origen àrab. A l'orient s'utilitzava un producte d'antimoni amb el nom àrab clàssic kuhl o més popularment kohól com a cosmètic per decorar les parpelles.[4]
L'aïllament de l'etanol en forma de compost pur va ser aconseguida pels alquimistes musulmans que van desenvolupar les tècniques de la destil·lació a l'època del califat abbàssida, entre els noms que coneixem destaquen els perses Jabir ibn Hayyan (Geber) i Al-Razí i l'àrab Al-Kindí. Els escrits atribueixen a Jabir ibn Hayyan (721-815) la invenció de l'alambí i la menció de l'aparició de vapors inflamables en bullir vi. Al-Kindí (801-873) va descriure la destil·lació del vi.[5] Al-Razí (864-930) va descriure la destil·lació de l'alcohol i la seva utilització en medicina.[6]
No obstant això, la historiografia occidental acostuma a situar l'obtenció de l'alcohol pur a principis del segle xiv, i atribuir-lo al metge Arnau de Vilanova, savi alquimista i professor de medicina a Montpeller. La cinquena essència de Ramon Llull no era res més que l'alcohol rectificat a una més suau temperatura. Lavoisier va ser qui va donar a conèixer l'origen i la manera de produir-se l'alcohol per mitjà de la fermentació vínica, demostrant que sota la influència del llevat de cervesa el sucre de raïm es transforma en àcid carbònic i alcohol. Va ser a més estudiat per Scheele, Gehl, Thénard, Duma i Boullay i el 1854 Berthelot el va obtenir per síntesi.[7]
Classificació dels alcohols
[modifica]
1) Metanol
2) Etanol (primari)
3) Propan-2-ol (secundari)
4) Tert-butanol (terciari).
Els alcohols poden ser primaris, secundaris o terciaris, en funció del nombre d'àtoms d'hidrogen substituïts en l'àtom de carboni al que es troba enllaçat el grup hidroxil.
- Alcohols primaris: el carboni del grup hidroxil està enllaçat com a mínim a dos àtoms d'hidrogen i a un radical orgànic R.
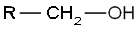
- CH₃-CH₂-OH (etanol)
- Alcohols secundaris: el carboni del grup hidroxil està enllaçat a un àton d'hidrogen i a dos radicals orgànics R i R'.

- (CH₂OH)₂CH-OH (propantriol, glicerol o glicerina)
- (CH₂OH)₃C-OH
- Tot i que els fenols són considerats de vegades com uns alcohols especials, al que el grup hidroxil està enllaçat al carboni d'un benzè, la seva reactivitat és molt diferent de la dels alcohols i generalment es classifiquen com un grup independent.

Nomenclatura
[modifica]Sistemàtica
[modifica]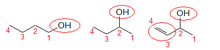
El sistema de nomenclatura de la IUPAC per a la química orgànica, que és la utilitzada pels organismes oficials, estableix que per formar els noms dels alcohols es parteix del nom de l'alcà progenitor i se substitueix els sufix -à per -ol i, quan cal, identificant la posició de l'àtom del carboni al que es troba enllaçat el grup hidroxil.[8]
Per exemple, el propà és un alcà compost per tres carbonis, CH₃CH₂CH₃, els carbonis es numeren de manera que s'atorgui al grup funcional el número més baix possible (habitualment es prefereix la numeració de dreta a esquerra), en aquest cas, atès que es tracta d'una cadena simètrica, la posició 1 i 3 són equivalents (només s'utilitza la 1) i podrien numerar la cadena de carbonis per les dues bandes sense canviar el resultat. Tenim en compte això si substituïm un enllaç a un hidrogen per un hidroxil a un dels carbonis dels extrems tindrem (en aquest cas tenim el radical hidroxil a la dreta i comencem a numerar per aquesta banda):
- Propan-1-ol: CH₃CH₂CH₂OH
I si la substitució afecta el carboni central, el 2, tindrem:
- Propan-2-ol: CH₃CH(OH)CH₃
De vegades el nombre que indica la posició del grup hidroxil s'escriu abans del nom, per als dos exemples que ens ocupen tindrien el noms: 1-propanol i 2-propanol.
En els cas dels polialcohols, als que hi ha més d'un grup hidroxil, s'utilitzen els sufixes -diol, -triol, -tetrol, -pentol, etc. En el nostre exemple, prenem com a base el propà, tindrien dues possibles combinacions amb dos grups hidroxils (noteu que a les imatges següents la numeració dels carbonis va d'esquerra a dreta, però això no afecta més que a la representació gràfica de la molècula atès que tenim tres carbonis i la molècula és simètrica, un grup hidroxil en posicions 2 i 3 és el mateix que en posicions 1 i 2):
-
Propan-1,2-diol o 1,2-propandiol
-
Propan-1,3-diol o 1,3-propandiol
En els casos de compostos on participa el grup hidroxil però no és la funció principal (no és un alcohol) s'utilitza el prefix hidroxi en comptes del sufix -ol.
Noms tradicionals
[modifica]Hi ha una nomenclatura antiga (i no sistemàtica) que encara s'utilitza en alguns àmbits no científics ni oficials: per a designar un alcohol s'anteposa la paraula alcohol i substituint el sufix -à de l'alcà del qual deriva pel sufix -ílic. Així, per exemple, tindríem: alcohol metílic pel metanol, etílic per l'etanol, propílic, etc.
Formulació
[modifica]Els alcohols alifàtics responen a la fórmula general: CnH2n+1OH. Hi ha, però, moltes menes d'alcohols, que contenen dobles i triples enllaços, anells aromàtics o altres grups funcionals, i que no responen a aquesta fórmula general.
Propietats físiques i químiques
[modifica]Aspecte
[modifica]Els alcohols amb una baixa massa molecular són líquids incolors a temperatura ambient i d'olor característica. En augmentar la massa molecular, augmenta el punt de fusió i ebullició, de manera que poden arribar a ser sòlids a temperatura ambient. Per exemple, el 2-Metilpropan-2-ol (tert-Butanol) té el punt de fusió a uns 25 °C mentre que el pentaeritritrol (2,2-bis(hidroximetil)1,3-propanediol) es fon a 260,5 °C.
Polaritat i presència d'enllaços hidrogen
[modifica]El grup hidroxil comporta habitualment que la molècula de l'alcohol sigui polar, això és a causa de la seva geometria (teoria VSEPR Valence Shell Electronic Pairs Repulsion o Repulsió dels Parells Electrònics de la Capa de València RPECV) i a l'electronegativitat del carboni, de l'oxigen i de l'hidrogen (Xsi(O)>Xsi(C)>Xsi(H)). Aquests grups poden formar enllaços hidrogen entre si o amb altres compostos, això explica la seva solubilitat en aigua i en els altres alcohols.
Punt d'ebullició
[modifica]El punt d'ebullició dels alcohols és força elevat per dues causes fonamentals:
- El nombre de grups hidroxil.
- La llargària i forma cadena de carbonis (a causa de les forces de van der Waals).
A més,
- El punt d'ebullició serà més elevat com més gran sigui el nombre de radicals hidroxil. Per exemple, un diol tindrà una temperatura d'ebullició superior a la de l'alcohol simple equivalent, que al seu torn també tindrà una temperatura d'ebullició superior a la de l'hidrocarbur progenitor. Per exemple, en el cas dels alcohols derivats del propà com el propan-1,2,3-triol (tres hidroxils) bull a 290 °C, el propan-1,2-diol (dos hidroxils) a 188,2 °C i el propan-1-ol a 97,1 °C (un hidroxil).
- Com més llarga sigui la cadena de carbonis més alt serà el punt d'ebullició. Per exemple, en el cas dels alcohols amb cadenes lineals tenim que el metanol bull a 64,7 °C, l'etanol a 78,4 °C, el propan-1-ol a 97,1 °C, el butan-1-ol a 117,2 °C, el pentan-1-ol a 137,98 °C i l'hexan-1-ol a 158 °C.
Com més lineal sigui la cadena serà més susceptible de patir les forces de van der Waals i més alt serà el punt d'ebullició. Per exemple, així el pentan-1-ol bull a 137,98 °C, el 2-metilbutan-1-ol a 131 °C i el 2,2-dimetilpropan-1-ol a 102 °C.
- Els punts de fusió i ebullició dels alcohols solen estar molt separats, de manera que es fan servir sovint com a components de barreges anticongelants. Per exemple, l'1,2-etandiol té un punt de fusió de -16 °C i un punt d'ebullició de 197 °C.
Solubilitat
[modifica]Els alcohols acostumen a ser solubles en aigua en proporcions variables, la seva solubilitat depèn dels dos factors citats adés: el nombre de grups hidroxils i la llargària i forma cadena de carbonis, però en aquest cas tenen un paper oposat.
- La cadena de carbonis és hidròfoba i com més llarga sigui més tendirà cap a la insolubilitat la molècula.
- Els radicals hidroxil són hidròfils i tendiran a fer la molècula més soluble.
Per tant,
- Els alcohols seran més solubles en aigua com més curta sigui la cadena de carbonis. Per exemple, l'etanol i el propan-1-ol són solubles en aigua en totes les proporcions, el le butan-1-ol en una proporció de 79 g·l−1, el pentan-1-ol de 23 g·l−1, l'hexan-1-ol de 6 g·l−1, l'heptan-1-ol de 2 g·l−1 i els alcohols més pesants són pràcticament insolubles.
- Com més grups hidroxil hi hagi més soluble serà l'alcohol. Per exemple, els butanediols (butan-1,2-diol, butan-1,3-diol, butan-1,4-diol i butan-2,3-diol), amb dos grups hidroxil, són solubles en aigua en totes les proporcions mentre que el butan-1-ol només ho és en una proporció de 79 g·l−1.
- Si la cadena de carbonis no és lineal la solubilitat serà més elevada. Per exemple, el 2,2-dimetilpropan-1-ol és soluble en una proporció de 102 g·l−1, el 2-metilbutan-1-ol en una proporció de 100 g·l−1 i el pentan-1-ol de 23 g·l−1.
Els alcohols amb una massa molecular baixa acostumen a ser solubles en solvents orgànics com la propanona o els èters.
Densitat
[modifica]Els alcohols acostumen a tenir una densitat més petita que la de l'aigua, però alguns com per exemple els polihidroxílics i els que tenen anells aromàtics que presenten una densitat més gran que la de l'aigua
Reactivitat
[modifica]Acidesa
[modifica]La forta polarització de l'enllaç O-H dona a possibilitat d'una ruptura iònica, de manera que els alcohols constitueixen àcids febles o molt febles per alliberament d'un protó H+ del grup hidroxil, amb un pKa comprés entre 16 i 18 en aigua (10 per als fenols). Són més febles que l'aigua, excepció feta del metanol, i només manifesten el seu caràcter àcid en solucions no aquoses, reaccionant per exemple amb una base com l'amidur de sodi (NaNH₂) a una solució d'hidròxid d'amoni (NH₄OH). La base conjugada d'un alcohol és un alcoholat (o alcòxid).
Un dels parells lliures de l'oxigen pot ser capturat per un protó, per això l'alcohol també és una base química segons la definició de Brønsted i Lowry, amb un pKa(ROH₂+/ROH) al voltant de -2, el seu àcid conjugat, l'ió alquiloxoni, és un àcid fort i només pot estar present en petites quantitats.
Nucleofília
[modifica]Els alcohols són bons nucleòfils, aquesta propietat és sempre deguda a la reactivitat dels parells lliures de l'oxigen del grup hidroxil.
Nucleofugacitat
[modifica]L'enllaç C-O és polaritzat i això comporta la possibilitat d'una ruptura iònica: R-OH → R+ + HO-. Aquesta ruptura és molt difícil, fent que el grup hidroxil sigui un mal nucleòfug. Tanmateix, en el cas de l'ió alquiloxoni la ruptura és molt més fàcil.
Deshidratació d'alcohols
[modifica]La deshidratació d'alcohols és el procés químic que consisteix en la transformació d'un alcohol per a passar a ser un alquè per procés d'eliminació. Per realitzar aquest procediment es fa servir un àcid mineral per extreure el grup hidroxil (OH) des de l'alcohol, generant una càrrega positiva en el carboni del qual va ser extret l'hidroxil el qual té una interacció elèctrica amb els electrons més propers (per defecte, electrons d'un hidrogen en el cas de notenir un altre substituent) que formen un doble enllaç en el seu lloc.
Un exemple simple és la síntesi del ciclohexà per deshidratació del ciclohexanol. Es pot veure l'acció de l'àcid sulfúric (H2SO4) el qual treu el grup hidroxil de l'alcohol, generant el doble enllaç i aigua.
Aplicacions
[modifica]

Els alcohols tenen aplicacions en begudes, com a combustible, en la indústria, la medicina i la ciència en general. L'etanol és l'únic alcohol apte per al consum humà i ha format part de les begudes alcohòliques consumides per la població des d'èpoques prehistòriques (cervesa, vi).
Alguns alcohols, especialment l'etanol i el metanol poden ser utilitzats com a combustible i tenen una combustió més neta que la de la gasolina o el gasoil. L'eficiència del combustible pot ser millorada sobrealimentant els motors de combustió interna injectant alcohol després que el turbocompressor o el sobrealimentador hagi pressuritzat l'aire. Això refreda l'aire a pressió provocant un augment de la seva densitat, el que permet més quantitat de combustible i, en conseqüència, més potència.
Els alcohols tenen una gran gamma d'usos en la indústria i en la ciència com a dissolvents. L'etanol és utilitzat sovint com a dissolvent en fàrmacs, perfums i en essències vegetals com la vainilla gràcies a la seva baixa toxicitat i gran capacitat de dissoldre substàncies no polars. Els alcohols serveixen sovint com a intermediaris versàtils en la síntesi orgànica.
També tenen utilitzacions com a anticongelants, per exemple, és força habitual l'ús d'una solució al 50% de volum de glicol i aigua.
L'etanol pot ser utilitzat com a antisèptic, per desinfectar la pell, sovint amb iode.
Alcohol de farmaciola
[modifica]L'alcohol de farmaciola pot tenir diverses composicions. Pot ser totalment alcohol etílic de 96°, amb algun additiu com el clorur de benzalconi o alguna substància per donar-li un gust desagradable. És el que es coneix com a alcohol etílic desnaturalitzat.
Si conté només etanol, es podria arribar a beure amb els mateixos efectes que una beguda alcohòlica. De fet, a Suècia per comprar alcohol en una farmàcia es necessita recepta mèdica, per controlar els que se'l podrien beure.
Altres composicions: podria contenir alcohol isopropílic, no és apte per beure, però pot ser més efectiu per a l'ús com a assecant.
Habitualment l'alcohol etílic té una concentració de 96°, però, per a ús com a desinfectant, és més efectiu si aquest és rebaixat fins a una concentració de 70°.
Síntesi al laboratori
[modifica]Hi ha diferents mètodes per a la preparació d'alcohols al laboratori:
- Per mitjà d'una reacció d'un haloalcà amb una solució aquosa d'hidròxid de sodi o hidròxid de potassi es poden obtenir principalment alcohols primaris per substitució nucleofílica.
- Els aldehids o les cetones poden ser reduïdes amb tetrahidroborat de sodi o amb hidrur de liti i alumini. Una altra reducció possible per a l'obtenció d'alcohols és la reducció de Meerwein-Ponndorf-Verley.
- Els alquens per mitjà d'una reacció d'hidratació catalitzada per àcid sulfúric donen habitualment alcohols secundaris o terciaris. La hidroboració i l'oximercuració dels alquens són reaccions més fiables en síntesi orgànica. Els alquens reaccionen amb la N-bromosuccinimida (NBS) i l'aigua en una reacció de formació d'Halohidrina.
- El reactiu de Grignard reacciona amb els grups carbonil per produir alcohols secundaris i terciaris. Algunes reaccions habituals són la de Barbier i la de Nozaki-Hiyama.
- La hidrogenació asimètrica de Noyori permet una reducció asimètrica de β-cetoèsters.
- Les amines poden ser convertides en una sal de diazoni que al seu torn és hidrolizada.
Manera en què es forma un alcohol secundari per reducció i hidratació del borohidrur de sodi (NaBH₄):

Producció
[modifica]Industrialment els alcohols es produeixen de diferents maneres:
- Metanol:
- En el passat s'obtenia per destil·lació de fusta seca, per això de vegades també rep la denominació d'alcohol de fusta.
- Avui dia per hidrogenació catalítica del monòxid de carboni: el gas natural i vapor d'aigua es reformen en un form per produir hidrogen i monòxid de carboni; llavors aquests dos últims gasos reaccionen en presència d'un catalitzador i sota pressió. El procés de reforma és endotèrmic i la síntesi és exotèrmica.
- Etanol:
- Per fermentació utilitzant glucosa produïda a partir de sucre procedent de la hidròlisi de midó, en presència de llevat i a una temperatura inferior a 37 °C. Per exemple, la conversió d'invertasa a glucosa i fructosa o la conversió de glucosa a zimasa i etanol.
- Per hidratació directa de l'etilè[10] o altres Alquens a partir d'un procés de cracking de fraccions procedents de la destil·lació del petroli.
Toxicitat
[modifica]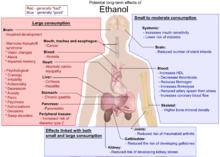
L'etanol és un líquid incolor, volàtil i d'olor suau que es pot obtenir de la fermentació dels sucres. A escala industrial és més habitual la seva obtenció a partir la hidratació de l'etilè (una reacció de l'etilè amb l'aigua en presència d'àcid fosfòric.[10] L'etanol és el depressor més utilitzat al món i ho ha estat des de fa mil·lennis, aquesta utilització pot conduir a l'addicció coneguda com a alcoholisme.
L'etanol de les begudes alcohòliques ha estat consumit pels éssers humans des de temps prehistòric per una sèrie de raons higièniques, dietètiques, medicinals, religioses i recreatives. El consum de grans dosis d'etanol causa embriaguesa (intoxicació alcohòlica), que pot provocar ressaca una vegada se n'han acabat els efectes. Com que l'etanol perjudica les habilitats cognitives, pot incitar a comportaments temeraris o irresponsables. Beure alcohol també pot afectar el rendiment posterior a la ingesta.[11][12] Segons la dosi i la freqüència amb què es consum, l'etanol pot causar coma etílic, una fallida respiratòria aguda o fins i tot la mort.
L'LD50 de l'etanol en les rates és de 10.300 mg/kg.[13] Altres alcohols són significativament més tòxics que l'etanol, en part perquè triguen molt més a ser metabolitzats i en part perquè la seva metabolització produeix substàncies que són encara més tòxiques. El metanol (alcohol de fusta), per exemple, és oxidat al fetge en el verí formaldehid per l'enzim alcohol deshidrogenasa; això pot provocar ceguesa o mort.[14]
Un tractament eficaç per evitar la toxicitat de formaldehid després d'ingerir metanol és administrar etanol. L'alcohol deshidrogenasa té una major afinitat per l'etanol, evitant així que el metanol s'hi uneixi i serveixi de substrat. Així, la resta de metanol tindrà temps de ser excretada pels ronyons. El formaldehid que quedi serà convertit en àcid fòrmic i després excretat.[15][16]
El metanol en si, tot i ser verinós, té un efecte sedant molt menys potent que l'etanol. Alguns alcohols de cadena llarga com per exemple l'n-propanol, l'isopropanol, l'n-butanol, el t-butanol i el 2-metil-2-butanol sí que tenen efectes sedants més potents, però també són més tòxics que l'etanol.[17][18] Aquests alcohols de cadena llarga es troben com a contaminants en algunes begudes alcohòliques i són coneguts com a alcohols de fusel,[19][20] i tenen la reputació de causar una ressaca greu, tot i que no està clar si els alcohols de fusel en són l'autèntica causa.[21] Molts alcohols de cadena llarga són utilitzats per la indústria com a dissolvents i a vegades els alcohòlics n'abusen,[22][23] causant-los una varietat de problemes de salut.[24]
Llista dels alcohols més importants
[modifica]| Alcohols més importants, amb punt de fusió, punt d'ebullició i solubilitat. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Referències
[modifica]- ↑ Martin Levey (1956). "Babylonian Chemistry: A Study of Arabic and Second Millennium B.C. Perfumery", Osiris 12, p. 376-389.
- ↑ 2,0 2,1 Allchin, F. R. (Mar., 1979). India: The Ancient Home of Distillation?. Man, New Series, Vol. 14, Num. 1, pàg. 55–63. Royal Anthropological Institute of Great Britain and Ireland.
- ↑ Forbes, R. J.. A Short History of the Art of Distillation from the Beginnings up to the Death of Cellier Blumenthal. BRILL, 1970. ISBN 9004006176., pàgines 53-54
- ↑ Breve Diccionario Etimológico de la Lengua Castellana. Joan Corominas. Ed. Gredos. Madrid 1990. ISBN 84-249-1332-9
- ↑ Hassan, Ahmad Y. «Alcohol and the Distillation of Wine in Arabic Sources». History of Science and Technology in Islam. [Consulta: 29 març 2008].
- ↑ Hassan, Ahmad Y. «Technology Transfer in the Chemical Industries». History of Science and Technology in Islam. [Consulta: 29 març 2008].
- ↑ Diccionario enciclopédico popular ilustrado Salvat (1906-1914)
- ↑ Nomenclatura de química orgànica: Seccions A, B i C: Regles definitives de 1979. Divisió de Química Orgànica, Unió Internacional de Química Pura i Aplicada. Edició a cura d'Àngel Messeguer i Peypoch i Miquel Àngel Pericàs i Brondó. Barcelona: Consell Superior d'Investigacions Científiques i Institut d'Estudis Catalans, 1989. Aquesta publicació es coneix com a llibre blau
- ↑ Global Status Report on Alcohol 2004
- ↑ 10,0 10,1 Lodgsdon, J.E. (1994). "Ethanol." a J.I. Kroschwitz (Ed.) Encyclopedia of Chemical Technology, 4a ed. vol. 9, pàg. 820. Nova York: John Wiley & Sons.
- ↑ Dorafshar AH, O'Boyle DJ, McCloy RF «Effects of a moderate dose of alcohol on simulated laparoscopic surgical performance». Surg Endosc, 16, 12, 2002, pàg. 1753-8. DOI: 10.1007/s00464-001-9052-3. PMID: 12140623.
- ↑ Kocher H, Warwick J, Al-Ghnaniem R, Patel A «Surgical dexterity after a 'night out on the town'». ANZ J Surg, 76, 3, 2006, pàg. 110-2. DOI: 10.1111/j.1445-2197.2006.03664.x. PMID: 16626342.
- ↑ Robert S. Gable «Comparison of acute lethal toxicity of commonly abused psychoactive substances» (reimpressió). Addiction, 99, 6, 2004, pàg. 686–696. Arxivat de l'original el 2006-08-10. DOI: 10.1111/j.1360-0443.2004.00744.x [Consulta: 5 juliol 2009].
- ↑ «Methanol and Blindness». Ask A Scientist, Chemistry Archive. Arxivat de l'original el 2013-06-17. [Consulta: 22 maig 2007].
- ↑ Zimmerman HE, Burkhart KK, Donovan JW. Ethylene glycol and methanol poisoning: diagnosis and treatment. Journal of Emergency Nursing. 1999 Apr;25(2):116-20. PMID: 10097201
- ↑ Lobert S. Ethanol, isopropanol, methanol, and ethylene glycol poisoning. Critical Care Nurse. Desembre del 2000; 20(6):41-7. PMID: 11878258
- ↑ McKee M, Suzcs S, Sárváry A, Adany R, Kiryanov N, Saburova L, Tomkins S, Andreev E, Leon DA. The composition of surrogate alcohols consumed in Russia. Alcoholism, Clinical and Experimental Research. Octubre del 2005; 29(10):1884-8. PMID: 16269919
- ↑ Bunc M, Pezdir T, Mozina H, Mozina M, Brvar M. Butanol ingestion in an airport hangar. Human and Experimental Toxicology. Abril del 2006; 25(4):195-7. PMID: 16696295
- ↑ Woo KL. Determination of low molecular weight alcohols including fusel oil in various samples by diethyl ether extraction and capillary gas chromatography. Journal of AOAC International. Setembre-octubre del 2005; 88(5):1419-27. PMID: 16385992
- ↑ Lachenmeier DW, Haupt S, Schulz K. Defining maximum levels of higher alcohols in alcoholic beverages and surrogate alcohol products. Regulatory Toxicology and Pharmacology. Abril del 2008; 50(3):313-21. PMID: 18295386
- ↑ Hori H, Fujii W, Hatanaka Y, Suwa Y. Effects of fusel oil on animal hangover models. Alcohol Clinical and Experimental Research. 2003 Aug;27(8 Suppl):37S-41S. PMID: 12960505
- ↑ Wiernikowski A, Piekoszewski W, Krzyzanowska-Kierepka E, Gomułka E. Acute oral poisoning with isopropyl alcohol in alcoholics. (polonès) Przeglad Lekarski. 1997;54(6):459-63. PMID: 9333902
- ↑ Mańkowski W, Klimaszyk D, Krupiński B. How to differentiate acute isopropanol poisoning from ethanol intoxication? -- a case report. (polonès) Przeglad Lekarski 2000;57(10):588-90. PMID: 11199895
- ↑ Bogomolova IN, Bukeshov MK, Bogomolov DV. The forensic medical diagnosis of intoxication of alcohol surrogates by morphological findings. (rus) Sudebno Meditsinskaia Ekspertiza. 2004 September-October;47(5):22-5. PMID: 15523882
- ↑ Ciclopentanol
Bibliografia
[modifica]- Peter Anderson i Ben Baumberg. L'alcohol a Europa. Perspectiva de la salut pública. Arxivat 2010-12-25 a Wayback Machine. Informe per a la Comissió Europea. Institute of Alcohol Studies, Regne Unit, Juny de 2006. Versió en català disponible a la xarxa.
- Metcalf, Allan A. The World in So Many Words. Houghton Mifflin, 1999. ISBN 0395959209.
Enllaços externs
[modifica]- IUPAC Nomenclature of Organic Chemistry, versió consultable en línia.