Biofilm

Una biopel·lícula o biofilm és una comunitat estructurada de microorganismes envoltats d'una matriu polimèrica autodesenvolupada i adherida a una superfície vivent o inerta. Així doncs, alguns dels principals trets que caracteritzen als biofilms són: adjunció de superfície, heterogeneïtat estructural, diversitat genètica, interaccions comunitàries complexes i una matriu extracel·lular de substàncies polimèriques. Els mecanismes moleculars que regulen la formació de biofilms varien molt entre una espècie i una altra i inclús entre diferents soques d'una mateixa espècie.[1]
Els organismes unicel·lulars senzills exhibeixen per regla general dos models clars de creixement. El primer és el de forma lliure flotant, o planctònica, forma en la qual les cèl·lules floten o neden independentment en algun medi líquid. El segon és un estat cooperatiu en el qual les cèl·lules s'empaqueten fermament unides a l'una a l'altra, creant normalment una superfície sòlida. Aquesta modificació del comportament cel·lular és provocat per molts factors, incloent-hi la percepció de quòrum, així com altres mecanismes que varien entre espècies.[2] Quan una cèl·lula canvia de model de creixement, sofreix un canvi fenotípic en el qual moltes sèries de gens modifiquen la seva regulació.[3]
Formació
[modifica]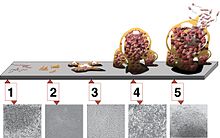
La formació d'una biopel·lícula comença amb l'adjunció de microorganismes lliures flotants a una superfície. Aquests primers colonitzadors s'adhereixen a la superfície inicialment a través de forces de van der Waals dèbils i reversibles. Si els colonitzadors no se separen immediatament de la superfície, es poden ancorar permanentment utilitzant estructures d'adhesió cel·lular com els pili.[4]
Els primers colonitzadors faciliten l'arribada d'altres cèl·lules proporcionant diversos llocs d'adherència i començant a construir la matriu que mantindrà unida la biopel·lícula. Algunes espècies no es poden unir a una superfície per elles mateixes, però són capaces d'ancorar-se a la matriu o directament a anteriors colonitzadors. Una vegada que la colonització ha començat, la biopel·lícula augmenta a través d'una combinació de divisions i reclutaments cel·lulars. És durant aquesta colonització que les cèl·lules inicien comportaments grupals coordinats mitjançant la detecció de quòrum.[5] El procés de formació de biopel·lícules es coneix com a desenvolupament i és l'escenari en el qual s'estableix de forma definitiva la biopel·lícula i només pot modificar-se en forma i mida. Aquest procés fa possible la resistència bacteriana als antibiòtics.[6]
Rol dels flagels
[modifica]Els pili, o flagels, no només tenen la funció d'adhesina en bacteris formadors de biofilms, de fet Bacillus cereus no utilitza el pili o flagel com adhesina per poder adherir-se a substrats i superfícies, sinó que també poden seguir les següents característiques:
- La motilitat (gràcies als flagels) és essencial per a que un bacteri pugui arribar a substrats o superfícies òptimes per la formació de l'estructura a les interfases aire-líquid. De fet, s'ha vist que, aquelles soques immòbils però capaces de poder formar biofilms només els podran formar submergits.
- Gràcies a la motilitat flagel·lar, aquelles cèl·lules integrants del biofilms que presentin flagels podran obrir-se camí entre la matriu i les altres cèl·lules, generant espai i, per tant, una millora en l'intercanvi de nutrients entre el biofilm i el medi exterior. Això també implica l'entrada de toxines i agents antibacterians que poden acabar perjudicant les colònies.
- Aquells bacteries que es trobin en la seva forma planctònica (lliures) i siguin mòbils podran penetrar en el biofilm i formar-ne part, augmentant així la biomassa de l'estructura (engrandint-la).
- Normalment els bacteris amb mobilitat flagel·lar es troben a la superfície dels biofilms. Aquests tenen un paper important en l'augment de la superfície del biofilm, afavorint la disseminació de les colònies i la colonització de diferents microhàbitats propers amb la possibilitat de torbar més nutrients i noves superfícies a colonitzar.[7]
Propietats
[modifica]Els biofilms es formen normalment sobre substrats sòlids submergits o que estan exposats a una mica de solució aquosa, encara que poden surar com estores flotants en superfícies líquides i també créixer a la superfície de les fulles, especialment en climes amb altes humitat relativa. Si tenen recursos suficients per a desenvolupar-se, una biopel·lícula acabarà sent observable a simple vista ràpidament. Els biofilms poden contenir molts tipus diferents de microorganismes, p. ex. bacteris, archaea, protozous, fongs i algues; cada grup realitzant funcions metabòliques especialitzades. Tanmateix, sota certes condicions, existeixen pel·lícules mono espècie.
Investigadors de la Universitat de Nova Gal·les del Sud i del Centre Helmholtz per a la Investigació de les Infeccions han trobat les estratègies utilitzades pels bacteris formadors de biopel·lícules. Descobriren que apliquen "armes químiques" per tal de defensar-se de desinfectants i antibiòtics, fagòcits i el sistema immunitari.
El coordinador del grup de recerca, Carsten Matz, inicià un estudi per trobar per què els fagòcits no poden anihilar els bacteris dels biofilms. Analitzà els bacteris marins, que es defensen de les amebes, el comportament de les quals es similar al comportament dels fagòcits. Les amebes actuen al mar just com les cèl·lules immunes en el cos humà: busquen bacteris i s'alimenten d'ells. Quan els bacteris estan sols i separats en l'aigua, es converteixen en una trampa fàcil per als atacants. Tanmateix, quan s'enganxen a una superfície i s'uneixen a altres bacteris, les amebes no els poden atacar.[8]
El treball suggereix que les biopel·lícules podrien servir com a font d'agents bioactius nous contra diversos patògens. Quan els bacteris s'organitzen en biopel·lícules, produeixen substàncies defensives eficaces, com ara el pigment violaceïna, que els bacteris individuals són incapaços de produir aïlladament.
Matriu extracel·lular
[modifica]La biopel·lícula es manté unida i és protegida per una matriu de composts polimèrics excretats anomenats EPS (extracellular polymeric substance). EPS és una abreviatura anglesa per a qualsevol substància polimèrica extracel·lular o exopolisacàrid. Aquesta matriu protegeix les cèl·lules situades al seu interior i facilita la comunicació entre elles a través de senyals bioquímics. S'ha trobat que algunes biopel·lícules contenen canals d'aigua que ajuden a distribuir els nutrients i les molècules de senyalització. Sota certes condicions, aquesta matriu forma un tapís microbià sedimentari que s'endureix molt, arribant a fossilitzar-se. Aquest és el cas d'alguns estromatòlits originats per cianobacteris.[9]
Els bacteris que viuen en una biopel·lícula acostumen a tenir propietats significativament diferents a les dels bacteris lliures flotants de la mateixa espècie, ja que l'ambient dens i protegit de la pel·lícula els permet cooperar i interaccionar de diverses maneres. Un benefici d'aquest ambient és l'augment de la seva resistència a detergents i antibiòtics. La matriu extracel·lular densa i la capa exterior de cèl·lules protegeixen l'interior de la comunitat dels efectes de dites substàncies. En alguns casos la resistència als antibiòtics pot augmentar fins a 1.000 vegades respecte a les dosis habitualment efectives.[10][11]
Exemples
[modifica]
Els biofilms són ubics. Gairebé totes les espècies de microorganismes, no només bacteris i arquees, tenen mecanismes pels quals es poden adherir a superfícies i entre les cèl·lules.
- Els biofilms es poden trobar en roques i còdols en el fons de la majoria dels cursos d'aigua o rius i sovint apareixen a la superfície d'estanys i piscines. De fet, les biopel·lícules són components importants de la cadena alimentària en rius i corrents i són ingerides pels invertebrats aquàtics dels que s'alimenten molts peixos.
- Els biofilms creixen en basses calentes, acídiques en el Parc Nacional de Yellowstone o al riu Tinto (Huelva) i en glaceres a l'Antàrtida.
- Els biofilms poden créixer en dutxes molt fàcilment, ja que proporcionen un ambient humit i càlid perquè la biopel·lícula creixi.
- Els biofilms es poden desenvolupar en els interiors de conductes on poden causar obstruccions i corrosió. Els biofilms en pisos i taulells poden fer difícil el sanejament d'àrees de preparació d'aliments. Se sap que els biofilms en sistemes d'aigües de refrigeració redueixen l'intercanvi de calor.
- L'adherència bacteriana a bucs de vaixells serveix de la fundació per bioembrutar de vaixells seagoing. Una vegada que forma una pel·lícula de bacteris, és més fàcil per a uns altres organismes marins com peus de cabra per enganxar-se. Tal embrutar pot inhibir velocitat de vaixells per fins a un 20%, fent viatja més temps i exigint combustible addicional. El temps en dic sec per reparar i repintar redueix la productivitat de béns de navili, i la vida útil de vaixells també es redueix a causa de supressió de corrosió i mecànica (raspadura) d'organismes marins des dels bucs dels vaixells.
- Els Biofilms també es poden arrear per a propòsits constructius. Per exemple, moltes depuradores inclouen un escenari de tractament en el qual les aigües residuals passen sobre biopel·lícules desenvolupades en filtres, que extreuen i digereixen composts orgànics. A tals biopel·lícules, els bacteris són principalment responsables de supressió de matèria orgànica (BOD); mentre els protozous i rotífers són principalment responsables de supressió de sòlids suspesos (SS), incloent-hi patògens i altres microorganismes. Els filtres de sorra lents depenen de desenvolupament de la biopel·lícula de la mateixa manera de filtrar aigua superficial de fonts de llac, font o riu per a propòsits que beuen. El que considerem com aigua neta és un malbaratament material a aquests organismes microcel·lulars, ja que són incapaços d'extreure altra nutrició de l'aigua purificada.
- Els biofilms poden ajudar a eliminar oli de petroli d'oceans contaminats o sistemes marins. L'oli és eliminat per les activitats que es degraden hidrocarbur de comunitats microbial, en particular per un grup últimament descobert notable d'especialistes, els anomenats bacteris hidrocarbonoclàstics (HCB).[12]
- Els biofilms són també presents a les dents de molts animals formant la placa dental, on es poden tornar responsables de càries i malaltia de geniva.
- Els biofilms es troben a la superfície de i dins de plantes. Poden contribuir els dos a malaltia de collita o, com en termes de Rizobi de fixació de nitrògens en arrels, existeixen simbiòticament amb la planta.[13] Els exemples de malalties de collita relacionades amb biopel·lícules inclouen Càncer Cítric, Pierce Disease de raïms, i Gra Bacterial de plantes com pebres i tomàquets.[14]
- L'SCOBY, una colònia simbiòtica de bacteris i llevats, utilitzat per la fermentació de la kombutxa, també forma un biofilm de cel·lulosa.
Biofilms i malalties contagioses
[modifica]Els biofilms estan implicats en una àmplia varietat d'infeccions microbianes humanes i animals. Es creu que participen un 80% de totes les infeccions.[15] Processos contagiosos en què s'han implicat biopel·lícules inclouen problemes comuns com infeccions del tracte urinari, infeccions de catèters, infeccions d'orella mitjana, formació de placa dental, gingivitis, infeccions de lents de contacte,[16] i processos menys comuns, però més letals com endocarditis, infeccions en la fibrosi quística i infeccions de sondes permanents, pròtesis articulars i vàlvules cardíaques artificials.[17][18]
S'ha mostrat últimament que les biopel·lícules són presents en el teixit tret d'un 80% de pacients que requereixen cirurgia per sinusitis crònica. Els pacients amb biopel·lícules s'ensenyaven a haver estat despullat de cilis i cèl·lules caliciformes, a diferència dels controls sense biopel·lícules que tenia cilis normals i la cèl·lula caliciforma morphology.[19] els biofilms també eren trobats en mostres des de dos de 10 controls sans esmentats. L'espècie de bacteris de cultures interoperatives no corresponia a l'espècie de bacteris a la biopel·lícula en el teixit del pacient respectiu. En altres paraules, les cultures eren negatives encara que els bacteris eren present.[20]
Les tècniques de tinció noves s'estan desenvolupant per diferenciar cèl·lules bacterial que creixen en animals de vida, p. ex. des de teixits amb inflamacions d'al·lèrgia.[14]
Biopel·lícules de Pseudomonas aeruginosa
[modifica]L'eficàcia dels tractaments mèdics en les societats industrialitzades es deteriora marcadament a causa d'infeccions oportunistes cròniques que s'han tornat cada vegada més aparents en els pacients immunocompromesos i la població d'edat avançada. Les infeccions cròniques romanen un desafiament essencial per a la professió mèdica i tenen un considerable impacte econòmic perquè la teràpia amb antibiòtics tradicionals és normalment insuficient per a erradicar aquestes infeccions. Una motiu determinant de tot això sembla la capacitat dels bacteris per créixer dins de biopel·lícules que els protegeixen de factors ambientals adversos. Pseudomonas aeruginosa no és només un patogen oportunista important i un agent causal d'infeccions nosocomials sinó que també es considera un organisme modèl per a l'estudi de diversos mecanismes que contribueixen a la supervivència bacteriana. En aquest context, l'elucidació dels mecanismes moleculars responsables dels canvis ocorreguts en aquest germen des del creixement com a cèl·lula lliure planctònica fins a desenvolupar un fenotip formador de biopel·lícula i el paper de la comunicació cel·lular bacteriana en la cronificació de les infeccions que provoca, hauria de proporcionar idees noves sobre la patogenicitat de P. aeruginosa que contribueixin al desenvolupament de nous fàrmacs antibacterians i d'estratègies terapèutiques alternatives per tal de millorar l'evolució clínica dels pacients crònicament infectats.[21]
Placa dental
[modifica]La placa dental és el material compacte adherit a la superfície de dents, genives i implants odontològics que s'origina a partir d'una biopel·lícula constituïda per bacteris aerobis i anaerobis (entre ells Streptococcus mutans i Streptococcus sanguinis), els seus subproductes i polímers salivals.[22] Aquesta acumulació de microorganismes sotmet les dents i els teixits gingivals a concentracions altes de metabòlits bacterians que ocasionen malaltia periodontal.[23] En la formació d'aquests biofilms causants de peridionitis, poden haver colonitzadors secundaris, com ara Bacillus cereus, els quals s'aprofitin del biofilm ja preformat per tal de colonitzar la placa dental.
Legionel·losi
[modifica]Se sap que els bacteris del gènere Legionella creixen sota certes condicions formant biopel·lícules, les quals es protegeixen contra molts desinfectants. Els treballadors de torres de refrigeració, les persones que treballen en espais amb aire condicionat i la gent que pren una dutxa està exposada a l'aspiració d'aerosols que contenen legionel·les en cas que els sistemes no es construeixin bé, el seu disseny sigui defectuós o no tinguin un manteniment adequat.[24][25]
Referències
[modifica]- ↑ López D, Vlamakis H, Kolter R «Biofilms» (en anglès). Cold Spring Harb Perspect Biol, 2010 Jul; 2 (7), pp: a000398. DOI: 10.1101/cshperspect.a000398. PMC: 2890205. PMID: 20519345 [Consulta: 26 març 2019].
- ↑ Nagar E, Schwarz R «To be or not to be planktonic? Self-inhibition of biofilm development» (en anglès). Environ Microbiol, 2015 Maig; 17 (5), pp: 1477-1486. DOI: 10.1111/1462-2920.12583. ISSN: 1462-2920. PMID: 25088599 [Consulta: 23 març 2019].
- ↑ Martínez LC, Vadyvaloo V «Mechanisms of post-transcriptional gene regulation in bacterial biofilms» (en anglès). Front Cell Infect Microbiol, 2014 Mar 25; 4, pp: 38. DOI: 10.3389/fcimb.2014.00038. PMC: 3971182. PMID: 24724055 [Consulta: 23 març 2019].
- ↑ JPG Images: niaid.nih.gov erc.montana.edu Arxivat 2009-09-27 a Wayback Machine.
- ↑ Díaz Caballero, AJ; Vivas Reyes, R; Puerta, L; Ahumedo Monterrosa, M; et al «Biopelículas como expresión del mecanismo de quorum sensing: Una revisión» (en castellà). Avances en Periodoncia e Implantologìa, 2011 Des; 23 (3), pp: 195-201. ISSN: 2340-3209 [Consulta: 2 abril 2019].
- ↑ Singh S, Singh SK, Chowdhury I, Singh R «Understanding the Mechanism of Bacterial Biofilms Resistance to Antimicrobial Agents» (en anglès). Open Microbiol J, 2017 Abr 28; 11, pp: 53-62. DOI: 10.2174/1874285801711010053. PMC: 5427689. PMID: 28553416 [Consulta: 2 abril 2019].
- ↑ Majed, Racha; Faille, Christine; Kallassy, Mireille; Gohar, Michel «Bacillus cereus Biofilms—Same, Only Different». Frontiers in Microbiology, 7, 2016, pàg. 1054. DOI: 10.3389/fmicb.2016.01054. ISSN: 1664-302X.
- ↑ Matz C, Webb JS, Schupp PJ, Phang SY, et al «Marine biofilm bacteria evade eukaryotic predation by targeted chemical defense» (en anglès). PLoS One, 2008 Jul 23; 3 (7), pp: e2744. DOI: 10.1371/journal.pone.0002744. PMC: 2444038. PMID: 18648491 [Consulta: 18 març 2019].
- ↑ König, C «Les stromatolites, formation sédimentaire des cyanobactéries» (en francès). Dossiers Futura-Sciences, 2018: Jul 19, pàgs: 4 [Consulta: 26 març 2019].
- ↑ Stewart P, Costerton J «Antibiotic resistance of bacteria in biofilms». Lancet, 358, 9276, 2001, pàg. 135–8. DOI: 10.1016/S0140-6736(01)05321-1. ISSN: 0140-6736. PMID: 11463434.
- ↑ Butt, A; Khan, A «Antibiotics Resistance of Bacterial Biofilms» (en anglès). MEJB, 2015 Oct; 10 (4), pp: 38-45. DOI: 10.5742/MEJB.2015.92718. ISSN: 8777 1834 8777 [Consulta: 23 març 2019].
- ↑ Martins VAP, et al. «Genomic Insights into Oil Biodegradation in Marine Systems». A: Microbial Biodegradation: Genomics and Molecular Biology. Caister Academic Press, 2008. http://www.horizonpress.com/biod ISBN 978-1-904455-17-2.
- ↑ «Introduction to Biofilms: Negative and positive impacts of biofilm». Arxivat de l'original el 2008-06-22. [Consulta: 23 desembre 2008].
- ↑ 14,0 14,1 Peter C. Andersen, Brent V. Brodbeck, Steve Oden, Anthony Shriner & Breno Leite Influence of xylem fuid chemistry on planktonic growth, biofilm formation and aggregation of Xylella fastidiosa, North Florida Research and Education Center, Institute of Food and Agricultural Sciences, University of Florida, Quincy, FL, USA
- ↑ «Research on microbial biofilms (PA-03-047)». NIH, National Heart, Lung, and Blood Institute, 20-12-2002.
- ↑ Imamura Y, Chandra J, Mukherjee PK, Lattif AA, Szczotka-Flynn LB, Pearlman E, Lass JH, O'Donnell K, Ghannoum MA «Fusarium and Candida albicans Biofilms on Soft Contact Lenses: Model Development, Influence of Lens Type, and Susceptibility to Lens Care Solutions». Antimicrob. Agents Chemother., 52, 1, 2008, pàg. 171–182. DOI: 10.1128/AAC.00387-07. PMID: 17999966.
- ↑ Lewis K «Riddle of biofilm resistance». Antimicrob. Agents Chemother., 45, 4, 2001, pàg. 999–1007. Arxivat de l'original el 2020-05-31. DOI: 10.1128/AAC.45.4.999-1007.2001. PMID: 11257008 [Consulta: 23 desembre 2008].
- ↑ Parsek M, Singh P «Bacterial biofilms: an emerging link to disease pathogenesis». Annu. Rev. Microbiol., 57, 2003, pàg. 677–701. DOI: 10.1146/annurev.micro.57.030502.090720. PMID: 14527295.
- ↑ Sanclement J, Webster P, Thomas J, Ramadan H «Bacterial biofilms in surgical specimens of patients with chronic rhinosinusitis». Laryngoscope, 115, 4, 2005, pàg. 578–82. PMID: 15805862.
- ↑ Sanderson A, Leid J, Hunsaker D «Bacterial biofilms on the sinus mucosa of human subjects with chronic rhinosinusitis». Laryngoscope, 116, 7, 2006, pàg. 1121–6. DOI: 10.1097/01.mlg.0000221954.05467.54. PMID: 16826045.
- ↑ Leevy WM, Gammon ST, Jiang H, Johnson JR, Maxwell DJ, Jackson EN, Marquez M, Piwnica-Worms D, Smith BD «Optical imaging of bacterial infection in living mice using a fluorescent near-infrared molecular probe». J. Am. Chem. Soc., 128, 51, 2006, pàg. 16476–7. DOI: 10.1021/ja0665592. PMID: 17177377.
- ↑ Marsh, PD «Dental plaque as a biofilm and a microbial community – implications for health and disease» (en anglès). BMC Oral Health, 2006 Jun 15; 6 (Supl 1), pp: S14. DOI: 10.1186/1472-6831-6-S1-S14. PMC: 2147593. PMID: 16934115 [Consulta: 17 març 2019].
- ↑ Rickard, AH; Bachrach, G; Davies, DG «Dental plaque biofilm formation» (en anglès). A: Cell-cell Communication in Oral Microbial Communities, Molecular Oral Microbiology (Rogers AH; Ed.) Caister Academic Press, 2008; Feb, pàg. Chap. 4, pp: 88-91. ISBN 978-1-904455-24-0 [Consulta: 17 març 2019].
- ↑ Murga R, Forster TS, Brown E, Pruckler JM, et al «Role of biofilms in the survival of Legionella pneumophila in a model potable-water system» (en anglès). Microbiology, 2001 Nov; 147 (Pt 11), pp: 3121-3126. DOI: 10.1099/00221287-147-11-3121. ISSN: 0026-2617. PMID: 11700362 [Consulta: 17 març 2019].
- ↑ Abu Khweek A, Amer AO «Factors Mediating Environmental Biofilm Formation by Legionella pneumophila» (en anglès). Front Cell Infect Microbiol, 2018 Feb 27; 8, pp: 38. DOI: 10.3389/fcimb.2018.00038. PMC: 5835138. PMID: 29535972 [Consulta: 17 març 2019].
Bibliografia
[modifica]- Ramadan H, Sanclement J, Thomas J «Chronic rhinosinusitis and biofilms». Otolaryngology--head and neck surgery, 132, 3, 2005, pàg. 414–7. DOI: 10.1016/j.otohns.2004.11.011. PMID: 15746854.
- Bendouah Z, Barbeau J, Hamad W, Desrosiers M «Biofilm formation by Staphylococcus aureus and Pseudomonas aeruginosa is associated with an unfavorable evolution after surgery for chronic sinusitis and nasal polyposis». Otolaryngology--head and neck surgery, 134, 6, 2006, pàg. 991–6. DOI: 10.1016/j.otohns.2006.03.001. PMID: 16730544.
- Lynch AS; Robertson GT «Biofilm and Fungal Infections». Annu. Rev. Med., 59, 2008, pàg. 415–428. DOI: 10.1146/annurev.med.59.110106.132000. ISSN: 0066-4219. PMID: 17937586.
Enllaços externs
[modifica]- Què és el biofilm al Quèquicom
- Biofilm Basics Center for Biofilm Engineering. Montana State University, 2010. (anglès)
