Borà (grup)
| Substància química | classe estructural d'entitats químiques |
|---|

Un borà és un hidrur de bor, un compost químic inorgànic de fórmula molecular general amb , o els seus derivats. Es caracteritzen per tenir estructura molecular polièdrica, situant-se els àtoms de bor en els vèrtexs de deltaedres, podent o no completar-lo, tots ells són deficients d’electrons, presenten alguns enllaços per ponts d'hidrogen entre àtoms de bor amb només dos electrons.
Història
[modifica]
Els hidrurs de bor se sintetitzaren i caracteritzar per primera vegada de forma sistemàtica el període del 1912 al 1937 pel químic alemany Alfred Stock (1876–1846). Els anomenà «borans» per analogia amb els alcans o hidrocarburs saturats, els hidrurs de carboni, que és el veí del bor a la taula periòdica. Com que els borans més lleugers eren volàtils, sensibles a l'aire i la humitat i tòxics, Stock desenvolupà mètodes i aparells d'alt buit per estudiar-los. El treball nord-americà sobre els borans començà l'any 1931, realitzat per Hermann I. Schlesinger (1882–1960) i Anton B. Burg (1904–2003). Els borans no tingueren aplicacions pràctiques fins a la Segona Guerra Mundial, quan el govern dels Estats Units donà suport a la investigació per trobar compostos volàtils d'urani (borohidrurs) per a la separació d'isòtops, i la dècada de 1950, quan subvencionà programes per desenvolupar combustibles d'alta energia per a coets i avions de reacció. Els borans i els seus derivats tenen calors de combustió molt més alts que els d'hidrocarburs.[1]
El 1943, Hugh Christopher Longuet-Higgins (1923–2004), quan encara era estudiant a la Universitat d'Oxford, fou el primer a explicar l'estructura i l'enllaç dels borans conjuntament amb el seu tutor Ronald Percy Bell (1907-1996).[2] Poc després, el 1948, la teoria de Longuet-Higgins fou confirmada en un estudi del diborà(6) d'espectroscòpia infraroja per W.C. Price de la Universitat de Chicago.[3] L'estructura del diborà(6) fou confirmada de nou per mesura de difracció d'electrons el 1951 per Kenneth Hedberg i Verner Schomaker.[4] William Nunn Lipscomb Jr. (1919–2011) confirmà l'estructura molecular dels borans mitjançant cristal·lografia de raigs X a la dècada de 1950 i desenvolupà teories per explicar la seva unió. Lipscomb rebé el Premi Nobel de Química l'any 1976 "pels seus estudis sobre l'estructura dels borans que donen llum als problemes d'enllaç químic", mentre que un dels deixebles de Schlesinger, Herbert Charles Brown (1912–2004), compartí el premi de 1979 per la seva reacció d'hidroboració (1956), l'addició extraordinàriament fàcil de a compostos orgànics insaturats (és a dir, alquens i alquins) dissolts en èter etílic a temperatura ambient per produir organoborans quantitativament (és a dir, en una reacció que s'acaba completament, o gairebé totalment). La reacció d'hidroboració, al seu torn, obrí noves vies d'investigació en l'àrea de la síntesi orgànica estereoespecífica.[1]

Estructura
[modifica]En lloc de mostrar les configuracions simples de cadenes i anells dels compostos de carboni, els àtoms de bor dels borans més complexos es troben a les cantonades de deltaedres (poliedres amb cares que són triangles equilàters: tetraedre, octaedre, icosaedre, etc.) o fragments deltaèdrics. El desenvolupament d'una comprensió d'aquests cúmuls de bor ha fet molt per ajudar els químics a racionalitzar la química d'altres compostos de clúster inorgànics, organometàl·lics i de metalls de transició.[5]
Una de les raons del gran interès pels borans és el fet que posseeixen estructures diferents de qualsevol altra classe de compostos. Com que l'enllaç dels borans implica un enllaç multicèntric, en què tres o més àtoms comparteixen un parell d'electrons d'enllaç, els borans s'anomenen substàncies amb deficiència d'electrons.[5]
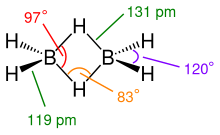
El diborà(6) té l'estructura de la figura del costat. Aquesta estructura implica un enllaç de pont de tres centres, en què un parell d'electrons es comparteix entre tres (en lloc de dos) àtoms: dos àtoms de bor i un àtom d'hidrogen. La longitud d'aquests enllaços és superior a la dels enllaços , 131 pm enfront de 119 pm, i també l'angle d'aquests enllaços és inferior (97°) al dels enllaços terminals (120°). La capacitat del bor per formar aquests enllaços a més dels enllaços covalents normals condueix a la formació de borans polièdrics complexos.[5]
Al diborà hi ha 12 electrons de valència per formar enllaços químics (B en té 3 i H en té 1, per tant, 2xB + 6xH =12). Cada enllaç terminal és un enllaç σ estàndard amb dos electrons cadascun, i n'hi ha quatre, la qual cosa suposa un total de vuit electrons. Això deixa un total de quatre electrons per compartir entre els dos ponts d'hidrogen. En conseqüència, es formen dos enllaços pont [6]
, cadascun dels quals consta de només dos electrons, formant el que s'anomenen enllaços de tres centres de dos electrons (és a dir, 3 àtoms comparteixen 2 electrons), de vegades anomenats «enllaços banana», ja que no són lineals sinó corbats.[7] Cada àtom B empra orbitals híbrids sp², disposats en un pla i separats 120°. Dos d'aquests orbitals s'usen en la formació d'enllaços σ amb els àtoms d'hidrogen terminals, explicant-se l'angle observat. La combinació lineal del tercer orbital híbrid sp² i l'orbital pz no utilitzat permet obtenir dos orbitals híbrids semblants als orbitals híbrids sp3, però amb major contribució de l'orbital pz. Són aquests orbitals híbrids els que es fan servir en la formació de l'enllaç de tres centres. Un d'aquests orbitals híbrids conté un electró i l'altre és buit. Un àtom de B dona el seu electró de valència que li queda a un pont, i l'altre àtom B dona a l'altre. Cada pont, per tant, té dos electrons.[7]
Nomenclatura
[modifica]
La nomenclatura de la Unió Internacional de Química Pura i Aplicada (IUPAC) pels borans es basa en tres regles:
- El nombre d'àtoms de bor s'indica amb un prefix (di-, tri-, tetra-, penta-...) seguit de la paraula «borà» i acabat amb el nombre d'hidrògens amb nombres aràbics entre parèntesis. Per exemple: diborà(6) , pentaborà(9) o pentaborà(11) .[8][9]
- Pels anions se substitueix la terminació «-à» per «-at» i el nombre d'hidrògens s'indica al principi amb els prefixos numerals i la paraula «hidrido». Es completa el nom afegint la càrrega entre parèntesis al final en números aràbics. Exemple: hexahidridohexaborat(2–) .[9]
- Opcionalment també es pot incloure informació estructural amb els prefixos que s'indiquen a continuació:
- Closo– (una corrupció de "clovo", del llatí clovis, que significa "gàbia"), poliedres amb només cares triangulars d'n àtoms de bor. La seva fórmula general és , però no se n'han aïllat. Sí que s'han caracteritzat anions, amb la fórmula general , com ara l'anió hexahidrido-closo-hexaborat(2–) .[8][9]
- Nido– (del llatí nidus, que significa "niu"), estructures no tancades en les quals el cúmul Bn ocupa n vèrtexs d'un poliedre de (n + 1) vèrtexs, és a dir, un deltaedre amb un vèrtex que falta. Els neutres tenen fórmula general , per exemple , , i , de noms nido-diborà(6), nido-pentaborà(9), nido-hexaborà(10) i nido-decaborà(14), respectivament. També s'han caracteritzat monoanions de fórmula , com o de noms octahidrido-nido-pentaborà(1–) i tridecahidrido-nido-decaborà(1–), respectivament; i dianions de fórmula , com o .[8][9]
- Aracno– (grec, que significa "tela d'aranya"), cúmuls encara més oberts, amb àtoms de bor que ocupen n vèrtexs contigus d'un poliedre de (n + 2) vèrtexs, és a dir, un deltaedre amb dos vèrtexs que falten. Els borans neutres d'aquest tipus tenen fórmula general , com el , i (aracno-tetraborà(10), aracno-pentaborà(11) i aracno-hexaborà(12), respectivament). Els anions tenen fórmules i , essent exemples , , i .[8][9]
- Hypho– (grec, que significa "teixir" o "una xarxa"), els cúmuls més oberts, amb àtoms de bor que ocupen n vèrtexs d'un deltaedre de (n + 3) vèrtexs. La seva fórmula general és , però no se n'han caracteritzat.[8][9]
- Klado– (grec, que significa "branca"), n vèrtexs d'un deltaedre de n + 4 vèrtexs ocupats per n àtoms de bor. La fórmula general és i no se'n coneixen.[1][9]
-
hexahidrido-closo-hexaborat(2-)
-
nido-pentaborà(9)
-
nido-hexaborà(10)
-
aracno-tetraborà(10)
-
aracno-hexaborà(12)
Els membres de les sèries hypho- i klado- es coneixen actualment només com a derivats del borà. L'enllaç entre dos o més d'aquests cúmuls de borans polièdrics s'indica amb el prefix conjuncto- (llatí, que significa "unir-se"). Per exemple, conjuncto- es produeix unint les unitats de dues molècules mitjançant un enllaç .[1]
Propietats
[modifica]Propietats físiques
[modifica]Els borans són els hidrurs més nombrosos que els de qualsevol altre element, excepte el carboni. Els borans poden ser sòlids, líquids o gasosos. Les forces entre molècules són les forces de dispersió de London, el tipus més feble de forces intermoleculars. Per aquesta raó, en general, els punts de fusió i ebullició dels borans augmenten amb l'augment de la complexitat i la massa molecular.[1]
| Borà | Punt de fusió (°C)[10][11] | Punt d'ebullició (°C)[10][11] | ΔfH0 gas (kJ/mol)[12] | ΔfG0 gas (kJ/mol)[12] |
|---|---|---|---|---|
| Diborà(6) | –165 | –92,5 | 36,4 | 87,6 |
| Tetraborà(10) | –120 | 18 | 66,1 | 184,3 |
| Pentaborà(9) | –46,6 | 60 | 73,2 | 173,6 |
| Decaborà(14) | 99,5 | 213 | 47,3 | 232,8 |
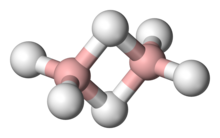
El borà aïllable més senzill és , diborà(6). És un dels intermedis químics més estudiats i més útils sintèticament. Està disponible comercialment, i durant anys es van preparar molts borans i els seus derivats, directament o indirectament. El borà(3) i el triborà(7) són molt inestables, però es poden aïllar com a adductes estables (productes d'addició) amb bases de Lewis (molècules donants d'electrons), per exemple, .[1]
Propietats químiques
[modifica]Tots els borans són composts endotèrmics, això és, la seva entalpia de formació és positiva, i també la seva energia lliure de formació . Les energies dels enllaços mitjanes són (bor-hidrogen terminal) 380 kJ/mol, 440 kJ/mol, 330 kJ/mol i 380 kJ/mol, inferiors en tots els casos a l'energia de l'enllaç , que és de 436 kJ/mol. Aquestes baixes energies expliquen la inestabilitat dels borans.[8] Si se'ls escalfa, es descomponen en bor i hidrogen:
Tot i que els borans més simples, per exemple el diborà(6) , són inflamables espontàniament a l'aire (cremen amb una flama verda característica) i molt reactius cap als dissolvents que contenen protons reemplaçables, la reactivitat generalment disminueix amb l'augment de la massa molecular. Alguns dels anions polièdrics de pes molecular més alt, com ara i , són notablement estables a l'aire, l'aigua i la calor i per a ells s'ha suggerit el terme «aromaticitat tridimensional».[8] Els aracno-borans són generalment més reactius i menys estables tèrmicament que els nido-borans, que al seu torn són més reactius i menys estables tèrmicament que els closo-borans. La reacció del diborà(6) amb l'oxigen desprèn 2 008 kJ/mol i dona òxid de bor i aigua:
Els borans de menor massa molecular s'hidrolitzen fàcilment i els de major massa molecular ho fan en dificultat. Desprenen hidrogen i produeixen àcid bòric :
Tots els borans reaccionen amb àlcalis actuant com a àcids monopròtics, excepte del diborà(6) que es descompon en borat de sodi i hidrogen. L'hidrogen que es transfereix prové del pont i es forma un nou enllaç covalent . En la sèrie del nido-borans el caràcter àcid augmenta amb la massa molar i en la sèrie dels aracno-borans és . Algunes reaccions són:
Síntesi
[modifica]Diborà(6)
[modifica]Alfred Stock obtingué per primera vegada mescles de borans de baix rendiment tractant borur de magnesi amb àcid clorhídric . El diborà es prepara més fàcilment amb un alt rendiment mitjançant la reacció de iode amb tetrahidridoborat de sodi (comunament anomenat borohidrur de sodi) en diglima com a dissolvent:[1]
o per reacció d'un borohidrur sòlid, és a dir, una sal que conté l'anió , amb un àcid anhidre,
Piròlisis del diborà(6)
[modifica]La resta de borans s'obtenen escalfant el diborà(6) entre 373 K i 523 K. Controlant la temperatura i la concentració del reactiu es poden obtenir els diferents borans.[13] Així, per exemple el decaborà(14) s'obté escalfant diborà(6) entre 453 K i 490 K. Les reaccions passen per la dissociació del diborà(6) en borà :[14]
Reacció amb tetrahidridoborat de sodi
[modifica]
Les reaccions del diborà(6) amb tetrahidridoborat de sodi s'empra per preparar borans d'alta massa molecular. Cada borà es pot sintetitzar canviant les condicions de temperatura i dissolvent. En primer lloc s'obtenen els borats de sodi, per tant aquesta primera etapa es pot emprar si es volen sintetitzar els anions borat. Una segona etapa permet obtenir els borats fent reaccionar els borats de sodi amb àcid clorhídric.[15]
Aplicacions
[modifica]Els borohidrurs disponibles comercialment, que també són importants pel seu ampli ús com a agents reductors inorgànics, són la sèrie més significativa comercialment de derivats de borans i les matèries primeres de partida per preparar borans tant a escala de laboratori com a escala industrial. La reacció d'hidroboració estereoespecífica esmentada anteriorment,
(on R és un grup alquil), gairebé quantitativament produeix organoborans, que al seu torn poden produir diversos compostos orgànics com l'alcà corresponent a l'alquè inicial o l'alcohol primari.[1]
Referències
[modifica]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Kauffman, George B. «borane» (en anglès). Encyclopedia Britannica, 15-08-2018. [Consulta: 17 febrer 2022].
- ↑ Longuet-Higgins, H. C.; Bell, R. P. «64. The structure of the boron hydrides» (en anglès). Journal of the Chemical Society (Resumed), 0, 01-01-1943, pàg. 250–255. DOI: 10.1039/JR9430000250. ISSN: 0368-1769.
- ↑ Price, W. C. «The Absorption Spectrum of Diborane». The Journal of Chemical Physics, 16, 9, 01-09-1948, pàg. 894–902. DOI: 10.1063/1.1747028. ISSN: 0021-9606.
- ↑ Hedberg, Kenneth; Schomaker, Verner «A Reinvestigation of the Structures of Diborane and Ethane by Electron Diffraction 1,2» (en anglès). Journal of the American Chemical Society, 73, 4, 4-1951, pàg. 1482–1487. DOI: 10.1021/ja01148a022. ISSN: 0002-7863.
- ↑ 5,0 5,1 5,2 Huheey, James E. Química inorgánica : principios de estructura y reactividad. 2d ed. Mexico [D.F.]: HARLA, 1981. ISBN 968-6034-13-7.
- ↑ Gutiérrez Ríos, Enrique. Química inorgánica. 2. ed., revisada. Barcelona: Reverté, 1994. ISBN 84-291-7215-7.
- ↑ 7,0 7,1 Burrows, Andrew. Chemistry³ : introducing inorganic, organic and physical chemistry. Second edition, 2013. ISBN 978-0-19-969185-2.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 Maurya, Ram Charitra. Inorganic Chemistry Some New Facets.. Berlin/Boston: Walter de Gruyter GmbH, 2021. ISBN 978-3-11-072728-9.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 Beckett, Michael A.; Brellochs, Bernd; Chizhevsky, Igor T.; Damhus, Ture; Hellwich, Karl-Heinz «Nomenclature for boranes and related species (IUPAC Recommendations 2019)» (en anglès). Pure and Applied Chemistry, 92, 2, 01-02-2020, pàg. 355–381. DOI: 10.1515/pac-2018-0205. ISSN: 1365-3075.
- ↑ 10,0 10,1 Manager, ILO Content. «Boranes: Physical & Chemical Properties» (en anglès britànic). [Consulta: 18 febrer 2022].
- ↑ 11,0 11,1 Ullmann's fine chemicals, 2014. ISBN 978-3-527-68357-4.
- ↑ 12,0 12,1 CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data.. 93rd ed., 2012-2013. Boca Raton, Fla.: CRC, 2012. ISBN 978-1-4398-8049-4.
- ↑ Inorganic and bio-inorganic chemistry. Oxford: Eolss Publishers, 2009. ISBN 978-1-84826-664-3.
- ↑ Baylis, Anthony B.; Pressley, George A.; Stafford, Fred E. «Mass Spectrometric Investigation of the Pyrolysis of Boranes. IV. Diborane1». Journal of the American Chemical Society, 88, 11, 01-06-1966, pàg. 2428–2433. DOI: 10.1021/ja00963a013. ISSN: 0002-7863.
- ↑ Wiberg, Egon. Inorganic chemistry. 1st English ed.. San Diego: Academic Press, 2001. ISBN 0-12-352651-5.















![{\displaystyle {\ce {[B6H6]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1a9007550b86a0319f8748bee588495035bd41a3)

![{\displaystyle {\ce {[B_{n}H_{n}]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/510317378a9e19b8c6c7b434937500a40322f763)



![{\displaystyle {\ce {[B_{n}H_{n + 3}]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9768efba0d80c5501f1e746d1cd0d8bdd131570)
![{\displaystyle {\ce {[B_{5}H_{8}]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a57703876c16da4f4818ac111858e30802054f30)
![{\displaystyle {\ce {[B_{10}H_{13}]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9809a75c539940d2d1d31a5333808547d98d832)
![{\displaystyle {\ce {[B_{n}H_{n + 2}]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dc356e1974871d198ce316dbcba958a97452d02e)
![{\displaystyle {\ce {[B_{10}H_{12}]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b949ab36a28a74407d88ae549cd4bc7941a97d1)
![{\displaystyle {\ce {[B_{11}H_{13}]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a13d390e7dff9d7a06ed5e2ef658c3c9d2990eba)



![{\displaystyle {\ce {[B_{n}H_{n + 5}]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23d9c59d9adb78c1042f56d9a6f6ad05363291a7)
![{\displaystyle {\ce {[B_{n}H_{n + 4}]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c802fa8f047eff224b62455f04ca7aeab399f83)
![{\displaystyle {\ce {[B_{2}H_{7}]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e25bb7b0d75aca717d41b201e5217cce81fb49fb)
![{\displaystyle {\ce {[B_{3}H_{8}]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e12adf0c788e785a396eccc9ab51a40c7df89c7d)
![{\displaystyle {\ce {[B_{5}H_{10}]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d3ad4d3547e5c9b914fabc67e632987c93c4698)
![{\displaystyle {\ce {[B_{10}H_{14}]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/03020ce389998392f988cb157e032735ace99add)






















![{\displaystyle {\ce {[B10H10]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85e85cbe964156a3d76697e9481505889cb39b34)
![{\displaystyle {\ce {[B12H12]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afcb6dabd83cc0156f7de767a0f8b52af0836355)





![{\displaystyle {\ce {B10H14 + OH- <=> [B10H13]- + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ef4579f50672ca6d4e19fbdc87e37e734918508)
![{\displaystyle {\ce {B4H10 + NH3 <=> [B4H10]- + NH4+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fac504dfe4a0d9ee41dd28c2f448e1a61b85622d)






![{\displaystyle {\ce {[BH4]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/869b819686a0036078cf1c62426a9588305e026e)






![{\displaystyle {\ce {1/2 B2H6 + NaBH4 ->[273 K][polieter] NaB2H7}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e5a8154cdf77ccd204f897beaa602f5fbaa52c9e)
![{\displaystyle {\ce {B2H6 + NaBH4 ->[373 K][diglima] NaB3H8 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8dffd18e14782d101d995ee38189f7972315369)
![{\displaystyle {\ce {5 B2H6 + 2 NaBH4 ->[373-453 K][NEt_3] Na2B12H12 + 13 H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f83693ca8467a52950e2780718db59727305f2a)
