Bor
| Per a altres significats, vegeu «Bor (desambiguació)». |
| Bor | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
5B
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||
Negre-marró  Línies espectrals del bor | |||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||
| Nom, símbol, nombre | Bor, B, 5 | ||||||||||||||||||||||||
| Categoria d'elements | Metal·loides | ||||||||||||||||||||||||
| Grup, període, bloc | 13, 2, p | ||||||||||||||||||||||||
| Pes atòmic estàndard | 10,811(7) | ||||||||||||||||||||||||
| Configuració electrònica | [He] 2s² 2p¹ 2, 3 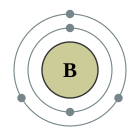
| ||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
2,08 g·cm−3 | ||||||||||||||||||||||||
| Punt de fusió | 2.349 K, 2.076 °C | ||||||||||||||||||||||||
| Punt d'ebullició | 4.200 K, 3.927 °C | ||||||||||||||||||||||||
| Entalpia de fusió | 50,2 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpia de vaporització | 480 kJ·mol−1 | ||||||||||||||||||||||||
| Capacitat calorífica molar | 11,087 J·mol−1·K−1 | ||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||
| Estats d'oxidació | 3, 2, 1[1] (òxid àcid suau) | ||||||||||||||||||||||||
| Electronegativitat | 2,04 (escala de Pauling) | ||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 800,6 kJ·mol−1 | ||||||||||||||||||||||||
| 2a: 2.427,1 kJ·mol−1 | |||||||||||||||||||||||||
| 3a: 3.659,7 kJ·mol−1 | |||||||||||||||||||||||||
| Radi atòmic | 90 pm | ||||||||||||||||||||||||
| Radi covalent | 84±3 pm | ||||||||||||||||||||||||
| Radi de Van der Waals | 192 pm | ||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[2] | ||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) ~10⁶ Ω·m | ||||||||||||||||||||||||
| Conductivitat tèrmica | 27,4 W·m−1·K−1 | ||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) (forma ß) 5–7[3] µm·m−1·K−1 | ||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 16,200 m·s−1 | ||||||||||||||||||||||||
| Duresa de Mohs | ~9,5 | ||||||||||||||||||||||||
| Nombre CAS | 7440-42-8 | ||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||
| Article principal: Isòtops del bor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El bor és l'element químic de símbol B i nombre atòmic 5. És un element metal·loide, semiconductor, trivalent que existeix abundantment en el mineral bòrax. Hi ha dos al·lòtrops del bor; el bor amorf és una pols marró, però el bor metàl·lic és negre. La forma metàl·lica és dura (9,3 en l'escala de Mohs) i és un mal conductor a temperatura ambient. No s'ha trobat lliure en la natura.
Història
[modifica]Els compostos de bor (de l'àrab buraq i aquest del persa burah) es coneixen des de fa milers d'anys.[6] A l'antic Egipte la momificació depenia del natró, un mineral que contenia borats i altres sals comuns. A la Xina s'usaven ja cristalls de borax cap al 300 aC i a l'antiga Roma, compostos de bor en la fabricació de vidre. A partir del segle viii els borats van ser usats en processos de refineria d'or i plata.[7]
El 1808, Humphry Davy, Gay-Lussac i Louis J. Thénard van obtenir bor amb una puresa del 50% aproximadament, encara que cap d'ells va reconèixer la substància com un nou element, cosa que faria Jöns Jacob Berzelius en 1824.[8] El bor pur va ser produït per primera vegada pel químic nord-americà Ezekiel Weintraub, el 1909.[9]
Abundància i obtenció
[modifica]Els Estats Units d'Amèrica (desert de Mojave, a Califòrnia) i Turquia són els majors productors de bor. L'element es troba combinat amb bòrax, àcid bòric, colemanita, kernita, ulexita i borats. L'àcid bòric es troba a vegades en les aigües volcàniques. La ulexita és un mineral que de manera natural presenta les propietats de la fibra òptica.
El bor pur és difícil de preparar; els primers mètodes usats requerien la reducció de l'òxid amb metalls com el magnesi o alumini, però el producte resultant gairebé sempre es contaminava. Pot obtenir-se per reducció d'halogenurs de bor volàtils amb hidrogen a alta temperatura.
Característiques
[modifica]El bor és un element amb vacants electròniques en l'orbital p; per això presenta una acusada apetència d'electrons, de manera que els seus compostos es comporten sovint com a àcids de Lewis, reaccionant amb rapidesa amb substàncies riques en electrons.
Entre les característiques òptiques d'aquest element, s'inclou la transmissió de radiació infraroja. A temperatura ambient, la seva conductivitat elèctrica és xicoteta, però és bon conductor de l'electricitat a alta temperatura.
Aquest metal·loide té la més alta resistència a la tracció entre els elements químics coneguts; el material fos amb arc té una resistència mecànica entre 1600 i 2400 MPa.

El nitrur de bor, un aïllant elèctric que condueix la calor tan bé com els metalls, s'empra en l'obtenció de materials tan durs com el diamant. El bor té a més qualitats lubricants semblants a les del grafit, i comparteix amb el carboni la capacitat de formar xarxes moleculars mitjançant enllaços covalents estables.
Isòtops
[modifica]En la naturalesa es troben dos isòtops de bor: B-11 (80,1%) i B-10 (19,9%). Els resultats de les masses es diferencien en una àmplia gamma de valors que es defineixen com la diferència entre les fraccions 11B i 10B i tradicionalment expressada en parts per mil, en aigües naturals que van des de -16 fins a 59. Hi ha 13 isòtops coneguts de bor, l'isòtop de més curta durada és 7B que es descompon a través d'emissió de protons i la desintegració alfa. Té una vida mitjana de 3.5×10−22s. El fraccionament isotòpic del bor és controlat per les reaccions de canvi dels compostos especials B(OH)3 i B(OH)4. Els isòtops de bor també es fraccionen durant la cristal·lització de minerals, durant els canvis de fase d'H2O en sistemes hidrotermals, i durant l'alteració hidrotermal de roques.[10][11]
Aplicacions
[modifica]El compost de bor de major importància econòmica és el bòrax, que s'empra en grans quantitats en la fabricació de fibra de vidre aïllant i perborat de sodi. Altres usos inclouen:
- Les fibres de bor usades en aplicacions mecàniques especials, en l'àmbit aeroespacial, aconsegueixen resistències mecàniques de fins a 3.600 MPa.[12]
- El bor amorf s'usa en focs artificials pel seu color verd.
- L'àcid bòric s'empra en productes tèxtils.[13]
- El bor és usat com a semiconductor.[14][15][16][17]
- Els compostos de bor tenen moltes aplicacions en la síntesi orgànica i en la fabricació de vidres de borosilicat.
- Alguns compostos s'empren com a conservants de la fusta, sent de gran interès el seu ús per la seva baixa toxicitat.[18]
- El B-10 s'usa en el control dels reactors nuclears, com a escut enfront de les radiacions i en la detecció de neutrons.
Segons l'estudi del seu ús com a combustible de coets, els hidrurs de bor s'oxiden amb facilitat, alliberant gran quantitat d'energia.[13][19]
- En l'actualitat, la investigació s'està conduint en la producció de combustible en forma d'hidrogen amb la interacció de l'aigua i d'un hidrur de bor (tal com NaBH4). El motor funcionaria barrejant l'hidrur de bor amb aigua per produir l'hidrogen segons el qual necessita, de manera que solucionin algunes dificultats d'aplicar l'hidrogen amb seguretat en el transport i el seu emmagatzematge corresponent. La investigació s'està produint a la Universitat de Minessota (Estats Units) i a l'Institut de la Ciència a Rehovot (Israel).[20][21]
Precaucions
[modifica]Ni el bor ni els borats són tòxics; no obstant això, alguns dels més exòtics compostos de bor i hidrogen són tòxics i han de manipular-se amb atenció. La DL50 per als animals és d'uns 6 g per kg de pes corporal. Les substàncies amb LD50 per sobre de 2g es considera no tòxic. La dosi mínima letal per als éssers humans no ha estat establerta, però un consum de 4 g/dia es va reportar sense incidents, i les dosis clíniques de 20 g d'àcid bòric per a la teràpia per captura de neutrons no va causar problemes. Alguns peixos han sobreviscut durant 30 minuts en una solució saturada d'àcid bòric i poden sobreviure més temps en solucions de bòrax.[22] Els borats són més tòxics per als insectes que en els mamífers. El borà i alguns compostos gasosos similars són molt verinosos. Com de costum, no és un element intrínsecament verinós, però la seva toxicitat depèn de l'estructura.[23][24]
Els borans (compostos de bor d'hidrogen) són tòxics, així com fàcilment inflamables i requereixen cures especials durant la seva manipulació. El borohidrur de sodi presenta un perill d'incendi a causa del seu caràcter reductor, i l'alliberament d'hidrogen en contacte amb l'àcid. Els halurs de bor són corrosius.[25][26]
Salut
[modifica]Científicament, no s'ha demostrat que el bor sigui una substància considerada essencial a la dieta humana o que sigui un requisit dietari en vertebrats i invertebrats, o almenys de la mateixa importància que ocupa en els vegetals.
El cos humà conté almenys 0,7 mg per quilo de pes de bor obtingut del consum d'aigua i vegetals. Un humà consumeix en la seva ingesta diària uns 0,8-2,5 mg de bor per quilo de pes sense que es manifesti algun símptoma per això. Dietes forçades de 5 g al dia poden causar nàusees, diarrea i vòmits, algunes bibliografies suggereixen que 20 g al dia de bor pot ser mortal en organismes sensibles, però no s'ha comprovat.[27]
Altres bibliografies semblen associar l'ocurrència d'artritis per la ingesta de bor; però altres publicacions estimen que aquest element ha de ser considerat en l'àmbit d'element traça com a essencial per al metabolisme de calci, coure, magnesi i la fixació de nitrogen.[28]
L'OMS ha estimat que el nivell acceptable de bor a l'aigua és 2,4 ppm. A Europa, els estàndards locals oscil·len entre 1 - 2 ppm i al Canadà, 5 ppm.[27]
Abatiment del bor
[modifica]El bor a causa de la seva naturalesa no és fàcil d'eliminar matrius aquoses. Les tècniques clàssiques de coagulació, sedimentació i encara per osmosi inversa no són satisfactòries. Algunes entitats de recerca com ara Fundación Chile han assenyalat que l'aplicació de sistemes de resines d'intercanvi iònic en conjunt amb zeolites i carbó activat són molt més prometedores com a formes de reduir aquest element.[27]
Referències
[modifica]- ↑ Zhang, K.Q.; Guo, B.; Braun, V.; Dulick, M.; Bernath, P.F. «Infrared Emission Spectroscopy of BF and AIF». J. Molecular Spectroscopy, 170, 1995, pàg. 82. Arxivat de l'original el 2012-01-11. Bibcode: 1995JMoSp.170...82Z. DOI: 10.1006/jmsp.1995.1058 [Consulta: 14 abril 2013]. Arxivat 2012-01-11 a Wayback Machine.
- ↑ Lide, David R. (ed.). Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics. CRC press, 2000. ISBN 0849304814 [Consulta: 14 abril 2013].
- ↑ Holcombe Jr., C. E.; Smith, D. D.; Lorc, J. D.; Duerlesen, W. K.; Carpenter; D. A. «Physical-Chemical Properties of beta-Rhombohedral Boron». High Temp. Sci., 5, 5, 10-1973, pàg. 349–57.
- ↑ 4,0 4,1 «Atomic Weights and Isotopic Compositions for All Elements». National Institute of Standards and Technology.
- ↑ Szegedi, S.; Váradi, M.; Buczkó, Cs. M. [et al]. «Determination of boron in glass by neutron transmission method». Journal of Radioanalytical and Nuclear Chemistry Letters, 146, 3, 1990, pàg. 177. DOI: 10.1007/BF02165219.
- ↑ Shipley, Joseph T. The Origins of English Words: A Discursive Dictionary of Indo-European Roots. JHU Press, 2001.
- ↑ «Etymology of Elements». Arxivat de l'original el 22 de septiembre de 2009. [Consulta: 6 juny 2009].
- ↑ Weeks, Mary Elvira. «XII. Other Elements Isolated with the Aid of Potassium and Sodium: Beryllium, Boron, Silicon and Aluminum». A: The Discovery of the Elements. Easton, PA: Journal of Chemical Education, 1933.
- ↑ Borchert Dietz, W.; Kolker, H., W. «Crystal Growth of Beta–Rhombohedrical Boron». Zeitschrift für Angewandte Physik, 29, 1970.
- ↑ Liu, Z. «Two-body and three-body halo nuclei». Science in China G: Physics Mechanics and Astronomy, 46, 2003. 10.1360/03yw0027.
- ↑ Barth, S. «Boron isotopic analysis of natural fresh and saline waters by negative thermal ionization mass spectrometry». Chemical Geology, 143, 1997, pàg. 255–261. 10.1016/S0009-2541(97)00107-1.
- ↑ Simmons, R.; Ahsian, N.; Raven, H.. The Book of Stones: Who They Are and What They Teach. North Atlantic Books, 2007, p. 421–422.
- ↑ 13,0 13,1 Hammond, C. R.. The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press, 2004.
- ↑ Gogotsi, Y. G. and Andrievski, R.A.. Materials Science of Carbides, Nitrides and Borides. Springer, 1999, p. 270–270.
- ↑ Ehrenfried Zschech, Caroline Whelan, Thomas Mikolajick. Materials for information technology: devices, interconnects and packaging. Birkhäuser, 2005.
- ↑ May, Gary S. Fundamentals of semiconductor manufacturing and process control. John Wiley and Sons, 2006, p. 51–54.
- ↑ Sherer, J. Michael. Semiconductor industry: wafer fab exhaust management. CRC Press, 2005, p. 39–60.
- ↑ Solozhenko, V. L. «Ultimate Metastable Solubility of Boron in Diamond: Synthesis of Superhard Diamondlike BC5». Phys. Rev. Lett., 102, 2009. 10.1103/PhysRevLett.102.015506.
- ↑ Weimer, Alan W. Carbide, Nitride and Boride Materials Synthesis and Processing. Chapman & Hall (London, New York), 1997.
- ↑ Wentorf, R. H. «Cubic form of boron nitride». J. Chem Phys., 26, 1957. 10.1063/1.1745964.
- ↑ Qin, Jiaqian «Is Rhenium Diboride a Superhard Material?». Advanced Materials, 20, 2008, pàg. 4780. 10.1002/adma.200801471.
- ↑ Garrett, Donald E.. Borates. Academic Press, 1998.
- ↑ Garrett, Donald E.. Borates: handbook of deposits, processing, properties, and use. Academic Press, 1998, p. 102;385–386.
- ↑ «Boron». [Consulta: 5 maig 2009].
- ↑ «Environmental Health Criteria 204: Boron», 1998. [Consulta: 5 maig 2009].
- ↑ Vithana, En; Morgan, P; Sundaresan, P; Ebenezer, Nd; Tan, Dt; Mohamed, Md; Anand, S; Khine, Ko; Venkataraman, D; Yong, Vh; Salto-Tellez, M; Venkatraman, A; Guo, K; Hemadevi, B; Srinivasan, M; Prajna, V; Khine, M; Casey, Jr; Inglehearn, Cf; Aung, T «Mutations in sodium-borate cotransporter SLC4A11 cause recessive congenital hereditary endothelial dystrophy (CHED2).». Nature genetics, 38, 7, 7-2006, pàg. 755–7. ISSN: 1061-4036. 10.1038/ng182416767101.
- ↑ 27,0 27,1 27,2 Revista Ecoamérica, nov 2008
- ↑ OMS recomana 2 mg/dia de bor Consultat el 23/11/2011
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||

