Carbur d'alumini
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 143,92615452 Da |
| Estructura química | |
| Fórmula química | Al₄C₃ |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Punt de fusió | 2.100 ℃ |
| Cristal·lografia | |
| Sistema cristal·lí | sistema trigonal |
El carbur d'alumini, o tricarbur de tetraalumini, és un compost inorgànic format per cations alumini(3+), , i anions carbur, , de fórmula Es presenta en forma de pols o de sòlids cristal·lins que poden ser de color groc-marró o de color verd-marró.
Propietats
[modifica]El carbur d'alumini presenta una densitat de 2,36 g/cm³ i el seu punt de fusió, és de 1 400 °C. Aquest compost es descompon quan es posa en contacte amb aigua calenta, així com per addició d'àcid clorhídric diluït i per addició d'àcid sulfúric concentrat. El producte de la descomposició en ambdós casos és el metà:[1]
Classificació
[modifica]El carbur d'alumini forma part dels carburs iònics, que son aquells que presenten un caràcter fort de sal i es formen sobretot a partir dels elements dels grups I i II de la taula periòdica. Els elements d'aquests grups són molt electropositius i el carboni en conseqüència presenta una càrrega positiva.
Estructura
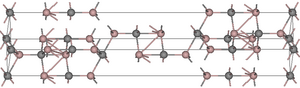
[modifica]Presenta una estructura cristal·lina poc freqüent, que consta de dues capes de Al2C i Al2C2. Cada àtom d'alumini es troba en coordinació amb 4 carburs d'alumini per donar una estructura tetraèdrica. Existeixen dos àtoms de carboni en ambients d'unió diferents; per una banda un octaedre de 6 àtoms d'alumini a una distància de 217 pm. L'altre és una estructura en forma de bipiràmide trigonal distorsionada formada per 4 àtoms d'alumini a una distància de 190 a 194 pm i 5 àtoms d'alumini a una distància de 221 pm.
Obtenció
[modifica]El carbur d'alumini es prepara per reacció directe entre alumini i carboni en un forn d'arc elèctric a uns 1000 °C en absència d'oxigen i nitrogen a partir de la reacció següent:[1]
Una alternativa és fer reaccionar òxid d'alumini o fosfat d'alumini amb carboni, produeix monòxid de carboni. Les reaccions són:[2]
També por obtenir-se per reacció de l'alumini amb el monòxid de carboni a alta temperatura:
Aparició
[modifica]Podem trobar petites quantitats de carbur d'alumini com a impureses del carbur de calci.
A la fabricació electrolítica d'alumini, el carbur d'alumini es forma com a resultat de la corrosió dels elèctrodes de grafit.
En materials compostos per una matriu de metall sobre la base d'una matriu d'alumini reforçat amb carburs no metàl·lics o fibres de carboni, el carbur d'alumini es forma com a producte no desitjat. En el cas de la fibra de carboni, reacciona amb la matriu d'alumini a temperatures superiors a 500 °C. Es pot aconseguir una inhibició de la reacció química mitjançant un recobriment de borur de titani (per exemple).
Aplicacions
[modifica]La seva aplicació principal és la utilització d'aquest compost als laboratoris per a l'obtenció de metà.
També pot ser utilitzat com a catalitzador o bé com a agent secant i agent reductor. Té diverses aplicacions en el sector de la metal·lúrgia, ja que pot actuar com a abrasiu en eines de tall d'alta velocitat i té aproximadament la mateixa duresa que el topazi.
Referències
[modifica]- ↑ 1,0 1,1 Wade, K.; Banister, A. J.. The Chemistry of Aluminium, Gallium, Indium and Thallium: Comprehensive Inorganic Chemistry (en anglès). Elsevier, 2016-06-07. ISBN 9781483153223.
- ↑ Advanced Inorganic Chemistry Vol-1 (en anglès). Krishna Prakashan Media. ISBN 9788187224037.
Enllaços externs
[modifica]- «Enciclonet - Carburo de aluminio» (castellà) [Consulta: 30 desembre 2020]
- «Ecured - Carburo de aluminio» (castellà) [Consulta: 30 desembre 2020]
- «Hoja informativa de sustancias peligrosas - Carburo de aluminio (PDF)» (castellà) [Consulta: 30 desembre 2020]
- «Ayudamos a conocer: Aluminio carburo» (en castellà). Arxivat de l'original el 2 juny 2016. [Consulta: 30 desembre 2020].









