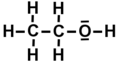Enllaç químic
L'enllaç químic és el fenomen fisicoquímic pel qual dos o més àtoms o ions s'uneixen per a formar compostos químics, obtenint així una major estabilitat. Per tant, per norma general, dos àtoms s'enllacen si l'energia assolida en la seva unió és inferior a la que tenia cadascun d'ells per separat. La gran majoria de les substàncies presents en la natura estan formades per conjunts d'àtoms vinculats entre si que, depenent dels tipus d'enllaços que presenten i les seves disposicions espacials, determinen les diferents propietats de les substàncies. Aquests fets atorguen una gran importància a l'estudi de l'enllaç químic, convertint-lo així en una de les disciplines més importants de la química.
Com s'ha dit anteriorment, les espècies químiques realitzen unions entre si per a assolir estadis de major estabilitat, tot disminuint l'energia del sistema; aquesta estabilitat se sol donar quan el nombre d'electrons que posseeix un àtom en el seu últim nivell energètic és igual a vuit (ns²np⁶), estructura que coincideix amb la del gas noble més proper en la taula periòdica. A més, perquè aquest obtingui una total estabilitat, haurà de formar un enllaç amb una altra espècie. Així doncs, d'aquesta descripció podem obtenir dues conclusions: la primera, que els gasos nobles (tal com indica el seu nom) no requereixen enllaçar-se amb cap altra substància, ja que són electrònicament estables per si sols, d'aquesta manera, podem trobar àtoms d'heli (He), de neó (Ne), d'argó (Ar), de criptó (Kr) i de xenó (Xe) aïllats; i la segona, la més important i la que atorga el sentit a la disciplina de la química com a ciència bàsica és que tota la resta d'elements químics tendiran a relacionar-se i reaccionar amb d'altres per aconseguir una major estabilitat. L'objectiu fonamental de la química serà doncs l'estudi d'aquestes reaccions, així com aprofundir en la composició de la matèria i el seu comportament. L'enllaç químic és, per tant, la disciplina encarregada de descriure les característiques de les unions entre les espècies químiques i les seves conseqüències, tant en l'àmbit microscòpic com macroscòpic.
Història
[modifica]Els primers plantejaments sobre la naturalesa dels enllaços químics van sorgir a principis del segle xii, i suposaven que certs tipus d'espècies químiques estaven vinculades per certs tipus d'afinitats químiques.
A mitjans del segle xix Edward Frankland, Friedrich Kekulé, A.S. Couper, Aleksandr Mikhailovich Butlerov i Hermann Kolbe, van desenvolupar teories de radicals, de valències anomenades en un principi "poder de combinar" en la qual els compostos s'atreien gràcies a l'atracció de pols positius i negatius.
El 1916, el químic Gilbert Newton Lewis va desenvolupar la idea de la unió per parells d'electrons i conjuntament amb Kössel van proposar que l'estabilitat atòmica s'obté quan els àtoms arriben a l'octet electrònic, que en l'actualitat s'identifica amb una configuració electrònica de gas noble (ns²np⁶). Walter Heitler i Fritz London van ser els autors de la primera explicació quàntica de la connexió química, especialment la de l'hidrogen molecular, el 1927, utilitzant la teoria de connexions de valència.[1] El 1930, la primera descripció matemàtica quàntica de l'enllaç químic simple la va fer Edward Teller en el seu doctorat.
El 1931, el químic Linus Pauling va publicar el que a vegades es considera el text més important de la història de la química: "The Nature of the Chemical Bond".
Teories d'enllaç
[modifica]És important indicar que l'enllaç químic és una situació d'equilibri de tipus elèctric, on les forces de repulsió entre nuclis i entre els núvols electrònics d'ambdós àtoms són mínimes i les forces d'atracció entre els nuclis i els electrons de tots dos són màximes. El punt d'equilibri acostuma a estar caracteritzat per la longitud i l'energia d'enllaç, on la longitud d'enllaç representa la distància en què l'energia és mínima (energia d'enllaç) i, per tant, l'estabilitat de la molècula és màxima. Si quan dos àtoms s'acosten les forces de repulsió superen les d'atracció, no es formarà l'enllaç, ja que no s'assoleix una longitud que estabilitzi la substància. L'explicació de les forces involucrades en un enllaç químic són descrites per les lleis de l'electrodinàmica quàntica. Nogensmenys, en ser un problema de molts cossos s'acostumen a utilitzar teories simplificades. Aquestes teories ofereixen una idea més o menys bona i aproximada de la situació real.
Teoria de Lewis
[modifica]L'any 1916, el fisicoquímic nord-americà Gilbert Newton Lewis va desenvolupar una teoria en què descrivia l'enllaç químic com la combinació d'un o més electrons entre dos àtoms, amb l'objectiu d'assolir l'octet electrònic i, per tant, una estructura de gas noble. Aquest enllaç té lloc entre àtoms que gairebé tenen complet el seu nivell de valència. Així doncs, amb l'octet aconsegueixen una estabilitat que no tenien com a àtoms independents.[2]
El terme regla de l'octet per descriure aquest fenomen fou definit per Irving Langmuir, que va ampliar i refinar la teoria de Lewis.[3][4]
Algunes idees bàsiques d'aquesta teoria són:
- Els electrons, especialment els que es troben en la capa més externa o de valència, tenen un paper fonamental en l'enllaç químic.
- En alguns casos es transfereixen electrons d'un àtom a un altre, formant-se ions positius i negatius que s'atrauen entre si per mitjà de forces electroestàtiques denominades enllaços iònics.
- En d'altres casos es comparteixen entre els àtoms un o més parells d'electrons; aquesta compartició es denomina enllaç covalent.
Per a representar l'octet electrònic, Lewis va suggerir una estructura anomenada electró-punt, en la qual cada àtom es representa amb el seu símbol químic i al seu voltant es van marcant tants punts com electrons tingui en la seva capa de valència. A aquestes estructures se les va anomenar, en honor del seu inventor, estructures de Lewis. Aquests són uns dels procediments més senzills i més utilitzats a l'hora d'indicar com es distribueixen els electrons en les molècules i els ions.
Per a representar espècies químiques mitjançant estructures de Lewis, se solen seguir els següents passos:
- Sumar els electrons de valència dels àtoms presents en la molècula. Si es tracta d'un anió, se li afegeix un electró per cada càrrega negativa, i si és un catió, es resten tants electrons com càrregues positives.
- Dibuixar la molècula amb els àtoms units per enllaços senzills i calcular el nombre d'electrons que s'han afegit; s'ha de tenir especial cura al dibuixar l'esquelet molecular correctament. Algunes premisses en què recolzar-se a l'hora de dibuixar la molècula són l'elecció d'un àtom central (que mai pot ser l'hidrogen i rarament ho és l'oxigen), que l'hidrogen sempre s'uneix formant enllaços simples, l'oxigen, majoritàriament, amb dos enllaços, el carboni amb quatre, el nitrogen amb tres, etc.
- Calcular el nombre d'electrons que manquen, distribuir-los per parelles entre els diferents àtoms procurant que es compleixi la regla de l'octet i formar, si s'escau, dobles enllaços. Tanmateix, val a dir que els elements més enllà del segon període poden sobrepassar la regla de l'octet.
Estructures ressonants
[modifica]Quan una molècula pot ser representada per més d'una estructura de Lewis, sempre que l'esquelet molecular es mantingui, es tracta d'una estructura ressonant. Les formes ressonants són cadascuna de les maneres de representar la molècula. L'híbrid de ressonància és la suma de totes aquestes maneres, per tant, cada forma ressonant contribueix a la descripció de la molècula. Les formes ressonants porten associada una energia de ressonància, que provoca una disminució energètica, fet que atorga més estabilitat al sistema; per tant, l'estabilitat del sistema augmentarà quantes més estructures ressonants se li atribueixin.
L'explicació d'aquesta disminució energètica és perquè aquestes formes no són úniques, sinó que la molècula resultant és un híbrid de les diferents representacions. Per exemple, l'anió nitrat, exposat més avall, presenta tres formes en ressonància, de manera que els tres enllaços nitrogen-oxigen tenen la mateixa distància i propietats, car que són una combinació entre ambdues representacions, l'enllaç simple (N-O) i l'enllaç doble (N=O).
Exemples d'estructures de Lewis
[modifica]-
Estructura de Lewis per a l'àtom de clor.
-
Estructura de Lewis per a l'amoníac.
-
Estructura de Lewis per al clor diatòmic.
-
Estructura de Lewis per al metà.
-
Estructura de Lewis per al diòxid de sofre.
-
Estructura de Lewis per a l'anió nitrat (forma ressonant).
-
Estructura de Lewis per a l'etanol.
Teoria RPECV
[modifica]Les estructures de Lewis ens donen informació sobre l'esquelet molecular i l'estructura electrònica d'aquesta, però no ens donen informació sobre la geometria de la molècula. És de gran importància conèixer la geometria de les molècules, ja que depenent de com es trobin orientats els àtoms en l'espai, la molècula tindrà unes propietats fisicoquímiques diferents, tant a nivell microscòpic com macroscòpic. Per a determinar-ne l'estructura, el científic Ronald Gillespie va idear la teoria de la repulsió dels parells d'electrons de la capa de valència (RPECV).
Aquesta teoria es basa en la màxima que afirma que les molècules cerquen tenir l'orientació que provoqui la mínima repulsió entre els parells d'electrons que hi ha al voltant de l'àtom central. Aquesta teoria diferencia els parells d'electrons en dos tipus:
- Parells d'electrons no enllaçants, són els que no formen cap enllaç però ocupen un lloc en l'espai.
- Parells d'electrons enllaçants, són els que constitueixen els enllaços.
Com que la teoria RPECV es basa en el fet que la molècula adopta la forma geomètrica de mínima repulsió entre els electrons de la capa de valència és important conèixer l'ordre de repulsió entre els parells d'electrons al voltant de l'àtom central. En aquest ordre, la repulsió màxima es produeix entre els parells d'electrons no enllaçants i la mínima entre els parells d'electrons enllaçants. Segons siguin el nombre de parells d'electrons al voltant de l'àtom central, podem diferenciar un gran nombre de geometries bàsiques o ideals. A partir d'elles, segons les repulsions dels parells d'enllaç, es pot determinar la geometria real de la molècula. Cal afegir que en la teoria RPECV, els enllaços dobles es consideren de la mateixa manera que els enllaços senzills.

Així doncs, es descriuen una sèrie de geometries per les diferents situacions en què l'àtom central de la molècula es vegi envoltat per dos, tres, quatre, cinc o sis grups d'electrons distribuïts al seu voltant (ja siguin enllaçants o no enllaçants):
- Dos grups d'electrons: lineal
- Tres grups d'electrons: trigonal plana
- Quatre grups d'electrons: tetraèdrica
- Cinc grups d'electrons: bipiramidal trigonal
- Sis grups d'electrons: octaèdrica
Per exemple, en el cas del metà (CH₄), en què el carboni s'enllaça a 4 àtoms d'hidrogen per tal d'omplir la seva capa semiplena (2s²2p² → 2s²2p⁶), l'àtom de C central s'envolta de 4 parells d'electrons i, per tant, acaba tenint una estructura tetraèdrica. En el cas de l'aigua (H₂O), l'oxigen s'enllaça amb únicament 2 àtoms d'hidrogen per tal d'omplir la seva capa semiplena (2s²2p4 → 2s²2p⁶), això és degut al fet que l'O només necessita 2 electrons per tal de completar la segona capa electrònica i, per tant, amb rebre els electrons de dos àtoms d'hidrogen en té prou; ara bé, no s'ha pas d'errar dient que la molècula serà lineal, ja que si bé s'enllaça a solament dos àtoms d'hidrogen, l'oxigen ja disposa de dos parells d'electrons previs que no acaben enllaçant, per tant, l'oxigen de la molècula d'aigua es veu rodejat per 4 parells d'electrons, donant així una estructura electrònica tetraèdrica. Tanmateix, hom únicament té en compte l'estructura tridimensional que formen els àtoms entre si, raó per la qual la molècula d'aigua és considerada angular.
Teoria de l'enllaç de valència
[modifica]La teoria de l'enllaç de valència es complementa amb la regla de l'octet. No pot descriure adequadament als àtoms amb orbitals actius, com els metalls de transició, però la teoria és molt senzilla i descriu adequadament la majoria dels compostos. Segons aquesta teoria, la formació de l'enllaç covalent es du a terme per mitjà de la superposició d'orbitals atòmics. Tanmateix, si s'intenta aplicar el mètode de l'enllaç de valència a un gran nombre de molècules observem que en la majoria de casos, les descripcions de la geometria molecular, basades en la superposició senzilla d'orbitals atòmics, no coincideix amb els valors obtinguts experimentalment. Per exemple, si ens basem en la configuració electrònica de la capa de valència corresponent a l'estat fonamental del carboni i utilitzem únicament orbitals semiplens, es prediu l'existència d'una molècula amb la fórmula CH₂ amb un angle d'enllaç de 90°. La molècula CH₂ és altament reactiva, observable únicament en condicions especials. Per tant, per a solucionar aquest problema, es desenvolupen una sèrie d'orbitals anomenats orbitals híbrids.
Els orbitals híbrids són una combinació lineal d'orbitals atòmics, pertanyents a un mateix àtom amb l'objectiu de crear-ne uns altres, els orbitals híbrids, que permeten explicar les geometries observades de les molècules i les forces dels enllaços. Ara sí, la molècula de metà pot ésser explicada; de manera que una combinació algebraica de les equacions d'ona de l'orbital 2s i els tres orbitals 2p de l'àtom de carboni permet obtenir un nou conjunt de quatre orbitals idèntics entre si. Aquests nous orbitals estan dirigits en l'espai de forma tetraèdrica i tenen energies intermèdies entre les dels orbitals 2s i 2p. A aquests nous orbitals híbrids se'ls anomenarà orbitals sp³, perquè són la fusió entre un orbital s i tres orbitals p. Per tant, d'aquesta manera, cada nou orbital sp³ podrà superposar-se amb un orbital 1s d'un àtom d'hidrogen, formant així la molècula de metà.
Teoria d'orbitals moleculars
[modifica]Les estructures de Lewis, la teoria RPECV i el mètode de l'enllaç de valència descriuen l'enllaç covalent i les estructures moleculars satisfactòriament en la majoria de casos. Tanmateix, cap d'aquests mètodes proporciona una explicació dels espectres electrònics de les molècules, del paramagnetisme de l'oxigen diatòmic o de l'estabilitat de l'espècie H₂+. Per a respondre aquestes qüestions es necessita descriure l'enllaç químic per mitjà d'un altre mètode diferent. Aquest mètode, anomenat teoria d'orbitals moleculars, assigna els electrons d'una molècula a una sèrie d'orbitals que pertanyen a la molècula com un tot, anomenats orbitals moleculars.

Quan dos àtoms s'apropen, les funcions d'ona dels seus orbitals es combinen i interfereixen de manera constructiva o destructiva. La interferència constructiva correspon a l'addició de les dues funcions matemàtiques; la interferència destructiva correspon, doncs, a la sostracció de les dues funcions. La interferència constructiva conferirà densitat electrònica entre els nuclis d'ambdós àtoms i, per tant, donarà pas a un orbital molecular enllaçant. En canvi, si la interferència és destructiva, la probabilitat electrònica entre els dos nuclis es reduirà, donant lloc a un orbital molecular antienllaçant. Els orbitals enllaçants tindran una energia més baixa que els orbitals atòmics i els antienllaçants en tindran una de major; per tant, una molècula serà més estable com més orbitals enllaçants i menys orbitals antienllaçants tingui.
Per a representar els orbitals enllaçants i antienllaçants, s'acostumen a usar els diagrames d'orbitals moleculars, que en donen una idea bàsica. D'aquesta manera, la teoria d'orbitals moleculars soluciona molts fenòmens que s'escapen de l'enllaç de valència.
Tipus d'enllaç
[modifica]En general, els enllaços químics es poden dividir en dos grans grups: els enllaços interatòmics i els enllaços intermoleculars.
Enllaç interatòmic
[modifica]Els enllaços interatòmics són una unió entre àtoms en la qual s'estableixen transferències o comparticions d'electrons de valència; és a dir, els electrons més superficials de l'àtom.
Hi ha tres tipus d'enllaç interatòmic:
Enllaç iònic
[modifica]
És la unió entre un àtom d'un element metàl·lic electropositiu que cedeix un o més electrons a l'àtom d'un element no metàl·lic electronegatiu. A causa d'aquesta transferència, les dues espècies químiques esdevenen ions amb càrregues de signe oposat i, per tant, queden enllaçades electroestàticament, formant xarxes iòniques. D'aquesta manera, ambdós àtoms aconsegueixen la configuració electrònica del gas noble més proper i, a més, enllaçar-se.
L'exemple de xarxa iònica per antonomàsia és la del clorur de sodi (NaCl), en què el sodi (Na, electropositiu) cedeix el seu electró més superficial al clor (Cl, electronegatiu).
- Xarxa iònica:
Els compostos iònics no formen pas molècules, sinó xarxes cristal·lines molt estables, en què els cations s'envolten del nombre més gran possible d'anions, i viceversa. La forma de la xarxa cristal·lina dependrà de la similitud que hi hagi entre les mides de l'anió i el catió i la seva càrrega. Si ambdós ions tenen la mateixa càrrega, com és el cas del clorur de sodi, hi haurà tants ions positius (Na+) com negatius (Cl-). Per contra, si la càrrega d'un ió és el doble que la de l'altre, aleshores hi haurà el doble d'ions d'un tipus que de l'altre, com és el cas de l'òxid de sodi (Na₂O) o el fluorur de calci (CaF₂). La fórmula dels compostos iònics ens indicaran la proporció en què es combinen els àtoms.
- Propietats dels compostos iònics:
Els compostos iònics són sòlids a temperatura ambient i tenen un punt de fusió elevat, a causa de la gran estabilitat de la xarxa cristal·lina iònica. Per tal de fondre un compost iònic, cal comunicar-li molta energia per tal que els ions deixin d'ocupar el seu lloc dins la xarxa perfectament ordenada i altament estable. Tanmateix, les xarxes són dures i fràgils. Això és degut al fet que per a ratllar un compost iònic cal separar els ions, fortament units. La fragilitat ve donada perquè un cop pot desplaçar els ions d'un pla de la xarxa, fent que quedin enfrontats a ions del mateix signe i, per tant, es repelin, trencant així el cristall.
En estat sòlid no condueixen l'electricitat, ja que els ions del compost ocupen posicions fixes; però quan estan fosos o bé en una solució, la xarxa cristal·lina s'ha desfet i les càrregues ja es poden moure. La majoria de compostos iònics es dissolen bé en aigua i altres dissolvents polars, perquè els pols positius del dissolvent envolten els ions negatius i els pols negatius envolten els ions positius, permetent així que el cristall es dissolgui. D'aquesta manera, els dissolvents apolars com el benzè o la gasolina no seran capaços de dissoldre'l.
Enllaç covalent
[modifica]
És la unió entre dos àtoms d'elements no metàl·lics i electronegatius. Aquesta unió es du a terme mitjançant una compartició total o parcial dels electrons de valència. Atès que cada àtom exerceix una diferent força atractiva als electrons compartits i a l'estructura d'aquesta, es poden arribar a crear dipols; és a dir, parts de la molècula amb densitat de càrrega positiva o negativa.
Un exemple de molècula covalent és el clorur d'hidrogen (HCl) en què l'hidrogen i el clor comparteixen el seu electró més superficial. En aquest cas, es produeix un dipol en la molècula perquè el clor és més electronegatiu que l'hidrogen i, per tant, atrau ambdós electrons compartits amb més força; això causa l'aparició de densitats de càrrega parcials (δ) diferents entre el clor (δ-) i l'hidrogen (δ+), creant així el dipol. D'aquesta manera, aquesta espècie química serà propensa a establir forces de van der Waals amb d'altres.
Enllaç metàl·lic
[modifica]
És la unió entre un conjunt d'àtoms d'elements metàl·lics en què comparteixen els seus electrons més superficials entre tots, formant una xarxa metàl·lica i creant així un núvol d'electrons que confereix al metall una gran duresa, ductilitat i conductivitat, tant elèctrica com tèrmica.
Un exemple de xarxa metàl·lica pot ésser qualsevol metall: el ferro (Fe), l'argent (Ag), el coure (Cu), l'or (Au), el zinc (Zn), etc.
Enllaç intermolecular
[modifica]Els enllaços intermoleculars són una unió, generalment dèbil i abundant en la bioquímica, en què diferents parts de determinades molècules es veuen atretes electroestàticament. Aquestes forces acostumen a ser anomenades forces de van der Waals, en honor del seu descobridor. Existeixen tres tipus de forces de van der Waals:
Forces de dispersió (de London)
[modifica]Les forces de van der Waals de dispersió són el tipus d'enllaç intermolecular que té lloc entre dipols temporals o transitoris en molècules sense moment dipolar permanent. Una molècula apolar pot patir espontàniament una separació de càrregues, donant lloc a un dipol temporal que, a la vegada, és capaç de causar-li un dipol induït a una altra, formant així una unió feble i efímera entre aquests. Les forces de dispersió són més freqüents i intenses com més electrons té la molècula; és, per tant, més polaritzable. Un exemple de substància amb presència d'aquest tipus d'unió són els gasos nobles, en què el núvol electrònic d'un àtom es pot veure atret electroestàticament pel nucli atòmic d'un altre; d'aquesta manera mantenen una certa cohesió a causa d'aquestes forces. Un altre exemple de forces de dispersió són les unions que tenen lloc entre hidrocarburs, sobretot entre cadenes hidrocarbonades.
Forces d'inducció
[modifica]Les forces de van der Waals d'inducció tenen lloc entre un dipol permanent i un dipol induït. El dipol permanent indueix a una altra molècula apolar una separació de càrregues, que deriva en un dipol induït. Un exemple de força d'inducció podria ser la unió espontània entre una molècula d'aigua (H₂O, dipol permanent) i un àtom de potassi (K, dipol induït), ja que núvol electrònic d'aquest es veuria atret momentàniament pels hidrògens de l'aigua (pol positiu).
Forces d'orientació
[modifica]Les forces de van der Waals d'orientació tenen lloc entre dipols permanents. Al trobar-se dues molècules amb dipols permanents, establiran un enllaç feble que les durà a orientar-se de forma que el pol positiu d'una estigui encarat cap al pol negatiu de l'altra. L'exemple més conegut d'enllaç per forces d'orientació és el pont d'hidrogen, en el qual un àtom d'hidrogen amb densitat de càrrega parcial positiva es veu atret per un altre àtom amb densitat de càrrega parcial negativa. Un exemple de substància amb presència d'aquest tipus d'unió és l'amoníac (NH₃), ja que, a causa de la seva estructura piramidal trigonal, les seves molècules presenten dipols permanents (el nitrogen amb δ- i els hidrògens amb δ+), entre els quals es poden formar unions d'aquestes característiques, nitrogen-hidrogen.
Paràmetres moleculars de l'enllaç covalent
[modifica]Actualment, hi ha la capacitat de determinar experimentalment els valors de les propietats que caracteritzen els enllaços i d'obtenir informació important a l'hora d'identificar les molècules covalents i conèixer-ne les propietats.
Energia d'enllaç
[modifica]L'energia d'enllaç és l'energia que es desprèn quan es forma un enllaç entre dos àtoms en estat gasós. Aquesta energia s'allibera a causa de l'estabilitat que adquireixen els àtoms en formar un enllaç. El valor d'aquesta energia ens indica la força amb què els àtoms es mantenen units. L'energia d'enllaç dels enllaços múltiples és major que la d'un enllaç senzill. Així, un enllaç doble té més energia que un enllaç senzill, però no el doble. Succeeix el mateix amb un enllaç triple.
Longitud d'enllaç
[modifica]La longitud d'enllaç és la distància mitjana entre els nuclis atòmics, tenint en compte els moviments de vibració i gir que realitzen els àtoms. Aquesta longitud coincideix amb la suma dels radis atòmics quan es tracta d'enllaços entre àtoms idèntics. En canvi, si els àtoms són diferents, la longitud d'enllaç sol ser menor que la suma dels dos radis atòmics sense enllaçar, ja que l'atracció entre els àtoms s'intensifica i la distància s'escurça. Per exemple, el radi atòmic del clor és de 99pm (picòmetres) i la distància d'enllaç Cl−Cl és 198pm. En el cas del clorur d'hidrogen, la longitud d'enllaç és de 128pm, inferior a la suma dels radis atòmics (hidrogen 37pm i clor 99pm).
En el cas d'enllaços múltiples, la distància d'enllaç es redueix. Per exemple, la longitud d'enllaç C−C és de 154pm, el doble que el radi atòmic del carboni (77pm). En canvi, la longitud d'enllaç C=C és de 133pm, i la del triple enllaç (C≡C) és de 120pm. Aquest fenomen és conseqüència de l'augment de la densitat electrònica entre els àtoms, la qual fa augmentar l'atracció entre els àtoms i disminuir així la seva separació.
Angle d'enllaç
[modifica]L'angle d'enllaç és l'angle mitjà i hipotètic entre dos enllaços. Aquest depèn de la geometria de la molècula i, per tant, conèixer-lo ens proporciona informació sobre la disposició espacial d'aquesta. Per exemple, els enllaços H−O de l'aigua formen un angle H−O−H de 104,45º i, en canvi, el clorur de beril·li (BeCl₂) forma enllaços Cl−Be−Cl amb angles de 180°.
Vegeu també
[modifica]- Regla de l'octet
- Estructura de Lewis
- Teoria RPECV
- Teoria de l'enllaç de valència
- Teoria dels orbitals moleculars
- Enllaç iònic
- Enllaç covalent
- Enllaç metàl·lic
- Forces de van der Waals
- Forces de dispersió de London
- Pont d'hidrogen
- Electronegativitat
- Enllaç carboni-nitrogen
Referències
[modifica]- ↑ W. Heitler, F. London «Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik». Zeitschrift für Physik, 4, 1927, pàg. 455-472 [Consulta: 9 maig 2023]. Adaptació a l'anglès «Interaction between neutral atoms and homopolar binding according to quantum mechanics», a Hettema, H. Quantum Chemistry: Classic Scientific Papers. Singapur: World Scientific, 2000. DOI 10.1142/9789812795762_0009.
- ↑ Lewis, G. N. «The Atom and the Molecule». Journal American Chemical Society, 38, 762-785, 1916.
- ↑ Langmuir, I. «The Arrangement of Electrons in Atoms and Molecules». Journal American Chemical Society, 41, 1919, pàg. 868-934.
- ↑ Jensen, W. B. «Abegg, Lewis, Langmuir, and the octet rule». Journal Chemical Education, 61, 1984, pàg. 191-200. DOI: 10.1021/ed061p191 [Consulta: 7 maig 2023].
Bibliografia
[modifica]- Petrucci, R.H., Herring, F.G., Madura, J.D., Bissonnette, C. Química General. 10a edició. PEARSON EDUCACIÓN, S.A., Madrid, 2011. ISBN 978-84-8322-680-3
- Boixaderas Sáez, N., Ibar Roy, M.J., Lladó Serra, N., Vidal Fernández, M.C. Química 1. Santillana Educación, S.L., Barcelona, 2008. ISBN 978-84-7918-377-6
- Boixaderas Sáez, N., Guardia Villaroel, C., Ibar Roy, M.J., Lladó Serra, N., Menéndez Hurtado, A.I., P. de Azpeitia, F.P. Química 2. Santillana Educación, S.L., Barcelona, 2009. ISBN 978-84-7918-354-7
- Castells i Esqué, P., Riba i Soldevila, N., Andreu i Mateu, F. Química 2. McGraw-Hill/Interamericana de España, S.L., Madrid, 2013. ISBN 978-84-481-8463-6
- Pauling, L. The Nature of the Chemical Bond. 3a ed. Cornell University Press, 1960. ISBN 0801403332.