Dipol elèctric
En física, un dipol (del grec antic, δίς (dis), «dues vegades»; πόλος (polos), «eix»)[1] és un fenomen electromagnètic que es produeix de dues maneres:
- Un dipol elèctric s'ocupa de la separació de les càrregues elèctriques positives i negatives que es troben en qualsevol sistema electromagnètic. Un exemple senzill d'aquest sistema és un parell de càrregues d'igual magnitud però de signe oposat separades per una distància típicament petita (un dipol elèctric permanent s'anomena electret).
- Un dipol magnètic és la circulació tancada d'un sistema de corrent elèctric. Un exemple senzill és un sol bucle de filferro amb corrent constant a través d'ell. Un imant de barra és un exemple d'imant amb un moment dipolar magnètic permanent.[2][3]
Els dipols, siguin elèctrics o magnètics, es poden caracteritzar pel seu moment dipolar, una magnitud vectorial. Per al dipol elèctric simple, el moment dipolar elèctric apunta des de la càrrega negativa cap a la càrrega positiva, i té una magnitud igual a la força de cada càrrega multiplicada per la separació entre les càrregues; per ser exactes, per a la definició del moment dipolar, sempre s'ha de tenir en compte el «límit dipolar», on, per exemple, la distància de les càrregues generadores hauria de convergir a 0, mentre que simultàniament, la força de la càrrega hauria de divergir fins a l'infinit en aquests casos. una manera que el producte es manté una constant positiva.
-
El camp magnètic d'una esfera amb un pol magnètic nord a la part superior i un pol magnètic sud a la part inferior. En comparació, la Terra té un pol magnètic sud prop del seu pol geogràfic nord i un pol magnètic nord prop del seu pol sud
-
Gràfic de contorns del potencial electroestàtic d'un dipol elèctric orientat horitzontalment de mida infinitesimal. Els colors forts indiquen el potencial més alt i més baix (on es troben les càrregues oposades del dipol)
Els dipols apareixen en cossos aïllants dielèctrics. A diferència del que passa en els materials conductors, en els aïllants els electrons no són lliures. En aplicar un camp elèctric a un dielèctric aïllant aquest es polaritza i provoca que els dipols elèctrics es reorienten en la direcció del camp disminuint la intensitat d'aquest. És el cas de la molècula d'aigua. Encara que té una càrrega total neutra (igual nombre de protons que d'electrons), presenta una distribució asimètrica dels seus electrons, la qual cosa la converteix en una molècula polar, al voltant de l'oxigen es concentra una densitat de càrrega negativa, mentre que els nuclis d'hidrogen queden nus, desproveïts parcialment dels seus electrons i manifesten, per tant, una densitat de càrrega positiva. Per això en la pràctica, la molècula d'aigua es comporta com un dipol. Així s'estableixen interaccions dipol-dipol entre les mateixes molècules d'aigua, formant-se enllaços o ponts d'hidrogen. La càrrega parcial negativa de l'oxigen d'una molècula exerceix atracció electroestàtica sobre les càrregues parcials positives dels àtoms d'hidrogen d'altres molècules adjacents. Encara que són unions febles, el fet que al voltant de cada molècula d'aigua es disposin quatre molècules unides per ponts d'hidrogen permet que es formi en l'aigua (líquida o sòlida) una estructura de tipus reticular, responsable en gran part del seu comportament anòmal i de la peculiaritat de les seves propietats fisicoquímiques.
Per al bucle de corrent magnètic (dipol), el moment dipolar magnètic apunta a través del bucle (segons la regla de la mà dreta), amb una magnitud igual al corrent del bucle multiplicada per l'àrea del bucle.
De manera similar als bucles de corrent magnètic, la partícula electró i algunes altres partícules fonamentals tenen moments dipolars magnètics, ja que un electró genera un camp magnètic idèntic al generat per un bucle de corrent molt petit. Tanmateix, el moment dipolar magnètic d'un electró no es deu a un bucle de corrent, sinó a una propietat intrínseca de l'electró.[4] L'electró també pot tenir un moment dipolar elèctric, tot i que encara no s'ha observat (vegeu moment dipolar elèctric de l'electró).
Un imant permanent, com un imant de barra, deu el seu magnetisme al moment dipolar magnètic intrínsec de l'electró. Els dos extrems d'un imant de barra s'anomenen pols, que no s'han de confondre amb monopols (vegeu l'apartat «Classificació» a continuació) i es poden etiquetar «nord» i «sud».
Pel que fa al camp magnètic terrestre, són pols de «buscar el nord» i de «buscar el sud» respectivament; si l'imant estigués suspès lliurement al camp magnètic de la Terra, el pol que busca el nord apuntaria cap al nord i el pol que busca el sud apuntaria cap al sud. El moment dipolar de la barra imant apunta des del seu sud magnètic fins al seu pol nord magnètic. En una brúixola magnètica, el pol nord d'un imant de barra apunta al nord. Tanmateix, això vol dir que el pol nord geomagnètic de la Terra és el pol sud (pol que busca el sud) del seu moment dipolar i viceversa.
Els únics mecanismes coneguts per a la creació de dipols magnètics són els bucles de corrent o l'espín mecànic quàntic, ja que l'existència de monopols magnètics mai s'ha demostrat experimentalment.
Classificació
[modifica]Un dipol físic consta de dues càrregues puntuals iguals i oposades; en sentit literal, dos pols. El seu camp a grans distàncies (és a dir, distàncies grans en comparació amb la separació dels pols) depèn gairebé completament del moment dipolar tal com s'ha definit anteriorment. Un dipol puntual (elèctric) és el límit que s'obté deixant que la separació tendeixi a 0 mentre es manté el moment dipolar fix. El camp d'un dipol puntual té una forma particularment simple, i el terme d'ordre 1 en el desenvolupament multipolar és precisament el camp del dipol puntual.
-
Línies de camp elèctric de dues càrregues oposades separades per una distància finita
-
Línies de camp magnètic d'un corrent en anell de diàmetre finit
-
Línies de camp d'un dipol puntual de qualsevol tipus, elèctric, magnètic, acústic, etc
Tot i que no hi ha monopols magnètics coneguts a la natura, hi ha dipols magnètics en forma de espín mecànic quàntic associat a partícules com els electrons (tot i que la descripció precisa d'aquests efectes queda fora de l'electromagnetisme clàssic). Un dipol puntual magnètic teòric té un camp magnètic de la mateixa forma que el camp elèctric d'un dipol puntual elèctric. Un bucle de corrent molt petit és aproximadament un dipol puntual magnètic; el moment dipolar magnètic d'aquest bucle és el producte del corrent que circula pel bucle i l'àrea (vector) del bucle.
Qualsevol configuració de càrregues o corrents té un «moment dipolar», que descriu el dipol el camp del qual és la millor aproximació, a grans distàncies, al de la configuració donada. Aquest és simplement un terme de l'expansió multipolar quan la càrrega total («moment monopolar») és 0, com sempre és per al cas magnètic, ja que no hi ha monopols magnètics. El terme dipolar és el dominant a grans distàncies: el seu camp cau en proporció a 1r3, en comparació amb 1r4 per al següent terme (quadrupol) i potències superiors de 1r per a termes superiors, o 1r2 pel terme monopol.
Dipols moleculars
[modifica]Moltes molècules tenen aquests moments dipolars a causa de distribucions no uniformes de càrregues positives i negatives en els diferents àtoms. Aquest és el cas dels compostos polars com el fluorur d'hidrogen (HF), on la densitat electrònica es comparteix de manera desigual entre els àtoms. Per tant, el dipol d'una molècula és un dipol elèctric amb un camp elèctric inherent que no s'ha de confondre amb un dipol magnètic, que genera un camp magnètic.
El químic i físic Peter J. W. Debye va ser el primer científic que va estudiar àmpliament els dipols moleculars i, com a conseqüència, els moments dipolars es mesuren en la unitat no-SI anomenada debye en el seu honor.
Per a les molècules hi ha tres tipus de dipols:
- Dipols permanents: es produeixen quan dos àtoms d'una molècula tenen una electronegativitat substancialment diferent: un àtom atrau electrons més que un altre, tornant-se més negatius, mentre que l'altre àtom es torna més positiu. Una molècula amb un moment dipolar permanent s'anomena molècula polar (Vegeu Interaccions dipol-dipol).
- Dipols instantanis: es produeixen per casualitat quan els electrons estan més concentrats en un lloc que en un altre en una molècula, creant un dipol temporal. Aquests dipols són de menor magnitud que els dipols permanents, però encara tenen un paper important en química i bioquímica a causa de la seva prevalença (Vegeu dipol instantani).
- Dipols induïts: es poden produir quan una molècula amb un dipol permanent repel·leix els electrons d'una altra molècula, induint un moment dipolar en aquesta molècula. Una molècula es polaritza quan porta un dipol induït (Vegeu Interacció ió-dipol induït).
De manera més general, un dipol induït de qualsevol distribució de càrrega polaritzable ρ (recordeu que una molècula té una distribució de càrrega) és causat per un camp elèctric extern a ρ. Aquest camp pot, per exemple, originar-se a partir d'un ió o molècula polar a les proximitats de ρ o pot ser macroscòpic (per exemple, una molècula entre les plaques d'un condensador carregat). La mida del moment dipolar induït és igual al producte de la força del camp extern i la polarització del dipol de ρ.
Els valors del moment dipolar es poden obtenir a partir de la mesura de la constant dielèctrica. Alguns valors típics de la fase gasosa en unitats debye són:[5]
- diòxid de carboni (CO₂): 0
- monòxid de carboni (CO): 0,112 D
- ozó (O₃): 0,53 D
- fosgen (COCl₂): 1,17 D
- amoníac (NH₃): 1,42 D
- vapor d'aigua (H₂O): 1,85 D
- cianur d'hidrogen (HCN): 2,98 D
- cianamida (CN₂H₂): 4,27 D
- bromur de potassi (Kbr): 10,41 D
El bromur de potassi (KBr) té un dels moments dipolars més alts perquè és un compost iònic que existeix com a molècula en fase gasosa.
El moment dipolar global d'una molècula es pot aproximar com una suma vectorial dels moments dipolars d'enllaç. Com a suma vectorial depèn de l'orientació relativa dels enllaços, de manera que a partir del moment dipolar es pot deduir informació sobre la geometria molecular.
-
La molècula lineal CO₂ té un dipol zero ja que els dos dipols d'enllaç es cancel·len
-
La molècula doblegada H₂O té un dipol xarxa. Els dos dipols d'enllaç no es cancel·len
Per exemple, el dipol zero del CO₂ implica que els dos moments dipolars de l'enllaç C=O es cancel·len de manera que la molècula ha de ser lineal. Per a H₂O, els moments d'enllaç O-H no es cancel·len perquè la molècula està doblegada. Per a l'ozó (O₃), que també és una molècula doblegada, els moments dipolars d'enllaç no són zero, tot i que els enllaços O-O es troben entre àtoms similars. Això coincideix amb les estructures de Lewis per a les formes de ressonància de l'ozó que mostren una càrrega positiva a l'àtom d'oxigen central.
Un exemple en química orgànica del paper de la geometria en la determinació del moment dipolar són els isòmers cis i trans de l'1,2-dicloroetè. En l'isòmer cis, els dos enllaços polars C−Cl es troben al mateix costat del doble enllaç C=C i el moment dipolar molecular és 1,90 D. En l'isòmer trans, el moment dipolar és zero perquè els dos enllaços C−Cl són a costats oposats del C=C i es cancel·len (i també es cancel·len els dos moments d'enllaç per als enllaços C−H molt menys polars).
Un altre exemple del paper de la geometria molecular és el trifluorur de bor, que té tres enllaços polars amb una diferència d'electronegativitat superior al llindar tradicionalment citat d'1,7 per a l'enllaç iònic. Tanmateix, a causa de la distribució triangular equilàter dels ions fluorur centrats i en el mateix pla que el catió bor, la simetria de la molècula fa que el seu moment dipolar sigui zero.
Operador de dipol mecànic quàntic
[modifica]Considerem una col·lecció de N partícules amb càrregues qi i vectors de posició ri. Per exemple, aquesta col·lecció pot ser una molècula formada per electrons, tots amb càrrega e-, i nuclis amb càrrega eZi, on Zi és el nombre atòmic de l'i-è nucli. El dipol observable (quantitat física) té l'«operador dipol» mecànic quàntic:
S'ha de tenir en compte que aquesta definició només és vàlida per a àtoms o molècules neutres, és a dir, càrrega total igual a zero. En el cas ionitzat, tenim
on és el centre de massa de la molècula/grup de partícules.[6]
Dipols atòmics
[modifica]Un àtom no degenerat (estat S) només pot tenir un dipol permanent zero. Aquest fet se segueix mecànicament quàntic de la simetria d'inversió dels àtoms. Els tres components de l'operador dipol són antisimètrics en inversió respecte al nucli,
on és l'operador dipol i és l'operador d'inversió.
El moment dipolar permanent d'un àtom en un estat no degenerat (vegeu nivells d'energia degenerats) es dona com el valor esperat (mitjana) de l'operador dipol,
on és una funció d'ona d'estat S, no degenerada, que és simètrica o antisimètrica en inversió: . Com que el producte de la funció d'ona (al ket) i el seu complex conjugat (al bra) és sempre simètric en inversió i la seva inversa,
es dedueix que el valor de l'expectativa canvia de signe sota inversió. Hem utilitzat aquí el fet que , sent un operador de simetria, és unitari: i per definició l'adjunt hermitià es pot moure de bra a ket i després es converteix en . Com que l'única quantitat que és igual o menor a ell és zero, el valor d'expectativa s'esvaeix,
En el cas dels àtoms de capa oberta amb nivells d'energia degenerats, es podria definir un moment dipolar amb l'ajuda de l'efecte Stark de primer ordre. Això dona un dipol que no s'esvaeix (per definició proporcional a un desplaçament de Stark de primer ordre que no s'esvaeix) només si algunes de les funcions d'ona que pertanyen a les energies degenerades tenen paritat oposada; és a dir, tenen un comportament diferent sota inversió. Això és un fet poc freqüent, però passa per a l'àtom d'hidrogen (H) excitat, on els estats 2s i 2p són degenerats «accidentalment» (vegeu l'article Vector de Laplace-Runge-Lenz per a l'origen d'aquesta degeneració) i tenen paritat oposada (2s és parell i 2p és senar).
Camp d'un dipol magnètic estàtic
[modifica]Magnitud
[modifica]La força de camp llunyà, B, d'un camp magnètic dipolar ve donada per
on
- B és la força del camp, mesurada en tesles.
- r és la distància des del centre, mesurada en metres.
- λ és la latitud magnètica (igual a 90°− θ) on θ és la colatitud magnètica, mesurada en radians o graus des de l'eix del dipolar.[Nota 1]
- m és el moment dipolar, mesurat en ampere-metre quadrat o joule per tesla.
- μ0 és la permeabilitat de l'espai lliure, mesurada en henry per metre.
La conversió a coordenades cilíndriques s'aconsegueix utilitzant r2 = z2 + ρ2 i
on ρ és la distància perpendicular de l'eix z. Llavors,
Forma vectorial
[modifica]El camp en si és una quantitat vectorial:
on
- B és el camp
- r és el vector des de la posició del dipol fins a la posició on es mesura el camp.
- r és el valor absolut de r (la distància des del dipol).
- r̂ = rr és el vector unitari paral·lel a r;
- m és el moment dipolar (vector).
- μ0 és la permeabilitat de l'espai lliure.
Aquest és exactament el camp d'un dipol puntual, exactament el terme dipol en l'expansió multipolar d'un camp arbitrari, i aproximadament el camp de qualsevol configuració semblant a un dipol a grans distàncies.
Potencial vectorial magnètic
[modifica]El potencial vectorial A d'un dipol magnètic és
amb les mateixes definicions anteriors.
Camp d'un dipol elèctric
[modifica]El potencial electroestàtic a la posició r degut a un dipol elèctric a l'origen ve donat per:
on p és el (vector) moment dipolar i є0 és la permitivitat del buit.
Aquest terme apareix com el segon terme en el desenvolupament multipolar d'un potencial electroestàtic arbitrari Φ(r). Si la font de Φ(r) és un dipol, com s'assumeix aquí, aquest terme és l'únic terme que no s'esvaeix en el desenvolupament multipolar multipolar de Φ(r). El camp elèctric d'un dipol es pot trobar a partir del gradient d'aquest potencial:
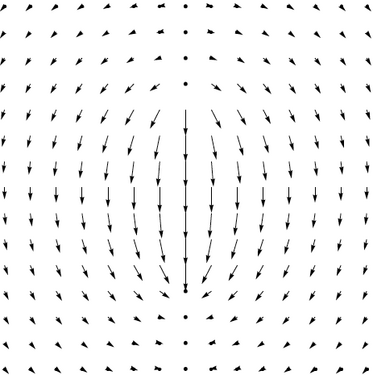
Això és de la mateixa forma de l'expressió per al camp magnètic d'un dipol magnètic puntual, ignorant la funció delta. Però en un dipol elèctric real, les càrregues estan físicament separades i el camp elèctric divergeix o convergeix a les càrregues puntuals. Això és diferent del camp magnètic d'un dipol magnètic real que és continu a tot arreu. La funció delta representa el camp fort que apunta en la direcció oposada entre les càrregues puntuals, que sovint s'omet, ja que rarament s'interessa el camp a la posició del dipol. Per a més discussions sobre el camp intern dels dipols, vegeu [Griffiths 1999] i [Jackson 1999, p. 148-150] o camp magnètic intern d'un dipol.
Parell de forces d'un dipol
[modifica]Si es col·loca un dipol en un camp elèctric () uniforme, dues càrregues (+ Q i - Q ), separades una distància 2 a , experimenten forces d'igual magnitud i de sentit oposat i , en conseqüència, la força neta és zero i no hi ha acceleració lineal (vegeu figura (a)) però hi ha un parell de forces net respecte a l'eix que passa per O la magnitud aquesta donada per:
- .
Tenint en compte que i , s'obté:
Així, un dipol elèctric submergit en un camp elèctric extern , experimenta un moment que tendeix a alinear-lo amb el camp:
Els vectors respectius es mostren a la figura (b).
-
(Fig. a) Un dipol elèctric en un camp extern uniforme.
(Fig. b) Una vista en perspectiva per visualitzar el moment produït -
Camp elèctric a causa d'un dipol
Es defineix el moment dipolar elèctric com una magnitud vectorial amb mòdul igual al producte de la càrrega q per la distància que les separa d, l'adreça és la recta que les uneix, i el sentit va de la càrrega negativa a la positiva:
Per valors prou baixos del mòdul del camp elèctric extern, pot provar que el moment dipolar és aproximadament proporcional a aquell. En efecte:
Sent la polaritzabilitat electrònica.
S'ha de fer treball (positiu o negatiu) mitjançant un agent extern per canviar l'orientació del dipol al camp. Aquest treball queda emmagatzemat com a energia potencial U dins el sistema format pel dipol i el dispositiu utilitzat per establir el camp extern.
Si a la figura (a) té el valor inicial , el treball requerit per fer girar el dipol, està donat per:
Tenint en compte la igualtat (1):
Com només interessen els canvis d'energia potencial, es tria l'orientació de referència d'un valor convenient, en aquest cas 90°. Així s'obté:
qual cosa es pot expressar en forma vectorial:
L'energia d'un dipol magnètic és similar
- .
Radiació dipolar
[modifica]A més dels dipols en electroestàtica, també és habitual considerar un dipol elèctric o magnètic que oscil·la en el temps. És una extensió, o un pas més físic, de la radiació d'ones esfèriques.
-
Mòdul del vector de Poynting per a un dipol elèctric oscil·lant (solució exacta). Les dues càrregues es mostren com dos petits punts negres
-
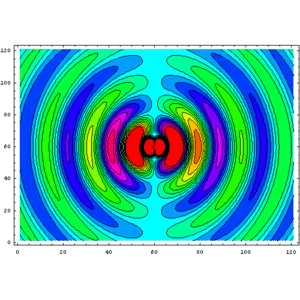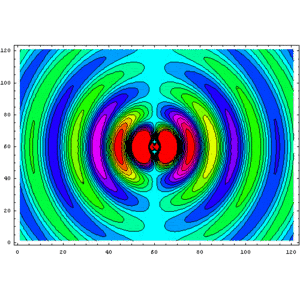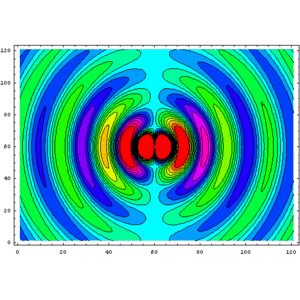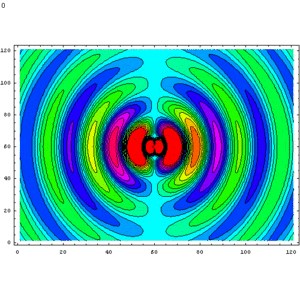
Evolució del camp magnètic d'un dipol elèctric oscil·lant. Les línies de camp, que són anells horitzontals al voltant de l'eix del dipol orientat verticalment, creuen perpendicularment el pla xy de la imatge. El component z del camp es mostra com un diagrama de contorn de color. El cian és de magnitud zero, el verd-groc-vermell i el blau-rosa-vermell augmenten les forces en direccions oposades
En particular, considerem un dipol elèctric oscil·lant harmònicament, amb freqüència angular ω i un moment dipolar p0 al llarg de la direcció ẑ de la forma
Al buit, el camp exacte produït per aquest dipol oscil·lant es pot derivar mitjançant la formulació de potencial retardat com:
Per a rωc ≫ 1, el camp llunyà pren la forma més simple d'una ona «esfèrica» radiant, però amb una dependència angular incrustada en el producte vectorial.[7]
La mitjana del vector de Poynting en el temps
no es distribueix isotròpicament, sinó que es concentra al voltant de les direccions perpendiculars al moment dipolar, com a resultat de les ones elèctriques i magnètiques no esfèriques. De fet, la funció harmònica esfèrica (sin θ) responsable d'aquesta distribució angular toroidal és precisament l'ona l = 1 «p».
La potència mitjana de temps total radiada pel camp es pot derivar del vector de Poynting com
Observem que la dependència de la potència de la quarta potència de la freqüència de la radiació està d'acord amb la dispersió de Rayleigh i els efectes subjacents per què el cel consisteix principalment en un color blau.
Un dipol polaritzat circular es descriu com una superposició de dos dipols lineals.
Notes
[modifica]- ↑ La colatitud magnètica és 0 al llarg de l'eix del dipol i 90° en el pla perpendicular al seu eix.
Referències
[modifica]- ↑ «Dipole, n.». A: Oxford English Dictionary (en anglès). Oxford University Press, 1989.
- ↑ Brau, 2004.
- ↑ Griffiths, 1999.
- ↑ Griffiths, 1994.
- ↑ Weast, 1984.
- ↑ «The Electric Dipole Moment Vector -- Direction, Magnitude, Meaning, et cetera» (en anglès).
- ↑ Griffiths, 1999, p. 447.
Bibliografia
[modifica]- Brau, Charles A. Modern Problems in Classical Electrodynamics (en anglès). Oxford University Press, 2004. ISBN 0-19-514665-4.
- Griffiths, David J. Introduction to Quantum Mechanics. Prentice Hall, 1994. ISBN 978-0-13-124405-4.
- Griffiths, David J. Introduction to Electrodynamics (en anglès). Prentice Hall, 1999. ISBN 0-13-805326-X.
- Jackson, John D. Classical Electrodynamics (en anglès). Wiley, 1999. ISBN 978-0-471-30932-1.
- Weast, Robert C. CRC Handbook of Chemistry and Physics (en anglès). CRC Press, 1984. ISBN 0-8493-0465-2.
Enllaços externs
[modifica]- «USGS Geomagnetism Program» (en anglès).
- «Fields of Force» (en anglès). Arxivat de l'original el 2010-12-14. [Consulta: 13 març 2010].
- Wolfram, Stephen. «Electric Dipole Potential» (en anglès). Wolfram Demonstrations Project.
- Krafft, Franz. «Energy Density of a Magnetic Dipole» (en anglès). Wolfram Demonstrations Project.















































![{\displaystyle U=\int _{{\theta }_{0}}^{\theta }PE\sin \theta d\theta =PE\int _{{\theta }_{0}}^{\theta }\sin \theta d\theta =-PE[\cos \theta -\cos {\theta }_{0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/72edf0b25241614c99eced20bb58db6a48d9a56f)





![{\displaystyle {\begin{aligned}\mathbf {E} &={\frac {1}{4\pi \varepsilon _{0}}}\left\{{\frac {\omega ^{2}}{c^{2}r}}\left({\hat {\mathbf {r} }}\times \mathbf {p} \right)\times {\hat {\mathbf {r} }}+\left({\frac {1}{r^{3}}}-{\frac {i\omega }{cr^{2}}}\right)\left(3{\hat {\mathbf {r} }}\left[{\hat {\mathbf {r} }}\cdot \mathbf {p} \right]-\mathbf {p} \right)\right\}e^{\frac {i\omega r}{c}}e^{-i\omega t}\\\mathbf {B} &={\frac {\omega ^{2}}{4\pi \varepsilon _{0}c^{3}}}({\hat {\mathbf {r} }}\times \mathbf {p} )\left(1-{\frac {c}{i\omega r}}\right){\frac {e^{i\omega r/c}}{r}}e^{-i\omega t}.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a84ead8e373689b51cea6ced6348616d2201bd6)


