Dibromometà
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 171,852324264 Da |
| Trobat en el tàxon | |
| Rol | mutagen |
| Estructura química | |
| Fórmula química | CH₂Br₂ |
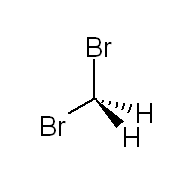 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Moment dipolar elèctric | 1,43 D |
| Punt de fusió | −53 ℃ −52,55 ℃ |
| Punt d'ebullició | 97 ℃ (a 101,325 kPa) |
| Moment dipolar elèctric | 1,43 D |
| Coeficient de repartiment aigua/octanol | 2,3 |
| Perill | |
| Potencial d'escalfament global | 1 |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El dibromometà és un halometà amb la fórmula . És insoluble en aigua, però molt soluble en dissolvents orgànics i té major densitat que l'aigua. És un líquid incolor amb una olor agradable. És un membre de la classe dels bromometans que són metans substituïts per dos àtoms de brom.
Estat natural
[modifica]Es produeix de manera natural per les algues marines que l'alliberen als oceans. Deixar-lo al sòl produeix la seva evaporació i filtració a terra. Posar-lo en aigua causa la seva desaparició per volatilització amb una mitjana de vida de 5,2 hores. No té cap efecte significant a la degradació biològica. A l'atmosfera es perd per la reacció amb els radicals d'hidroxils creats fotoquímicament. La durada estipulada d'aquesta reacció és d'uns 213 dies.
Preparació
[modifica]El dibromometà és preparat comercialment amb diclorometà i bromoclorometà:
6 CH₂Cl₂ + 3 Br₂ + 2 Al → 6 CH₂BrCl + 2 AlCl₃
CH₂Cl₂ + HBr → CH₂BrCl + HCl
Aquest procés requereix triclorur d'alumini com a catalitzador. El producte del bromoclorometà de qualsevol de les dues reaccions pot reaccionar d'una manera similar:
6 CH₂BrCl + 3 Br₂ + 2 Al → 6 CH₂Br₂ + 2 AlCl₃
CH₂BrCl + HBr → CH₂Br₂ + HCl
Al laboratori, es prepara des de bromoform utilitzant arsènic sòdic i hidròxid de sodi:
CHBr₃ + Na₃AsO₃ + NaOH → CH₂Br₂ + Na₃AsO4 + NaBr
Una altra manera de preparar-ho és amb diiodometà i brom.
Usos
[modifica]El dibromometà s'empra com a dissolvent, fluid de mesura, i a la síntesi orgànica (normalment com a H-NMR international standard). És útil per a tornar els catecols als seus derivats metilendiòxids. Té un paper com un metabòlit marí i un metabòlit d'algues. És un membre dels bromometani i un bromohidrocarbur.
Referències
[modifica]|
|
Aquest article té bibliografia, però no se sap quina referència verifica cada part. Podeu millorar aquest article assignant cadascuna d'aquestes obres a frases o paràgrafs concrets. |

