Equació química
Una equació química és la representació dels canvis que es produeixen a una reacció química utilitzant simbologia pròpia de la química.[1]
En una reacció química els materials de partida es denominen reactius. Les substàncies formades a conseqüència de les reaccions es denominen productes.[2] Per tant, una reacció química es pot resumir de la manera següent:
R1 + R2 → P1 + P2
Els químics parlen també de reactius gairebé com sinònim de reactiu: un reactiu és una substància que pot reaccionar amb altres substàncies i per aquest motiu està disponible habitualment als laboratoris químics i a la natura. L'àcid clorhídric constitueix un exemple de reactiu. Tanmateix, un reactant és una substància que pren part en una reacció específica.
En 1615 Jean Beguin va publicar Tyrocinium Chymicum, un dels primers treballs escrits sobre química, on va escriure la primera equació química de la història.[3][4]
Requisits per a una equació química
[modifica]Una equació química ha de satisfer una sèrie de lleis, de manera simultània:[5][6]
- Complir amb la llei de conservació de la matèria.
- Complir amb la llei de conservació de la càrrega.
- Complir amb la llei de conservació de l'energia.
Noteu que no s'especifica que el procés en qüestió passi realment a la natura o al laboratori. Per exemple, l'equació química global de la formació de l'aigua gasosa, a partir de les substàncies d'hidrogen i d'oxigen (presentada posteriorment), en realitat ocorre en una sèrie de passos intermedis (anomenats mecanisme de reacció), corresponent a la successió de reaccions químiques que ocorren per produir el producte donat.
Estructura
[modifica]Una equació química (vegeu un exemple més avall) consisteix en una llista de reactius (les substàncies de partida) a la banda esquerra, un símbol de fletxa, i una llista de productes (substàncies formades en la reacció química) al costat dret. Cada substància s'especifica mitjançant la fórmula química, opcionalment precedida d'un nombre anomenat coeficient estequiomètric.[a] El coeficient especifica quantes entitats (per exemple, molècules) d'aquesta substància intervenen en la reacció sobre una base molecular. Si no s'escriu explícitament, el coeficient és igual a 1. Les substàncies múltiples a qualsevol costat de l'equació estan separades entre si per un signe més.
Com a exemple, l'equació per a la reacció de àcid clorhídric amb sodi es pot denotar:
Atès que les fórmules són força simples, aquesta equació podria llegir-se com dos H-C-L més dos N-A rendiments[b] dos N-A-C-L i H dos. Alternativament, i en general per a les equacions que impliquen productes químics complexos, les fórmules químiques es llegeixen utilitzant nomenclatura IUPAC, cosa que podria verbalitzar aquesta equació com «dues molècules d'àcid clorhídric i dos àtoms de sodi reaccionen per formar dues unitats de fórmula de clorur de sodi i una molècula de gas d'hidrogen».
Representació simbòlica
[modifica]Un exemple simple de reacció és la formació d'aigua a partir d'hidrogen i oxigen. Aquesta reacció pot simbolitzar-se la manera següent:
- hidrogen + oxigen → aigua
Aquesta reacció constitueix un exemple de síntesi química. Una 'síntesi' és una reacció en la qual es forma una substància utilitzant materials de partida més simples (en aquest cas, elements). Altres tipus de reacció és una descomposició química, en què una substància es descompon en substàncies més simples. Una reacció d'aquest tipus es produeix quan s'escalfa la calcària fins a 800 graus. (En una reacció de descomposició una substància es transforma en una substància menys complexes, que fins i tot poden ser complexes. La reacció inversa a la descomposició és síntesi, en la que es forma una substància utilitzant materials de partida més simples).
Aquesta descomposició tèrmica (és a dir, provocada per la temperatura) és típica de la majoria dels carbonats. Els químics descriuen una reacció mitjançant la seva equació química. Es tracta d'una expressió que indica les fórmules químiques reactants i dels productes. Com es veurà a continuació la forma d'escriure les reaccions anteriors és :
Observin que es distingeix entre una 'reacció química', que és el canvi químic real, i una 'equació química', que és la representació del canvi utilitzant símbols químics. El símbol Δ (la lletra grega delta) significa que reacció es produeix a una temperatura elevada (en aquest cas, a aproximadament 800). Els nombres que apareixen multiplicant les fórmules químiques, es denominen coeficients estequiomètrics de les substàncies. Aquest nom curiós deriva de les paraules gregues que signifiquen 'element ‘ i ' mesura '. Aquests coeficients estan inclosos en les equacions per assegurar que estigui present el mateix nombre d'àtoms de cada element en els reactants i en els productes : una reacció química no es pot crear ni destruir àtoms. A la síntesi de l'aigua, per exemple, hi ha quatre àtoms d'hidrogen a l'esquerra de la fletxa (entre els reactants) i quatre àtoms d'hidrogen a la dreta de la fletxa (entre els productes); així mateix hi ha dues àtoms d'oxigen a cada costat de la fletxa Per tant, una equació química té en compte la idea de Dalton que un canvi químic és una reordenació d'àtoms entre diferents substàncies (una reacció química és una reordenació dels àtoms presents als reactants formant-se agrupacions d'àtoms característiques dels productes); resumeix les identitats de les substàncies que participen en la reacció (informació qualitativa), i constata el fet que es conserva el nombre d'àtoms de cada tipus (informació quantitativa). Una equació química presenta, més informació en cas d'incloure l'estat físic (sòlid, líquid o gasós) de cada una de les substàncies que prenen part en la reacció. Aquesta informació addicional es pot expressar col·locant els següents símbols darrere de cada substància:
(s) per als sòlids (l) per als líquids (g) per als gasos
D'altra banda (aq) s'utilitza per indicar que una substància és a solució aquosa (dissolta en aigua). Les versions completes de les equacions donades amb anterioritat són:
- 2H₂ (g) + O₂ (g) → 2H₂O (l)
Per la síntesi de l'aigua líquida (que de fet és diferent del vapor d'aigua del gel), i per a la reacció de descomposició.
- CaCO₃ (s) → CaO (s) + CO₂ (g)
Com igualar equacions
[modifica]Una equació química està igualada quan apareix el mateix nombre d'àtoms de cada un dels elements a tots dos costats de la fletxa (les equacions explicades fins ara estaven igualades). Les reaccions senzilles poden d'igualar gairebé de manera immediata, però altres equacions requereixen més esforç per ser igualades.
Per formular i igualar una equació química es comença escrivint una equació sense coeficients estequiomètrics que resumeix la informació qualitativa sobre la reacció, per exemple:
H₂ + O₂ → H₂O Hidrogen + oxigen formen aigua
Després s'escolliran els coeficients perquè l'equació quedi igualada:
2 x (H₂) + O₂ → 2 x (H₂O)
No s'ha d'igualar una equació canviant els subíndex de les fórmules químiques. Això indicaria que en la reacció hi prenen part substàncies diferents. Si canviem de H₂O a H₂O₂ i escrivim:
H₂ + O₂ → H₂O₂
s'obté certament una equació igualada. Tanmateix, aquesta equació igualada expressa una reacció diferent : la formació del peròxid d'hidrogen a partir dels seus elements. En cas d'escriure:
2H + O → H₂O
s'obté així mateix una equació igualada, però ara l'equació expressa la reacció entre els àtoms d'hidrogen i oxigen, però no entre les molècules que constitueixen els materials de partida reals.
En molts casos, quan es multiplica una fórmula per un coeficient per igualar un element donat, deixa d'estar igualat un altre element. Per tant, convé reduir l'esforç necessari per igualar una equació treballant d'una manera sistemàtica. Un procediment directe i eficaç consisteix a igualar primer l'element que és present menys vegades en l'equació i després anar treballant amb els altres elements fins a ocupar-se de l'element que és present més vegades. Es pot il·lustrar aquest mètode igualant l'equació d'una combustió. Es tracta d'una reacció que es produeix quan un element o un compost es crema amb oxigen (una flama de metà desprèn calor a conseqüència de la combustió del metà per donar diòxid de carboni i aigua. La flama és blava perquè la calor generat per la reacció excita les unitats C₂ i CH formades durant la combustió, que desprenen llum acolorida). Quan els compostos orgànics que contenen només carboni, hidrogen i oxigen es cremen amb abundància d'aire, els únics productes obtinguts són diòxid de carboni i aigua. Si el compost orgànic és el metà (CH₄), que forma part del gas natural, l'equació sense coeficients és :
CH₄ + O₂ → CO₂ + H₂O
Com que C i H són presents en dues fórmules i O és present en tres, es comença per C i H. Els àtoms de carboni ja estan igualats. S'igualen els àtoms de H multiplicant per 2 la fórmula H₂ O de manera que hi hagi quatre àtoms de H a cada costat de la fletxa:
CH₄ + O₂ → CO₂ + 2 H₂O
Ara només queda el O per igualar. Com que hi ha quatre àtoms d'oxigen a la dreta, però només dos a l'esquerra, la fórmula O₂ ha multiplicar per 2. El resultat és:
CH₄ + 2O₂ → CO₂ + 2 H₂O
Ara l'equació està igualada, cosa que es pot comprovar explicant el nombre d'àtoms de cada un dels elements situats a tots dos costats de la fletxa. En aquest punt ha d'especificar-se l'estat físic de les substàncies. Si un dels productes de la reacció és vapor d'aigua, llavors s'escriu:
CH₄ (g) + 2O₂ (g) → CO₂ (g) + 2H₂O (g)
En alguns casos, la igualació condueix a coeficients fraccionaris, com en l'equació de la combustió del butà (C₄ H₁₀):
C₄H₁₀ (g) + 13/2 O₂(g) → 4CO₂(g) + 5H₂O (g)
Com que és molt més convenient treballar amb nombres sencers, normalment és raonable (però no absolutament necessari) eliminar les fraccions multiplicant l'equació fraccionària per un factor numèric. En aquest cas es pot eliminar la fracció 13/2 multiplicant-la per 2, i llavors s'obté:
2C₄ H₁₀ (g) + 13O₂ (g) → 8CO₂ (g) + 10H₂O (g)
Equilibri d'equacions químiques
[modifica]Atès que en una reacció química no es produeix cap reacció nuclear, els elements químics travessen la reacció sense canvis. Així, cada costat de l'equació química ha de representar el mateix nombre d'àtoms de qualsevol element particular (o nucleid, si es tenen en compte diferents isòtops). El mateix passa amb la càrrega elèctrica total, tal com estableix la llei de conservació de la càrrega. Es diu que una equació que compleix aquests requisits està equilibrada.
Una equació química s'equilibra assignant valors adequats als coeficients estequiomètrics. Les equacions senzilles es poden equilibrar per inspecció, és a dir, per assaig i error. Una altra tècnica consisteix a resoldre un sistema d'equacions lineals.
Les equacions equilibrades solen escriure's amb els coeficients de número-natural més petits. No obstant això, de vegades pot ser avantatjós acceptar un coeficient fraccionari, si simplifica els altres coeficients. Així, l'exemple introductori es pot reescriure com
En algunes circumstàncies, els coeficients fraccionaris són fins i tot inevitables. Per exemple, la reacció corresponent a l'entalpia estàndard de formació s'ha d'escriure de manera que es formi una molècula d'un únic producte. Això requerirà sovint que alguns coeficients dels reactants siguin fraccionaris, com és el cas de la formació de fluorur de liti:
Mètode d'inspecció
[modifica]
4 + 2 O
2 → CO
2 + 2 H
2O, cal anteposar un coeficient 2 al gas oxigen al costat dels reactants i a l'aigua al costat dels productes perquè, segons la llei de conservació de la massa, la quantitat de cada element no variï durant la reacció.
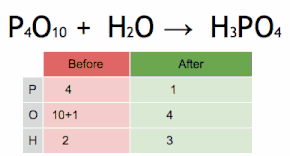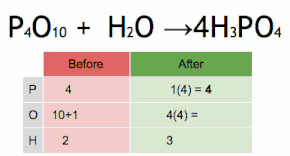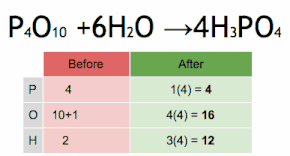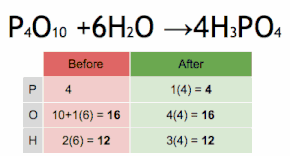
Aquesta equació química s'equilibra multiplicant primer H3PO4 per 4 per igualar el nombre d'àtoms de P, i després multiplicant a H2O per sis per equilibrar el nombre dàtoms de H i O.
El mètode d'inspecció es pot resumir fixant el coeficient estequiomètric de la substància més complexa en 1 i assignant valors a altres coeficients pas a pas, de manera que tots dos costats de l'equació acabin amb el mateix nombre d'àtoms per a cada element. Si durant aquest procés sorgeix algun coeficient fraccionari, la presència de fraccions es pot eliminar (en qualsevol moment) multiplicant tots els coeficients pel seu mínim comú denominador.
- Exemple
Balanç de l'equació química per a la combustió total de metà
es realitza mitjançant els següents passos:
- Un coeficient d'un es col·loca a la fórmula més complexa (CH4):
- El costat esquerre té un àtom de carboni, per la qual cosa una molècula de CO2 ho equilibra. El costat esquerre també tens quatre àtoms d'hidrogen, la qual cosa s'equilibra amb dues molècules d'H2O:
- L'equilibri de quatre àtoms d'oxigen del costat dret mitjançant dues molècules d'O2 condueix a l'equació
- S'ometen els coeficients iguals a 1, ja que no cal especificar-los explícitament:
- És convenient comprovar que l'equació final està equilibrada, és a dir, que per a cada element hi ha el mateix nombre d'àtoms a la banda esquerra i al dret: 1 carboni, 4 hidrogen i 4 oxigen.
Sistema d'equacions lineals
[modifica]Per a cada element químic (o nucleït o resta no modificat o càrrega) i, el requeriment de la seva conservació es pot expressar mitjançant l'equació matemàtica:
on
- aij és el nombre d'àtoms de l'element i en una molècula de substància j (segons la fórmula a l'equació química), i
- sj és el coeficient estequiomètric de la substància j.
Els resultats són un sistema d'equacions lineals homogènies, les quals es resolen directament utilitzant mètodes matemàtics. Aquest sistema té la solució trivial de tots zeros, que no és d'interès, però si és que hi ha solucions addicionals, n'hi haurà un nombre infinit. Qualsevol solució no trivial equilibrarà l'equació química. Una solució preferida és una amb un nombre enter, majorment positiu.[c]
Exemple
[modifica]Assignem variables als coeficients estequiomètrics de l'equació química de l'apartat anterior i escrivim les equacions lineals corresponents:
Totes les solucions a aquest sistema d'equacions lineals són de la següent forma, on r és qualsevol número real:
L'elecció de r = 1 produeix la solució preferida,
que correspon a l'equació química equilibrada:
Catàlisi i altres condicions
[modifica]
Si la reacció requereix energia, s'indica el mateix damunt de la fletxa. Una lletra grega delta (Δ) majúscula a un triangle (△)[d] es col·loca a la fletxa de la reacció per indicar que s'afegeix energia en forma de calor a la reacció. L'expressió hν[e] és utilitzada com a símbol per a l'agregat d'energia en forma de llum. S'utilitzen altres símbols per a altres tipus d'energia o radiació específics.
De la mateixa manera, si una reacció requereix un determinat mitjà amb certes característiques específiques, aleshores el nom de l'àcid o la base que s'utilitza com a mitjà es pot col·locar damunt de la fletxa. Si no es requereix un àcid o una base específics, una altra manera de denotar l'ús d'un medi àcid o bàsic és escriure H+ o OH− (o encara àcid o base) a dalt de la fletxa. Les condicions específiques de temperatura i pressió, així com la presència de catalitzadors, es poden indicar de la mateixa manera.
Notes
[modifica]- ↑ No confondre amb una quantitat relacionada anomenada número estequiomètric.
- ↑ Que no s'ha de confondre amb rendiment (química), una quantificació de l'eficiència de síntesi.
- ↑ Un coeficient estequiomètric negatiu significa una substància col·locada al costat incorrecte de l'equació química de coeficients estequiomètrics sj amb màxim comú divisor igual a un.
- ↑ El triangle (△) era originalment el símbol químic del foc.
- ↑ Aquesta expressió prové de l'equació de Planck per a l'energia del fotó, E = hν. La lletra grega ν ("nu") que de vegades és reemplaçada per error per la lletra llatina v ("vee").
Referències
[modifica]- ↑ «Equació química». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ IUPAC, Compendium of Chemical Terminology, 2a ed. ("The Gold Book") (1997). Versió corregida en línia: (2006–) "chemical reaction equation" (en anglès).
- ↑ Crosland, M. P. (1959). «The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black.» Annals of Science, Vol 16, No. 2, Junio.
- ↑ Crosland, M.P. «The use of diagrams as chemical ‘equations’ in the lecture notes of William Cullen and Joseph Black» (en anglès). Annals of Science, 15, 2, 6-1959, pàg. 75–90. Arxivat de l'original el 2020-12-15. DOI: 10.1080/00033795900200088. ISSN: 0003-3790 [Consulta: 30 novembre 2024].
- ↑ R, Petrucci. et al. (2011). Química General (10° ed). Madrid: PEARSON EDUCATION, S.A.. pp.35,255
- ↑ F, Carey. (2006). Química orgánica (6ta ed). México: The McGraw-Hill Companies, Inc. p.34
Bibliografia
[modifica]- Seese, William S. & G. William Daub: Química. A Google Books













