Fluorobenzè
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 96,038 Da |
| Estructura química | |
| Fórmula química | C₆H₅F |
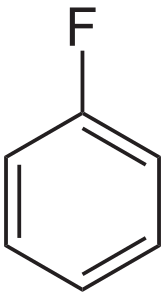 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Velocitat del so | 1.183 m/s (20 ℃, líquid) |
| Moment dipolar elèctric | 1,6 D |
| Punt de fusió | −42 ℃ −42,21 ℃ |
| Punt d'ebullició | 84,73 ℃ (a 101,325 kPa) |
| Moment dipolar elèctric | 1,6 D |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El fluorobenzè és un compost orgànic, un fluorur d'aril i el més simple dels fluorobenzens, que té per fórmula empírica C6H5F, sovint abreujat PhF. És un líquid incolor, precursor de molts compostos fluorofenílics.

Preparació
[modifica]El fluorobenzè no és un compost químic que hom el trobi a la natura. És un compost artificial que fou sintetitzat per primera vegada el 1886 en un treball de recerca del químic prussià O. Wallach (1847-1931), Premi Nobel de Química el 1910, a la Universitat de Bonn.[1] En una primera etapa, Wallach convertí clorur de fenildiazoni [PhN2]Cl en el triazè PhN=NN(CH2)5 mitjançant la reacció amb piperidina (CH2)5NH:
A continuació, dissocià el triazè emprant àcid fluorhídric HF i obtingué el fluorobenzè, segons la reacció:
A escala de laboratori, el fluorobenzè es prepara mitjançant la reacció de Balz-Schiemann de descomposició tèrmica del tetrafluoroborat de benzendiazoni PhN2BF4, proposada per Günther Balz i Günther Schiemann (1899-1967) el 1927:[2]

L'etapa final és la descomposició:
Segons aquest procediment, el sòlid [PhN2]BF4 s'escalfa amb una flama per iniciar una reacció exotèrmica, que també produeix trifluorur de bor i nitrogen gasós. Els productes PhF i BF3 se separen fàcilment a causa dels seus diferents punts d'ebullició.[3]
La síntesi tècnica és per la reacció del ciclopentadiè amb el difluorocarbè. El ciclopropà format inicialment experimenta una expansió de l'anell i la posterior eliminació del fluorur d'hidrogen.

Reaccions
[modifica]El fluorobenzè es comporta de manera bastant diferent de la d'altres derivats d'halobenzè (clorobenzè, bromobenzè i iodobenzè) a causa de les propietats de donador π del fluor. Per exemple, en les reaccions de substitució electròfila aromàtica la posició para, l'oposada a l'anell aromàtic a la del fluor, està més activada que les posicions orto i meta cap als electròfils. Per aquest motiu, es pot convertir en 1-bromo-4-fluorobenzè amb una eficiència relativament alta.[4]
Propietats com a dissolvent
[modifica]El fluorobenzè és un dissolvent útil per a espècies altament reactives. El seu punt de fusió és de –44 °C, inferior al del benzè. En canvi, els punts d'ebullició del fluorobenzè i del benzè són molt similars, difereixen només en 4 °C. És considerablement més polar que el benzè, amb una constant dielèctrica de 5,42 en comparació amb 2,28 del benzè a 298 K. El fluorobenzè és un compost relativament inert que reflecteix la força de l'enllaç C–F.[5]
Encara que normalment es considera un dissolvent no coordinant, s'ha cristal·litzat un complex metàl·lic de fluorobenzè.[6]
Toxicitat
[modifica]Irrita la pell, els ulls i les mucoses. L'exposició repetida de la pell pot causar dermatitis a causa de l'acció desgreixant. La inhalació crònica de vapors o boira pot provocar danys als pulmons, el fetge i els ronyons. L'exposició aguda al vapor pot causar símptomes que van des de la tos fins a l'anestèsia transitòria i la depressió del sistema nerviós central.[5]
Referències
[modifica]- ↑ Wallach, O. «Ueber einen Weg zur leichten Gewinnung organischer Fluorverbindungen» (en anglès). Justus Liebigs Annalen der Chemie, 235, 3, 1-1886, pàg. 255–271. DOI: 10.1002/jlac.18862350303. ISSN: 0075-4617.
- ↑ Balz, Günther; Schiemann, Günther «Über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung». Berichte der deutschen chemischen Gesellschaft (A and B Series), 60, 5, 11-05-1927, pàg. 1186–1190. DOI: 10.1002/cber.19270600539. ISSN: 0365-9488.
- ↑ Wang, Zerong. Comprehensive Organic Name Reactions and Reagents (en anglès). Wiley, 2010-09-15. DOI 10.1002/9780470638859.conrr044. ISBN 978-0-471-70450-8.
- ↑ Rosenthal, Joel; Schuster, David I. «The Anomalous Reactivity of Fluorobenzene in Electrophilic Aromatic Substitution and Related Phenomena» (en anglès). Journal of Chemical Education, 80, 6, 6-2003, pàg. 679. DOI: 10.1021/ed080p679. ISSN: 0021-9584.
- ↑ 5,0 5,1 PubChem. «Fluorobenzene» (en anglès). [Consulta: 4 juliol 2024].
- ↑ Perutz, R.N.; Braun, T. Transition Metal-mediated C–F Bond Activation (en anglès). Elsevier, 2007, p. 725–758. DOI 10.1016/b0-08-045047-4/00028-5. ISBN 978-0-08-045047-6.

![{\displaystyle {\ce {[PhN2]Cl + 2 (CH2)5NH -> PhN=NN(CH2)5 + [(CH2)5NH2]Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4de05be9b5652642e5c37b10a532e50029819442)
![{\displaystyle {\ce {PhN=NN(CH2)5 + 2 HF -> PhF + N2 + [(CH2)5NH2]F}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/84dd5768aa16613222770a3f3dc1abaeba36c010)




