Aldehid
| Substància química | classe estructural d'entitats químiques |
|---|---|
| Estructura química | |
 | |
| SMILES canònic | |
Un aldehid és un compost orgànic que conté un grup carbonil terminal, o sigui que el grup carbonil està enllaçat a un àtom d'hidrogen i a un altre àtom de carboni. La fórmula general que representa els compostos que presenten aquest grup funcional és R-CHO.[1]
El grup aldehid és electròfil a causa de la deficiència electrònica de l'àtom de carboni.
Com en els altres grups funcionals que presenten un grup carbonil, els àtoms d'hidrogen situats en posició α són relativament àcids (en els aldehids pKa ~17) a causa de l'estabilització per ressonància de la base conjugada.
Nomenclatura
[modifica]
Segons les normes de la IUPAC,[2][3] aquests compostos s'anomenen substituint la terminació -à de l'alcà corresponent per la terminació -al.[4] A banda d'això, pels següents compostos també es permet la utilització de la nomenclatura trivial:
- HCHO es pot anomenar formaldehid
- CH₃CHO es pot anomenar acetaldehid
- C₆H₅CHO es pot anomenar benzaldehid
En el cas que la molècula presenti un altre grup funcional prioritari (un grup àcid carboxílic), s'utilitza el prefix oxo- per designar el grup aldehid.
| Nombre de carbonis | Nomenclatura IUPAC | Nomenclatura trivial | Fórmula | P.E.°C |
|---|---|---|---|---|
| 1 | Metanal | Formaldehid | HCHO | -21 |
| 2 | Etanal | Acetaldehid | CH 3CHO |
20,2 |
| 3 | Propanal | Propionaldehid Propilaldehid |
C 2H 5CHO |
48,8 |
| 4 | Butanal | n-Butiraldehid | C 3H 7CHO |
75,7 |
| 5 | Pentanal | n-Valeraldehid Amilaldehid n-Pentaldehid |
C 4H 9CHO |
103 |
| 6 | Hexanal | Capronaldehid n-Hexaldehid |
C 5H 11CHO |
100.2 |
| 7 | Heptanal | Enantaldehid Heptilaldehid n-Heptaldehid |
C 6H 13CHO |
48.3 |
| 8 | Octanal | Caprilaldehid n-Octilaldehid |
C 7H 15CHO |
Entre 55.381 i 55.389 (Aproximadament) |
| 9 | Nonanal | Pelargonaldehid n-Nonilaldehid |
C 8H 17CHO |
62.47 |
| 10 | Decanal | Caprinaldehid n-Decilaldehid |
C 9H 19CHO |
10.2 |
Per anomenar aldehids com a substituents

Si sou substituent d'un substituent

Els aldehids són funcions terminals, és a dir, que van al final de les cadenes.
Nomenclatura de cicles
| Localitzador | Cadena Carbonada Principal | Carbaldehid | Exemple |
|---|---|---|---|
| 1(es pot ometre) | Benzè | Carbaldehid | 
|
| 2,3 | Naftalè | DiCarbaldehid | 
|
Si el cicle presenta altres substituents menys importants se'ls noms primers, així:
Per a més detalls consulteu Nomenclatura d'aldehids
Estructura i enllaç
[modifica]Els aldehids presenten un carboni central que està unit per un doble enllaç a l'oxigen i un enllaç senzill a l'hidrogen i un enllaç senzill a un tercer substituent, que és el carboni o, en el cas del formaldehid, l'hidrogen. El carboni central sol descriure's com sp2-hibridat. El grup aldehid és una cosa polar. La longitud d'enllaç C=O és d'uns 120-122 picòmetres.[5]
Propietats
[modifica]Propietats Físiques
[modifica]- La doble unió del grup carbonil és perquè el grup carbonil està polaritzat[6] a causa del fenomen de ressonància.
- Els aldehids amb hidrogen sobre un carboni sp³ en posició alfa al grup carbonil presenten isomeria tautomèrica. Els aldehids s'obtenen de la deshidratació d'un alcohol primari amb permanganat de potassi, la reacció ha de ser feble, les cetones també s'obtenen de la deshidratació d'un alcohol, però s'obtenen d'un alcohol secundari i igualment són deshidratats amb permanganat de potassi i s'obtenen amb una reacció feble, si la reacció de l'alcohol és forta, el resultat serà un àcid carboxílic respectivament.
Els aldehids tenen propietats diverses que depenen de la resta de la molècula. Els aldehids més petits són més solubles en aigua, formaldehid i acetaldehid completament. Els aldehids volàtils tenen olors penetrants.
Els aldehids es poden identificar per mètodes espectroscòpics. Mitjançant espectroscòpia IR, mostren una banda CO forta a prop de 1.700 cm-1. En els seus espectres de 1H NMR, el centre d'hidrogen del formol absorbeix prop de δH 9,5 a 10, que és una part distintiva de l'espectre. Aquest senyal mostra l'acoblament característic a qualsevol protó del carboni α amb una petita constant d'acoblament típicament inferior a 3,0 Hz. Els espectres 13C NMR d'aldehids i cetones donen un senyal suprimit (dèbil) però distintiu en C 190 a 205.
Propietats Químiques
[modifica]- Es comporten com reductor, per oxidació l'aldehid dóna àcids amb el mateix nombre d'àtoms de carboni.
- La reacció típica dels aldehids i les cetones és l'addició nucleofílica.
Química
[modifica]Síntesis
[modifica]
Hi ha diversos mètodes per preparar aldehids, però la tecnologia dominant és la hidroformilació:[7]
- Oxidació d'alcohols primaris. Aquest mètode es basa en la reacció d'un alcohol primari amb agents oxidants suaus, com per exemple PCC,[8] PDC,[9] IBX,[10] el periodinà de Dess-Martin (DMP)[11] o l'oxidació de Swern.[12] Agents oxidants més forts com el dicromat o permanganat potàssic portarien a l'oxidació directa fins a àcid carboxílic. Esquemàticament el procés d'oxidació és el següent:[13]
- Ozonòlisi d'alquens.[14] La reacció d'un alquè amb ozó porta a la formació d'un ozònid, un intermedi altament reactiu que reacciona amb espècies reductores per donar un grup aldehid.[15][16]
- Reducció d'èsters. La reducció d'aquests compostos amb agents reductors com el DIBAL-H o el LDBBA són capaços d'aturar-se en l'estadi d'aldehid.[17][18]
- Reducció de clorurs d'àcid utilitzant la reacció de Rosenmund.[19]
- Homologació de cetones amb metoximetilentrifenilfosfina, utilitzant una modificació de la reacció de Wittig.[20]
- Reaccions de formilació. Aquestes reaccions, com la Vilsmeier-Haack,[21] s'utilitzen per introduir grups aldehid.
- Reacció de Nef. La hidròlisi de nitroalcans primaris porta a la formació d'aldehids.[22]
Tautomeria ceto-enol
[modifica]
La tautomeria ceto-enol es refereix a l'equilibri que existeix entre la forma ceto i enol en els aldehids i les cetones.[23] Aquest equilibri està catalitzat per àcids i bases, i generalment es troba desplaçat cap a la forma carbonílica, ja que aquesta és més estable.
Reaccions d'oxidació i reducció
[modifica]
- Els aldehids es poden reduir a alcohols primaris, utilitzant agents reductors com el borhidrur de sodi (NaBH₄) o l'hidrur d'alumini i liti (LiAlH₄).
- Els aldehids es poden oxidar a àcids carboxílics emprant agents oxidants com el permanganat potàssic (KMnO₄) o el dicromat potàssic (K₂Cr₂O₇).
- Al sotmetre un aldehid que no presenta àtoms d'hidrogen en posició α (per exemple el benzaldehid) a un medi fortament bàsic, es dona la reacció de Cannizzaro,[24] en la que l'aldehid desproporciona per donar l'alcohol i l'àcid carboxílic corresponent.
Reaccions d'addició nucleofílica
[modifica]En les reaccions d'addició nucleofílica, un nucleòfil s'addiciona a l'àtom de carboni del grup carbonil per donar un compost en el que aquest àtom de carboni té geometria tetraèdrica. Juntament amb la protonació de l'àtom d'oxigen del grup carbonil (que es pot donar abans o després de l'addició del nucleòfil), aquesta reacció dona un producte en el que l'àtom de carboni del grup carbonil està enllaçat al nucleòfil, a un àtom d'hidrogen i a un grup hidroxil.

En molts casos, l'addició del nucleòfil provoca la pèrdua d'una molècula d'aigua. En aquests casos aquesta reacció s'anomena d'addició-eliminació o reacció de condensació.
Alguns exemples de reaccions d'addició nucleofílica són els següents:
- En les reaccions d'acetalització un alcohol s'addiciona al grup carbonil sota catàlisi àcida o bàsica per formar un hemiacetal. Sota catàlisi àcida, l'hemiacetal pot reaccionar amb una segona molècula d'alcohol per formar l'acetal. Els hemiacetals cíclics, com els de la glucosa solen ser estables. Els acetals són estables, però reverteixen a la forma carbonílica al tractar-los amb àcid.
- Els aldehids poden reaccionar amb aigua per formar hidrats, compostos de l'estil R-C(H)(OH)(OH). Tot i això, aquests compostos només són estables amb la presència de grups fortament electroatraients, com en l'hidrat de cloral. El mecanisme de formació d'aquests compostos és el mateix que en el cas dels acetals.
- L'addició d'amines primàries i secundàries al grup aldehid porta a l'obtenció dels corresponents hemiaminals (R-C(H)(OH)(NR₂)), intermedis que poden eliminar una molècula d'aigua per acabar obtenint imines o ions imini en el cas de les amines secundàries.
- La reacció d'un aldehid amb HCN permet obtenir cianhidrines, compostos de fórmula general R-C(H)(OH)(CN).
- En la reacció de Grignard, un reactiu de Grignard (també anomenat magnesià) s'addiciona al grup aldehid per donar l'alcohol corresponent substituït amb el grup provinent del reactiu de Grignard.
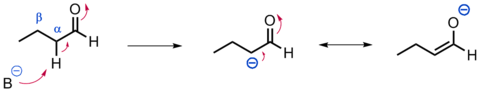
- En les reaccions aldòliques el enolats de cetones, èsters, amides i àcids carboxílics s'addicionen a aldehids per formar compostos β-hidroxicarbonílics (aldols). La deshidratació posterior sota catàlisi àcida o bàsica porta a la formació de compostos α,β-insaturats. La combinació d'aquests dos passos (addició i deshidratació) es coneix com a condensació aldòlica.
- La hidroxilamina (NH₂OH) es pot addicionar al grup carbonil. L'eliminació d'aigua resulta en la formació de l'oxima.
Exemples d'aldehids
[modifica]Usos
[modifica]Els aldehids s'utilitzen principalment per a la fabricació de resines, plàstics, solvents, pintures, perfums, essències.
Els aldehids són presents en nombrosos productes naturals i grans varietats són de la pròpia vida quotidiana. La glucosa per exemple existeix en una forma oberta que presenta un grup aldehid. L'acetaldehid format com a intermedi en la metabolització es creu responsable en gran manera dels símptomes de la ressaca després de la ingesta de begudes alcohòliques.
El formaldehid és un conservant que es troba en algunes composicions de productes cosmètics. No obstant això, aquesta aplicació ha de ser vista amb cautela, ja que en experiments amb animals el compost ha demostrat un poder cancerigen. També s'utilitza en la fabricació de nombrosos compostos químics com la baquelita, la melamina, etc.
Vegeu també
[modifica]Referències
[modifica]- ↑ Diccionario de ciencias. Editorial Complutense.
- ↑ IUPAC. Nomenclature of Organic Chemistry ("Blue Book")
- ↑ «Short summary of IUPAC nomenclature of organic compounds». Arxivat de l'original el 2009-02-26. [Consulta: 18 febrer 2009].
- ↑ Química 2 (SEP). Ediciones Umbral.
- ↑ G. Berthier, J. Serre. «Aspectos generales y teóricos del grupo carbonilo». A: Saul Patai. El grupo carbonilo. 1. John Wiley & Sons, 1966, p. 1-77 (PATAI'S Chemistry of Functional Groups). DOI 10.1002/9780470771051.ch1. ISBN 9780470771051.
- ↑ Fieser, Louis F. Química orgánica fundamental. Reverte.
- ↑ Bertleff, W.; Roeper, M. y Sava, X. (2003) "Carbonylation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim. doi:10.1002/14356007.a05_217.pub2
- ↑ Pyridinium chlorochromate (PCC)
- ↑ Pyridinium dichromate (PDC)
- ↑ IBX, 2-Iodoxybenzoic acid
- ↑ Dess-Martin periodinane, IBX, Triacetoxyperiodinane
- ↑ Swern Oxidation
- ↑ Ratcliffe, R. W. (1988). "Oxidation with the Chromium Trioxide-Pyridine Complex Prepared in situ: 1-Decanal". Org. Synth.; Coll. Vol. 6: 373.
- ↑ Ozonolysis
- ↑ Criegee, R. Angew. Chem. Int. Ed. Engl. 1975, 745-752.doi:10.1002/anie.197507451
- ↑ Geletneky, C.; Berger, S. Eur. J. Org. Chem. 1998, 1625-1627.
- ↑ Zakharkin, L. I.; Khorlina, I. M. Tet. Lett. 1962, 619-620.doi:10.1016/S0040-4039(00)70918-X
- ↑ Kim, M. S.; Choi, Y. M.; An, D. K. Tet. Lett. 2007, 5061-5064.doi:10.1016/j.tetlet.2007.05.091
- ↑ Rosenmund Reduction
- ↑ Levine, S. G. J. Am. Chem. Soc. 1958, 6150-6151.doi:110.1021/ja01555a068
- ↑ Vilsmeier-Haack Reaction
- ↑ Pinnick, H. W. Organic Reactions 1990.doi:10.1002/0471264180.or038.03
- ↑ IUPAC Gold Book - Tautomerism doi:10.1351/goldbook.T06252
- ↑ Cannizzaro Reaction
Bibliografia
[modifica]- PETERSON, W.R. Formulación y Nomenclatura Química Orgánica. 6ta. Barcelona: Eunibar-editorial universitaria de Barcelona, p. 98-101.
- Clayden, J.; Greeves, N.; Warren, S.; Wothers, P., Organic chemistry, Oxford University Press, 2001.
Enllaços externs
[modifica]- Organic Chemistry Animations ChemTube3d (anglès)
- Aldehyde. Encyclopedia Britannica (anglès)
- Organic-chemistry.org (anglès)
- IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book").doi:10.1351/goldbook.A00208

![{\displaystyle {\ce {[O] + CH3(CH2)9OH -> CH3(CH2)8CHO + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fe12103929f870bd0f268e0ff4023984be8707d)