Fulminat de plata
 | |
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 148,903 Da |
| Estructura química | |
| Fórmula química | AgCNO |
| SMILES canònic | |
| Identificador InChI | Model 3D |
El fulminat de plata (AgCNO) és la sal de plata altament explosiva de l'àcid fulmínic.
El fulminat de plata és un explosiu primari, però té un ús limitat com a tal a causa de la seva extrema sensibilitat a l'impacte, la calor, la pressió i l'electricitat. El compost es torna progressivament sensible a mesura que s'agrega, fins i tot en petites quantitats; el tacte d'una ploma que cau, l'impacte d'una sola gota d'aigua o una petita descàrrega estàtica són capaços de detonar de manera explosiva una pila no confinada de fulminat de plata no més gran que un centau i no més pesat que uns quants mil·ligrams. Agregar quantitats més grans és impossible, a causa de la tendència del compost a autodetonar-se sota el seu propi pes.
El fulminat de plata va ser preparat per primera vegada l'any 1800 per Edward Charles Howard en el seu projecte d'investigació per preparar una gran varietat de fulminats. Juntament amb el fulminat de mercuri, és l'únic fulminat prou estable per a un ús comercial. Els detonadors que utilitzaven fulminat de plata es van utilitzar per iniciar l'àcid pícric el 1885, però des de llavors només han estat utilitzats per la Marina italiana.[1] L'ús comercial actual ha estat en la producció de generadors de soroll i novetats no perjudicials com a joguines per a nens.
Estructura
[modifica]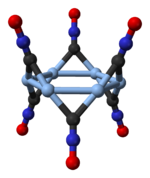
El fulminat de plata es presenta en dues formes polimòrfiques, una ortorròmbica i una de trigonal amb una xarxa romboèdrica.[2] El polimorf trigonal consta d'hexàmers cíclics, (AgCNO) ₆.[3]

Propietats
[modifica]Els fulminats són molt tòxics, aproximadament el mateix que els cianurs.[1] Quan és pur, el fulminat de plata és químicament molt estable i no es descompone després d'anys d'emmagatzematge. Com moltes sals de plata, s'enfosqueix amb l'exposició a la llum. Només és lleugerament soluble en aigua freda i es pot recristal·litzar amb aigua calenta.[1] [4] També es pot recristal·litzar a partir d'una solució al 20% d'acetat d'amoni.[1] No és higroscòpic i pot explotar quan està humit o sota l'aigua; es va informar que continuava sent explosiu després de 37 anys sota l'aigua.[1] Explota en contacte amb àcid sulfúric concentrat o clor o brom, però no quan entra en contacte amb el iode.[1] És insoluble en àcid nítric, però es dissol en amoníac, clorurs alcalins, cianurs alcalins, anilina, piridina i iodur de potassi formant complexos.[1] L' àcid clorhídric concentrat el descompon de manera no explosiva amb un soroll de xiuxiueig; El tiosulfat també el descompon de manera no explosiva i es pot utilitzar per eliminar-lo.[1]
Preparació
[modifica]Aquest compost es pot preparar abocant una solució de nitrat de plata en àcid nítric en etanol, sota un control acurat de les condicions de reacció, per evitar una explosió.[5] La reacció es fa normalment – 80-90 °C; a les 30 °C, el precipitat pot no formar-se.[1] Només s'han de preparar quantitats molt petites de fulminat de plata alhora, ja que fins i tot el pes dels cristalls pot fer que s'autodetonin. Una altra manera de fer fulminat de plata és fer reaccionar el carbonat de plata amb l'amoníac en solució.[5]
El fulminat de plata també es forma quan el gas òxid de nitrogen es fa passar per una solució de nitrat de plata en etanol.[1]
El fulminat de plata es pot preparar sense voler, quan una solució àcida de nitrat de plata entra en contacte amb l'alcohol.[5] Això és un perill en algunes formulacions de miralls de plata química.
Novetat en explosius
[modifica]El fulminat de plata, sovint en combinació amb el clorat de potassi, s'utilitza en els fabricants de soroll trucats coneguts com a "tirar avall", "crackers", "snappers", "whippersnappers", "pop-its" o "bang snaps", un tipus popular de focs artificials novetats. Contenen aproximadament 200 mil·ligrams de grava fina recoberta amb una petita quantitat (aproximadament 80 micrograms) [6] de fulminat de plata. Quan es llança contra una superfície dura, l'impacte és suficient per detonar la petita quantitat d'explosiu, creant una petita salutació a partir de la detonació supersònica. Els snaps estan dissenyats per ser incapaços de produir danys (fins i tot quan es detonen contra la pell) a causa de l'efecte amortidor que proporciona la massa molt més gran del medi de grava. També és la substància química que es troba a les galetes de Nadal [7] que va ser utilitzada per primera vegada per a aquest propòsit per Tom Smith el 1860. El producte químic està pintat en una de les dues tires estretes de cartolina, amb abrasiu a la segona. Quan s'estira el cracker, l'abrasiu detona el fulminat de plata.
Una barreja de fulminats amb un 10-20% – clorat de potassi és més barata i més brillant que el fulminat sol.[1]
Fulminat de plata i "plata fulminant"
[modifica]El fulminat de plata sovint es confon amb nitrur de plata, azida de plata o plata fulminant. "Plata fulminant", encara que sempre es refereix a una substància explosiva que conté plata, és un terme ambigu. Tot i que pot ser un sinònim de fulminat de plata, també pot referir-se al nitrur o azida, el producte de descomposició del reactiu de Tollen, o una mescla alquímica, que no conté l'anió fulminat.
Referències
[modifica]- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 Matyas, Robert. Primary Explosives. Springer Science & Business Media, 338 pages, Mar 12, 2013.
- ↑ Britton, D.; Dunitz, J. D. Acta Crystallographica, 19, 4, 1965, pàg. 662–668. DOI: 10.1107/S0365110X6500405X.
- ↑ Britton, D. Acta Crystallographica C, 47, 12, 1991, pàg. 2646–2647. DOI: 10.1107/S0108270191008855.
- ↑ 0.0075 gm at 13 °C, 0.018 gm at 30 °C, and 0.25 gm per 100 gm H₂O at 100 °C
- ↑ 5,0 5,1 5,2 Collins, P. H.; Holloway, K. J. Propellants, Explosives, Pyrotechnics, 3, 6, 1978, pàg. 159–162. DOI: 10.1002/prep.19780030603.
- ↑ package disclosure of Alexron Co. Ltd, Hong Kong, Phantom Brand Bang Snaps, (c)2013
- ↑ Spectrum. «Comment #70». Old Firework Factory Locations. UK Pyrotechnics Society. [Consulta: 20 desembre 2011].
