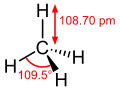Germà (grup)
| Substància química | classe estructural d'entitats químiques |
|---|
Un germà és un hidrur de germani, un compost químic constituït per molècules que contenen àtoms de germani i d'hidrogen . Presenten una fórmula general amb . L'estructura de les seves molècules es basa en cadenes d'àtoms de germani enllaçats linealment mitjançant enllaços covalents sigma . A partir de quatre àtoms de germani les cadenes poden estar ramificades, per tant, hi ha isòmers de cadena. Són composts similars als silans pel que fa a les seves propietats físiques i químiques. Els germans són menys volàtils i inflamables que els silans i són una mica menys reactius amb els àlcalis.
Història
[modifica]El primer hidrur de germani fou obtingut el 1902 per E. Voegelen en fer reaccionar zinc amb tetraclorur de germani en presència d'àcid sulfúric.[1] Voegelen treballà amb petites quantitats i no obtingué l'hidrur en estat pur, sinó que es limità a determinar la composició de l'hidrur existent en una barreja diluïda amb hidrogen a partir del qual pogué separar l'hidrur. Feu reaccionar l'hidrur de germani amb una sal d'argent, precipitant així germanur d'argent , i la mescla també es passà sobre sofre finament dividit, convertint així l'hidrur en sulfur. L'anàlisi d'aquests dos productes suggerí la fórmula , el germà.[2]
El 1909 John H. Müller i Nicol H. Smith, de la Universitat de Pennsilvània, informaren sobre l'ús del test de Marsh per detectar germani;[3] en el curs del seu estudi també investigaren mètodes per preparar l'hidrur. No aïllaren l'hidrur pur sinó que feren feina amb mescles d'hidrur en hidrogen. El 1922 l'austríac Friedrich Paneth (1887–1958) i Schenk, independentment, prepararen petites quantitats de germà tractant un aliatge de germani i zinc o de germani i magnesi amb un àcid. Ambdós investigadors comprovaren experimentalment que la composició del gas era i Schenk també determinà valors de –165 °C per al punt de congelació i –126 °C pel punt d'ebullició.[2]
A la Universitat de Cornell, Louis Munroe Dennis (1863–1936), Robert B. Corey (1897–1971) i Roy W. Moore estudiaren mètodes per preparar hidrurs de germani i finalment adoptaren un mètode semblant al que utilitza l'alemany Alfred Stock (1876–1946) per a la preparació dels hidrurs de silici. Aquest procediment consisteix en el tractament del germanur de magnesi amb un àcid. L'aplicació d'aquesta tècnica permet sintetitzar germà , digermà i trigermà que es van aïllar i identificar per primera vegada el 1924.[4] El 1959 E. Amberger sintetitzà el tetragermà i el pentagermà .[5]
Nomenclatura
[modifica]Existeix una nomenclatura sistemàtica per als germans. Cada nom dels germans consisteix en el nom «germà» precedida per un prefix numèric (di-, tri-, tetra-, etc.) corresponent al nombre d'àtoms de germani en la molècula. Així s'anomena digermà, és el trigermà, etc. No existeix prefix per a un, és simplement germà. Els germans també poden ser anomenats com qualsevol altre compost inorgànic, així el germà és pot anomenar també tetrahidrur de germani.[6]
S'han caracteritzat germans fins al nonagermà amb isòmers de cadena.[7]
Estructura
[modifica]Els àtoms de germani presenten hibridació sp3, per la qual cosa poden formar quatre enllaços covalents simples (enllaços sigma) dirigits segons els vèrtexs d'un tetraedre, separats 109,5°, igual que els àtoms de carboni perquè són elements del mateix grup 14 de la taula periòdica. Les longituds dels enllaços amb els àtoms d'hidrogen creix amb el volum atòmic dels elements, que és proporcional al nombre màssic. L'enllaç té una longitud de 152,5 pm, la de l'enllaç és de 148,0 pm i la del només és de 108,7 pm. S'observa que a mesura que augmenta el volum atòmic s'incrementa la distància d'enllaç.[8]
Els enllaços són més febles que els , i aquests més febles que els . Les energies d'enllaç en kJ/mol són 263,6; 326,8 i 607,2, respectivament. Així la força de l'enllaç és un poc inferior a la meitat de la força . Pel que fa als enllaços amb els hidrògens, són un poc més febles els que els i que els , però la diferència és poc significativa. En kJ/mol són respectivament: 321,7; 299,2; 338,4.[9]
Propietats
[modifica]
Els germans a temperatura ambient són gasos incolors o líquids volàtils i les seves propietats físiques i químiques són molt semblants a les dels silans. Els germans són tots menys volàtils que els silans corresponents i, potser sorprenentment, notablement menys reactius. Així, a diferència del silà i l'estannà , hidrurs d'elements que pertanyen al mateix grup 14 de la taula periòdica, el germà no s'encén en contacte amb l'aire i no es veu afectat per les dissolucions d'àcids o d'hidròxid de sodi aquós al 30%. Actua com un àcid front a l'amoníac líquid formant cations amoni i anions germanat i reacciona amb metalls alcalins en aquest dissolvent per donar sals .[10]
Les sals , com el corresponent, són de composts blancs i cristal·lins d'una utilitat sintètica considerable. L'anàlisi de difracció de raigs X mostra que i tenen l'estructura de tipus , la qual cosa implica la rotació lliure de , i té l'estructura rara TlI. El radi iònic derivat de 229 pm emfatitza la similitud amb (226 pm) i això es veu reforçat pels angles d'enllaç deduïts dels experiments de RMN de línia ampla: 94 ± 4° semblant al del que és isoelectrònic, 93,5°; 92,5 ± 4° comparat amb isoelectrònic, 91,8°.[10]
| Germà | Punt de fusió
(°C) |
Punt d'ebullició
(°C) |
Densitat
(g/cm³ al punt de fusió) |
|---|---|---|---|
| –164,8 | –88,1 | 1,52 | |
| –109 | 29 | 1,98 | |
| –105,6 | 110,5 | 2,20 | |
| — | 176,9 | — | |
| — | 234 | — |
Els germans de major massa molecular presenten isomeria de cadena. Així el tetragermà presenta dos isòmers i ; i el pentagermà en té tres: , i .[7]
Preparació
[modifica]Abans el germà se sintetitzava per la hidròlisi ineficient d'aliatges de Mg/Ge amb àcids aquosos, però ara es produeix generalment per la reacció de amb l'hidrur d'alumini i liti en èter:
o encara més convenientment per la reacció de diòxid de germani amb solucions aquoses de .
Els germans superiors es preparen per l'acció d'una descàrrega elèctrica sobre el germà . Els hidrurs barrejats com el es poden preparar de manera similar fent circular una barreja de i , però encara no s'han preparat hidrurs cíclics o insaturats.[10]
Referències
[modifica]- ↑ Voegelen, E. «Über Germaniumwasserstoff». Zeitschrift für anorganische Chemie, 30, 1, 16-04-1902, pàg. 325–330. DOI: 10.1002/zaac.19020300127. ISSN: 0863-1778.
- ↑ 2,0 2,1 Johnson, Otto H. «The Germanes and their Organo Derivatives.». Chemical Reviews, 48, 2, 01-04-1951, pàg. 259–297. DOI: 10.1021/cr60150a003. ISSN: 0009-2665.
- ↑ Müller, John H.; Smith, Nicol H. «GERMANIUM HYDRIDE». Journal of the American Chemical Society, 44, 9, 01-09-1922, pàg. 1909–1918. DOI: 10.1021/ja01430a009. ISSN: 0002-7863.
- ↑ Dennis, L. M.; Corey, Robert B.; Moore, Roy W. «GERMANIUM.1 VII. THE HYDRIDES OF GERMANIUM». Journal of the American Chemical Society, 46, 3, 3-1924, pàg. 657–674. DOI: 10.1021/ja01668a015. ISSN: 0002-7863.
- ↑ Amberger, E. «Eigenschaften von Ge4H10 und Ge5H12». Angewandte Chemie, 71, 11, 07-06-1959, pàg. 372–373. DOI: 10.1002/ange.19590711108. ISSN: 0044-8249.
- ↑ IUPAC. Nomenclatura de química inorgànica: recomanacions de 1990. Traducció: Enric Casassas i Simó, Joaquim Sales i Cabré. Barcelona: Institut d'Estudis Catalans. Secció de Ciències i Tecnologia, 1997. ISBN 84-7283-360-7.
- ↑ 7,0 7,1 Mackay, K. M.. Introduction to modern inorganic chemistry. Sixth edition, 2017. ISBN 978-1-315-27467-6.
- ↑ «CCCBDB listing of experimental data page 2». [Consulta: 24 febrer 2022].
- ↑ William M. Haynes. CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data.. 93rd ed., 2012-2013. Boca Raton, Fla.: CRC, 2012. ISBN 978-1-4398-8049-4.
- ↑ 10,0 10,1 10,2 Greenwood, N. N.. Chemistry of the elements. 2a edició, 1997. ISBN 0-585-37339-6.
- ↑ 11,0 11,1 Holleman, Arnold Frederik. Lehrbuch der anorganischen Chemie. 81.-90., sorgf. rev., verb. und stark erw. Aufl. Reprint 2019, 2019. ISBN 978-3-11-150960-0.