Halogenació
L'halogenació és el procés químic mitjançant el qual s'addicionen un o diversos àtoms d'elements del grup dels halògens (grup 17 de la taula periòdica) a una molècula orgànica. Una de les halogenats més simples és l'halogenació d'alcans. En aquestes reaccions els àtoms d'hidrogen dels alcans resulten substituïts totalment o parcialment per àtoms del grup dels halògens. La reacció que té lloc és la següent:
Són possibles una gran varietat de productes químics. La composició de la barreja de productes donarà la concentració dels reactius i altres condicions del medi de reacció, per exemple, la temperatura.
Tipus d'halogenació
[modifica]En una halogenació s'incorpora un àtom d'halogen a una molècula. Hi ha descripcions més concretes que especifiquen el tipus d'halogen: fluoració, cloració, bromació i iodació.
En una reacció d'addició de Markovnikov, un halogen com el brom es fa reaccionar amb un alquè que fa que l'enllaç π del doble enllaç es trenqui per donar la formació d'un haloalcà amb enllaç senzill. Això fa més reactiu l'hidrocarbur, i el brom, com a resultat, és un bon grup sortint en diverses reaccions químiques com ara les reaccions de substitució nucleofílica alifàtica i les reaccions d'eliminació.
Hi ha diversos tipus principals d'halogenació, incloent:
- Halogenació radicalària, típica d'alcans
- Halogenació de cetones
- Halogenació electrofílica
- Reacció d'addició d'halogen
Així mateix, en la deshalogenació un àtom d'halogen s'elimina d'una molècula com a conseqüència d'una reacció.
Exemples
[modifica]- La formació de clorur d'or (III) per cloració d'or.
Altres mètodes específics d'halogenació són la reacció de Hunsdiecker (a partir d'àcids carboxílics) i la reacció de Sandmeyer (halurs d'aril).
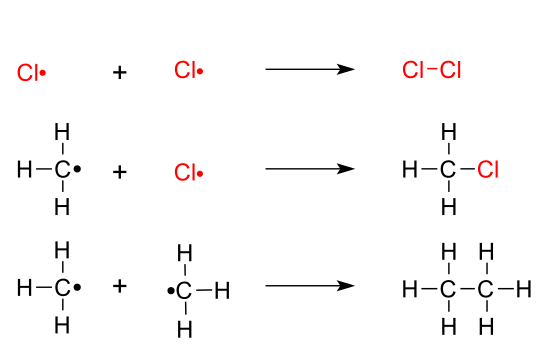
- Reacció de substitució radicalària en alcans: L'halogenació és la reacció de substitució d'un àtom d'H en un alcà per substituir-lo per un àtom d'halogen com Cl, Br, I, F. Es tracta d'una reacció en tres etapes: d'iniciació, de propagació i de terminació.[1] Generalment transcorre sota llum ultraviolada.
- La iniciació consisteix en la formació de radical és a través del trencament de l'enllaç covalent. En aquest exemple, la molècula de clor es divideix en dos radicals clor, (Cl ·), cadascun d'ells amb un electró desaparellat.
- En el pas 1 de la propagació s'extreu un àtom com l'hidrogen de la cadena d'alcà per formar un radical llogo. L'àtom d'H separat s'unirà al radical clor, Cl ·, format en l'etapa d'iniciació.
- El pas 2 de la propagació consisteix a afegir un àtom d'halogen al radical alquil, formant un enllaç covalent, per compartició dels seus electrons. En aquest pas es formen nous radicals clor, Cl ·
- La terminació és on els radicals s'uneixen a través de reaccions d'addició per a formar nous compostos, units covalentment entre si.
- Això acaba amb els radicals lliures presents unint-se per impedir que continuï el mecanisme cíclic. Hi ha diferents possibilitats de terminació, de manera que el resultat d'aquesta reacció és una barreja complexa de substàncies.
En resum, l'halogen arrenca un àtom de H de la cadena carbonada de l'alcà i després s'uneix en aquest lloc a la cadena a través d'una reacció d'addició.
- Un altre exemple d'halogenació es pot trobar en la síntesi orgànica de l'anestèsic halotà a partir de tricloroetilè que implica una bromació a alta temperatura en la segona etapa:[2]

Vegeu també
[modifica]- Haloalcà (halogenur d'alquil)
- Halogenurs d'aril
- Halogenació de Hell-Volhard-Zelinsky
- Halogenació radicalària
- Halocetona
- Substitució electròfila
Referències
[modifica]- ↑ Química Orgànica. EUNED, 1986. ISBN 996831496X. P. 40
- ↑ Synthesis of essential drugs , Ruben Vardanyan, Victor Hruby, Elsevier 2005 ISBN 0-444-52166-6