Hemozoïna
L'hemozoïna (en anglès hemozoin o haemozoin) és un producte de rebuig format a partir de la digestió de la sang per alguns paràsits que s'alimenten d'aquest líquid corporal. Aquests organismes hematòfags, com ara els paràsits de la malària (Plasmodi spp.), Rhodnius i Schistosoma, digereixen l'hemoglobina de la sang i alliberen grans quantitats de grups hemo, el component no proteic de l'hemoglobina. Un grup hemo és un cofactor enzimàtic que consisteix en un àtom de ferro contingut en el centre d'un anell heterocíclic de porfirina. El grup hemo en el seu estat lliure (sense estar associat amb una proteïna) és tòxic per a les cèl·lules, per això els paràsits el converteixen en una forma cristal·lina insoluble anomenada hemozoïna. En plasmodis, l'hemozoïna sovint és anomenada pigment de la malària.
Com que la formació de l'hemozoïna és essencial per a la supervivència d'aquests paràsits, és un objectiu atractiu pel desenvolupament de possibles fàrmacs i s'estudia molt en Plasmodis com a mètode per tractar la malària. Molts dels antimalàrics utilitzats actualment, com la cloroquina i la mefloquina, han estat dissenyats per matar els paràsits de la malària per mitjà de la inhibició de la biocristal·lització de l'hemozoïna.
Descobriment
[modifica]El pigment marró negrós va ser observat per primera vegada per part de Johann Heinrich Meckel l'any 1847 en la sang i la melsa d'una persona boja.[1][2] Tanmateix, no va ser fins a l'any 1849 quan la presència d'aquest pigment va ser relacionada amb la infecció de la malària.[3] Inicialment, es va creure que aquest pigment era produït pel cos com a resposta a la infecció, però Charles Louis Alphonse Laveran es va adonar l'any 1880 que l'anomenat "pigment de la malària" és, en realitat, produït pels paràsits, a mesura que es van multiplicant dins els glòbuls vermells.[4] La relació entre el pigment i els paràsits de la malària va ser utilitzada per Ronald Ross per identificar les etapes en el cicle de vida del Plasmodi mentre viu dins el mosquit, perquè, tot i que aquestes formes del paràsit són aparentment diferents de les etapes del paràsit en la sang, també contenen traces del pigment.
Més endavant, l'any 1891, T. Carbone i W.H. Marró van publicar articles que enllacen la degradació de l'hemoglobina amb la producció del pigment, descrivint el pigment de la malària com una forma d'hematina, refutant la idea àmpliament acceptada que el pigment estava relacionat amb la melanina. Brown va observar que totes les melanines perden el seu color ràpidament quan són tractades amb permanganat de potassi, en canvi aquest pigment no manifesta cap signe de descoloriment.[5][6] El nom en anglès hemozoin va ser proposat per Louis Westenra Sambon.[7] Durant a dècada del 1930 diversos autors van identificar l'hemozoïna com una forma cristal·lina i pura de l'α-hematina i van demostrar que la substància no contenia proteïnes en els cristalls, sense donar cap explicació pel que fa a les diferències de solubilitat entre els cristalls del pigment de la malària i l' α-hematina.[4]
Formació
[modifica]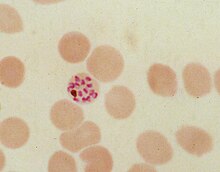
Durant el seu cicle de reproducció asexual dins els eritròcits, el Plasmodi falciparum consumeix fins al 80% de l'hemoglobina de la cèl·lula amfitriona.[8][9] La digestió d'hemoglobina allibera α-hematina (ferriprotoporfirina IX) monomèrica. Aquest compost és tòxic, degut al seu caràcter pro-oxidant que fa que catalitzi la producció d'espècies reactives d'oxigen. Es creu que l'estrès oxidatiu és generat durant la conversió del grup hemo (ferroprotopofirina) a hematina (ferriprotopofirina). L'hematina lliure també es pot unir a la membrana cel·lular i destruir-la causant la lisi de l'eritròcit amfitrió.[10] La reactivitat peculiar d'aquesta molècula ha estat demostrada en variades condicions experimentals tant in vitro com in vivo.[11]

Llavors el paràsit de malària desintoxica la cèl·lula d'hematina per mitjà de la seva biocristal·lització, convertint-la en cristalls insolubles de β-hematina (anomenada hemozoïna) que són químicament inerts.[13][14][15] En el Plasmodi, el vacúol alimentari s'omple amb cristalls d'hemozoïna, els quals fan aproximadament uns 100-200 nanòmetres de llargària, cadascun dels quals conté aproximadament 80.000 grups hemo.[4] La desintoxicació a través de la biocristal·lització és un procés distint del de desintoxicació en mamífers, en què un enzim anomenat hemo oxigenasa trenca els grups hemo excessius en biliverdina, ferro, i monòxid de carboni.[16]
Diversos mecanismes han estat proposats per a la producció d'hemozoïna en el Plasmodi. Hi ha una gran controvèrsia al voltant d'aquest tema, els lípids de membrana, les proteïnes riques en histidina, o fins i tot una combinació d'ambdós, han estat proposats com a catalitzador de la formació d'hemozoïna.[17][18][19][20] Altres autors han descrit una proteïna desintoxicant de grups hemo, reclamant que aquesta és més potent que qualsevol lípid o proteïna rica en histidina.[12] És possible que molts processos contribueixen a la formació d'hemozoïna.[21] La formació d'hemozoïna en altres organismes que s'alimenten de sang no ha estat tan ben estudiada com en el Plasmodi.[22] Tanmateix, estudis en Schistosoma mansoni han revelat que aquest cuc paràsit produeix grans quantitats d'hemozoïna durant el seu creixement en el torrent sanguini humà. Tot i que les formes dels cristalls són diferents d'aquelles produïdes pels paràsits de la malària, l'anàlisi química del pigment produït per Schistosoma mansoni va mostrar que es tracta igualment d'hemozoïna.[23][24][25] De la mateixa manera, els cristalls formats en l'intestí del Rhodnius prolixus durant la digestió de la sang també tenen una forma única, però estan compostos així mateix d'hemozoïna.[26] La formació d'hemozoïna en l'intestí mitjà del R. prolixus ocorre en condicions fisicoquímiques fisiològicament rellevants a la vegada que els lípids porten a terme una funció important en la biocristal·lizació dels grups hemo. S'ha demostrat que la cristal·lització autocatalítica de grups hemo és un procés ineficient i que aquesta conversió minva a mesura que la concentració d'hemozoïna augmenta.
Molts altres mecanismes de protecció han estat desenvolupats per part d'una gran varietat d'hematòfags contra els efectes tòxics del grup hemo lliure.[27] Els mosquits digereixen els seus àpats de sang de manera extracel·lular i no produeixen hemozoïna. El grup hemo és retingut en la matriu peritròfica, una capa de proteïna i polisacàrids que cobreix l'intestí mitjà i separa les cèl·lules intestinals dels bolus de sang que estan sent digerits.[28]
Tot i que la β-hematina pot ser produïda espontàniament en assajos a pH baix, el desenvolupament d'un mètode senzill i fiable per mesurar la producció d'hemozoïna ha resultat difícil. Això és degut en part a la incertesa sobre quines molècules són implicades en la producció d'hemozoïna, i en part a la dificultat per mesurar la diferència entre agregats o precipitats de grups hemo, en comparació als de hemozoïna genuïna.[29] L'actual mètode és sensible i precís, però requereix múltiples etapes de rentat que són lentes i, per tant, no ideals per cribratge d'alt rendiment.[29] Tanmateix, alguns cribratges han estat duts a terme amb aquests assajos.[30]
Estructura
[modifica]

Els cristalls de β-hematina estan formats per dímers de molècules d'hematina que són, a la vegada, units entre ells per ponts d'hidrogen per formar estructures més grans. En aquests dímers, un enllaç de coordinació ferro-oxigen uneix el ferro central d'una hematina a l'oxigen de la cadena carboxilada lateral d'una hematina adjacent. Aquests enllaços recíprocs ferro-oxigen són altament inusuals i no han estat observat en cap altre dímer de porfirines. La β-hematina pot adquirir una forma o bé de dímer cíclic o bé de polímer lineal, una forma polimèrica no ha estat mai observada per l'hemozoïna, refutant la idea àmpliament estesa que l'hemozoïna és produïda per l'enzim hemo-polimerasa.[31][32]
Els cristalls d'hemozoïna tenen una estructura triclínica i són lleugerament magnètics. La diferència diamagnètica entre l'oxihemoglobina de baix espín i l'hemozoïna paramagnètica pot ser utilitzada per separar aquests dos compostos.[33][34] També exhibeixen dicroisme òptic, el que significa que absorbeixen llum més fortament al llarg de la seva longitud que a través de la seva amplada, fet que permet la detecció automatitzada de malària.[35] L'hemozoïna és produïda d'una manera que, sota l'acció d'un camp magnètic, dona lloc a un dicroisme òptic característic de la seva pròpia concentració; per tant, la mesura precisa d'aquest dicroisme induït pot ser utilitzada per determinar el nivell d'infecció malarial.[36]
Inhibidors
[modifica]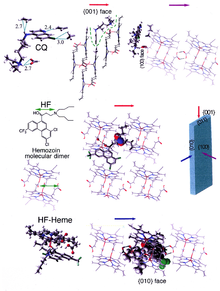
La formació hemozoïna és un objectiu excel·lent per possibles fàrmacs antimalàrics, ja que és un procés que és essencial per a la supervivència del paràsit de la malària i alhora és absent en l'amfitrió humà. L'objectiu del fàrmac, l'hematina, és derivada de l'amfitrió i es troba en gran part fora del control genètic del paràsit, fet que fa que el desenvolupament de resistència al fàrmac sigui més difícil. Es creu que molts fàrmacs utilitzats clínicament actuen inhibint la formació d'hemozoïna en el vacúol alimentari.[37] Això impedeix la desintoxicació del grup hemo alliberat en aquest compartiment, matant el paràsit.[38]
Els exemples més ben estudiats d'inhibidors de la biocristal·lització de l'hematina són fàrmacs derivats de la quinolina com la cloroquina i la mefloquina. Aquests s'uneixen tant a grups hemo lliures com a cristalls d'hemozoïna, per tant bloquen l'addició de nous grups hemo evitant així el creixement dels cristalls.[39] Es creu que els inhibidors s'uneixen a la cara dels cristalls que és més petita i a la vegada està creixent més ràpidament.[40][41]
Rol en fisiopatologia
[modifica]L'hemozoïna és alliberada a la circulació durant la reinfecció i és fagocitada in vivo i in vitro pels fagòcits amfitrions alterant funcions importants de les seves cèl·lules. La majoria d'alteracions funcionals tenen efectes postfagocítics de llarg termini, com ara la inhibició d'eritropoesi in vitro.[42][43][44][45][46] Contràriament, s'ha demostrat que una estimulació potent d'esclat oxidatiu a curt termini per part dels monòcits humans ocorre durant la fagocitosi de l'hemozoïna.[47]
Vegeu també
[modifica]Referències
[modifica]- ↑ Janjua RM, Schultka R, Goebbel L, Pait TG, Shields CB «The legacy of Johann Friedrich Meckel the Elder (1724-1774): a 4-generation dynasty of anatomists». Neurosurgery, 66, 4, 2010, pàg. 758–770. DOI: 10.1227/01.NEU.0000367997.45720.A6. PMID: 20305497.
- ↑ Meckel H «Ueber schwarzes Pigment in der Milz und dem Blute einer Geisteskranken». Zeitschrift für Psychiatrie, IV, 1847, pàg. 198–226.
- ↑ Virchow R «Zur pathologischen Physiologie des Bluts». Arch pathol Anatomie Physiol Klin Med, 2, 3, 1849, pàg. 587–598. DOI: 10.1007/BF02114475.
- ↑ 4,0 4,1 4,2 Sullivan DJ «Theories on malarial pigment formation and quinoline action». Int J Parasitol, 32, 13, 12-2002, pàg. 1645–53. DOI: 10.1016/S0020-7519(02)00193-5. PMID: 12435449.
- ↑ Carbone T «Sulla natura chimica del pigmento malarico». G R Accad Med Torino, 39, 1891, pàg. 901–906.
- ↑ Brown WH «MALARIAL PIGMENT (SO-CALLED MELANIN): ITS NATURE AND MODE OF PRODUCTION». J Exp Med, 13, 2, 1911, pàg. 290–299. DOI: 10.1084/jem.13.2.290. PMC: 2124860. PMID: 19867409.
- ↑ Sinton JA, Ghosh BN «Studies of malarial pigment (haemozoin). Part I. Investigation of the action of solvents on haemozoin and the spectroscopical appearances observed in the solutions». Records of the malaria survey of India, 4, 1934, pàg. 15–42.
- ↑ Rosenthal PJ, Meshnick SR «Hemoglobin catabolism and iron utilization by malaria parasites». Mol Biochem Parasitol, 83, 2, 12-1996, pàg. 131–139. DOI: 10.1016/S0166-6851(96)02763-6. PMID: 9027746.
- ↑ Esposito A, Tiffert T, Mauritz JM, Schlachter S, Bannister LH, Kaminski CF, Lew VL «FRET Imaging of Hemoglobin Concentration in Plasmodium falciparum-Infected Red Cells». PLoS ONE, 3, 11, 2008, pàg. e3780. DOI: 10.1371/journal.pone.0003780. PMC: 2582953. PMID: 19023444.
- ↑ Fitch CD, Chevli R, Kanjananggulpan P, Dutta P, Chevli K, Chou AC «Intracellular ferriprotoporphyrin IX is a lytic agent». Blood, 62, 6, 1983, pàg. 1165–1168. PMID: 6640106.
- ↑ Hebbel RP, Eaton JW «Pathobiology of heme interaction with the erythrocyte membrane». Semin Hematol, 26, 2, 4-1989, pàg. 136–149. PMID: 2658089.
- ↑ 12,0 12,1 Jani D, Nagarkatti R, Beatty W, Angel R, Slebodnick C, Andersen J, Kumar S, Rathore D «HDP—A Novel Heme Detoxification Protein from the Malaria Parasite». PLoS Pathog, 4, 4, 4-2008, pàg. e1000053. DOI: 10.1371/journal.ppat.1000053. PMC: 2291572. PMID: 18437218.
- ↑ Fitch CD, Kanjananggulpan P «The state of ferriprotoporphyrin IX in malaria pigment». J Biol Chem, 262, 32, 11-1987, pàg. 15552–1555. PMID: 3119578.
- ↑ Pagola S, Stephens PW, Bohle DS, Kosar AD, Madsen SK «The structure of malaria pigment beta-haematin». Nature, 404, 6775, 3-2000, pàg. 307–310. DOI: 10.1038/35005132. PMID: 10749217.
- ↑ Hempelmann E «Còpia arxivada». Parasitol Research, 100, 4, 2007, pàg. 671–676. Arxivat de l'original el 2011-06-10. DOI: 10.1007/s00436-006-0313-x. PMID: 17111179 [Consulta: 5 abril 2016]. Arxivat 2011-06-10 a Wayback Machine.
- ↑ Kikuchi G, Yoshida T, Noguchi M «Heme oxygenase and heme degradation». Biochem Biophys Res Commun, 338, 1, 12-2005, pàg. 558–567. DOI: 10.1016/j.bbrc.2005.08.020. PMID: 16115609.
- ↑ Pisciotta JM, Sullivan D «Hemozoin: Oil Versus Water». Parasitol Int, 57, 2, 6-2008, pàg. 89–96. DOI: 10.1016/j.parint.2007.09.009. PMC: 2442017. PMID: 18373972.
- ↑ Huy NT, Shima Y, Maeda A, Men TT, Hirayama K, Hirase A, Miyazawa A, Kamei A «Phospholipid Membrane-Mediated Hemozoin Formation: The Effects of Physical Properties and Evidence of Membrane Surrounding Hemozoin». PLoS ONE, 8, 7, 2013, pàg. e70025. DOI: 10.1371/journal.pone.0070025.
- ↑ Sullivan DJ, Gluzman IY, Goldberg DE «Plasmodium hemozoin formation mediated by histidine-rich proteins». Science, 271, 5246, 1-1996, pàg. 219–222. DOI: 10.1126/science.271.5246.219. PMID: 8539625.
- ↑ Pandey AV, Babbarwal VK, Okoyeh JN, Joshi RM, Puri SK, Singh RL, Chauhan VS «Hemozoin formation in malaria: a two-step process involving histidine-rich proteins and lipids». Biochem Biophys Res Commun, 308, 4, 9-2003, pàg. 736–743. DOI: 10.1016/S0006-291X(03)01465-7. PMID: 12927780.
- ↑ Chugh M, Sundararaman V, Kumar S, Reddy VS, Siddiqui WA, Stuart KD, Malhotra P «Protein complex directs hemoglobin-to-hemozoin formation in Plasmodium falciparum». Proc Natl Acad Sci U S A, 110, 14, 4-2013, pàg. 5392–7. DOI: 10.1073/pnas.1218412110. PMID: 23471987.
- ↑ Egan TJ «Haemozoin formation». Mol Biochem Parasitol, 157, 2, 2-2008, pàg. 127–136. DOI: 10.1016/j.molbiopara.2007.11.005. PMID: 18083247.
- ↑ Moore GA, Homewood CA, Gilles HM «A comparison of pigment from Schistosoma mansoni and Plasmodium berghei». Ann Trop Med Parasitol, 69, 3, 9-1975, pàg. 373–374. PMID: 1098591.
- ↑ Oliveira MF, d'Avila JC, Torres CR, Oliveira PL, Tempone AJ, Rumjanek FD, Braga CM, Silva JR, Dansa-Petretski M, Oliveira MA, de Souza W, Ferreira ST «Haemozoin in Schistosoma mansoni». Mol Biochem Parasitol, 111, 1, 11-2000, pàg. 217–221. DOI: 10.1016/S0166-6851(00)00299-1. PMID: 11087932.
- ↑ Corrêa Soares JB, Menezes D, Vannier-Santos MA, Ferreira-Pereira A, Almeida GT, Venancio TM, Verjovski-Almeida S, Zishiri VK, Kuter D, Hunter R, Egan TJ, Oliveira MF «Interference with Hemozoin Formation Represents an Important Mechanism of Schistosomicidal Action of Antimalarial Quinoline Methanols». PLoS Negl Trop Dis, 3, 7, 2009, pàg. e477. DOI: 10.1371/journal.pntd.0000477. PMC: 2703804. PMID: 19597543.
- ↑ Oliveira MF, Kycia SW, Gomez A, Kosar AJ, Bohle DS, Hempelmann E, Menezes D, Vannier-Santos MA, Oliveira PL, Ferreira ST «Structural and morphological characterization of hemozoin produced by Schistosoma mansoni and Rhodnius prolixus». FEBS Lett, 579, 27, 2005, pàg. 6010–6016. DOI: 10.1016/j.febslet.2005.09.035. PMID: 16229843.
- ↑ Stiebler R, Timm BL, Oliveira PL, Hearne GR, Egan TJ, Oliveira MF «On the physico-chemical and physiological requirements of hemozoin formation promoted by perimicrovillar membranes in Rhodnius prolixus midgut». Insect Biochem Mol Biol, 40, 3, 2010, pàg. 284–292. DOI: 10.1016/j.ibmb.2009.12.013. PMID: 20060043.
- ↑ Pascoa V, Oliveira PL, Dansa-Petretski M, Silva JR, Alvarenga PH, Jacobs-Lorena M, Lemos FJ «Aedes aegypti peritrophic matrix and its interaction with heme during blood digestion». Insect Biochem Mol Biol, 32, 5, 5-2002, pàg. 517–523. DOI: 10.1016/S0965-1748(01)00130-8. PMID: 11891128.
- ↑ 29,0 29,1 Dorn A, Vippagunta SR, Matile H, Bubendorf A, Vennerstrom JL, Ridley RG «A comparison and analysis of several ways to promote haematin (haem) polymerisation and an assessment of its initiation in vitro». Biochem Pharmacol, 55, 6, 3-1998, pàg. 737–747. DOI: 10.1016/S0006-2952(97)00509-1. PMID: 9586945.
- ↑ Tekwani BL, Walker LA «Targeting the hemozoin synthesis pathway for new antimalarial drug discovery: technologies for in vitro beta-hematin formation assay». Comb Chem High Throughput Screen, 8, 1, 2-2005, pàg. 63–79. DOI: 10.2174/1386207053328101. PMID: 15720198.
- ↑ Lemberg R, Legge JW «Hematin compounds and bile pigments». Interscience, New York, 1949.
- ↑ Hempelmann E, Marques HM «Analysis of malaria pigment from Plasmodium falciparum». J Pharmacol Toxicol Methods, 32, 1, 9-1994, pàg. 25–30. DOI: 10.1016/1056-8719(94)90013-2. PMID: 7833503.
- ↑ Paul F, Roath S, Melville D, Warhurst DC, Osisanya JO «Separation of malaria-infected erythrocytes from whole blood: use of a selective high-gradient magnetic separation technique». Lancet, 2, 8237, 1981, pàg. 70–71. DOI: 10.1016/S0140-6736(81)90414-1. PMID: 6113443.
- ↑ Kim CC, Wilson EB, Derisi JL «Improved methods for magnetic purification of malaria parasites and haemozoin». Malar J, 9, 1, 2010, pàg. 17. DOI: 10.1186/1475-2875-9-17. PMC: 2817699. PMID: 20074366.
- ↑ Mendelow BV, Lyons C, Nhlangothi P, Tana M, Munster M, Wypkema E, Liebowitz L, Marshall L, Scott S, Coetzer TL «Automated malaria detection by depolarization of laser light». Br J Haematol, 104, 3, 1999, pàg. 499–503. DOI: 10.1046/j.1365-2141.1999.01199.x. PMID: 10086786.[Enllaç no actiu]
- ↑ Newman DM, Heptinstall J, Matelon RJ, Savage L, Wears ML, Beddow J, Cox M, Schallig HD, Mens P «Còpia arxivada». Biophys J, 95, 2, 2008, pàg. 994–1000. Arxivat de l'original el 2011-07-27. DOI: 10.1529/biophysj.107.128140. PMC: 2440472. PMID: 18390603 [Consulta: 5 abril 2016]. Arxivat 2011-07-27 a Wayback Machine.
- ↑ Ziegler J, Linck R, Wright DW «Heme Aggregation inhibitors: antimalarial drugs targeting an essential biomineralization process». Curr Med Chem, 8, 2, 2-2001, pàg. 171–89. DOI: 10.2174/0929867013373840. PMID: 11172673.
- ↑ Coronado LM, Nadovich CT, Spadafora C «Malarial hemozoin: From target to tool». Biochim Biophys Acta, 1840, 6, 2014, pàg. 2032–2041. DOI: 10.1016/j.bbagen.2014.02.009. PMID: 24556123.
- ↑ Sullivan DJ, Gluzman IY, Russell DG, Goldberg DE «On the molecular mechanism of chloroquine's antimalarial action». Proc Natl Acad Sci USA, 93, 21, 10-1996, pàg. 11865–70. DOI: 10.1073/pnas.93.21.11865. PMC: 38150. PMID: 8876229.
- ↑ de Villiers KA, Marques HM, Egan TJ «The crystal structure of halofantrine-ferriprotoporphyrin IX and the mechanism of action of arylmethanol antimalarials». J Inorg Biochem, 102, 8, 8-2008, pàg. 1660–1667. DOI: 10.1016/j.jinorgbio.2008.04.001. PMID: 18508124.
- ↑ Weissbuch I, Leiserowitz L «Interplay between malaria, crystalline hemozoin formation, and antimalarial drug action and design». Chem Rev, 108, 11, 2008, pàg. 4899–4914. DOI: 10.1021/cr078274t. PMID: 19006402.
- ↑ Arese P, Schwarzer E «Malarial pigment (haemozoin): a very active ‘inert’ substance». Ann Trop Med Parasitol, 91, 5, 1997, pàg. 501–516. DOI: 10.1080/00034989760879. PMID: 9329987.
- ↑ Skorokhod OA, Alessio M, Mordmüller B, Arese P, Schwarzer E «Hemozoin (malarial pigment) inhibits differentiation and maturation of human monocyte-derived dendritic cells: a peroxisome proliferator-activated receptor-gamma-mediated effect». J Immunol, 173, 6, 2004, pàg. 4066–74. DOI: 10.4049/jimmunol.173.6.4066. PMID: 15356156.
- ↑ Giribaldi G, Ulliers D, Schwarzer E, Roberts I, Piacibello W, Arese P «Hemozoin- and 4-hydroxynonenal-mediated inhibition of erythropoiesis. Possible role in malarial dyserythropoiesis and anemia». Haematologica, 89, 4, 2004, pàg. 492–493. PMID: 15075084.
- ↑ Casals-Pascual C, Kai O, Cheung JO, Williams S, Lowe B, Nyanoti M, Williams TN, Maitland K, Molyneux M, Newton CR, Peshu N, Watt SM, Roberts DJ «Suppression of erythropoiesis in malarial anemia is associated with hemozoin in vitro and in vivo». Blood, 108, 8, 2006, pàg. 2569–77. DOI: 10.1182/blood-2006-05-018697. PMID: 16804108.
- ↑ Skorokhod OA, Caione L, Marrocco T, Migliardi G, Barrera V, Arese P, Piacibello W, Schwarzer E «Inhibition of erythropoiesis in malaria anemia: role of hemozoin and hemozoin-generated 4-hydroxynonenal.». Blood, 116, 20, 2010, pàg. 4328–37. DOI: 10.1182/blood-2010-03-272781. PMID: 20686121.
- ↑ Barrera V, Skorokhod OA, Baci D, Gremo G, Arese P, Schwarzer E «Host fibrinogen stably bound to hemozoin rapidly activates monocytes via TLR-4 and CD11b/CD18-integrin: a new paradigm of hemozoin action». Blood, 117, 21, 2011, pàg. 5674–82. DOI: 10.1182/blood-2010-10-312413. PMID: 21460246.
