Làmina beta
La làmina β (o làmina β-plegada) és la segona forma d'estructura secundària de les proteïnes, només una mica menys comú que l'hèlix alfa. Les làmines beta consisteixen en cadenes beta connectades lateralment com a mínim amb dos o tres enllaços d'hidrogen, formant, així, una làmina plegada. Una cadena beta (també cadena β) és una cadena polipeptídica en general de 3 a 10 aminoàcids de llarg. Les fulles β han estat implicades en la formació dels agregats de proteïnes i fibres que s'observen en moltes malalties humanes, en particular l'amiloïdosi i la malaltia d'Alzheimer.

Nomenclatura
[modifica]Habitualment, entenem per cadena β un sol tram d'aminoàcids que adopten una conformació estesa formant enllaços d'hidrogen amb una altra cadena β. En canvi, definim làmina β com el conjunt de, almenys, dues d'aquestes cadenes unides per enllaços d'hidrogen.
Història
[modifica]Aquesta estructura fou proposada per primera vegada per William Astbury el 1930. Aquest, proposà la idea de la formació d'enllaços per pont d'hidrogen entre els enllaços peptídics de les cadenes beta, ja siguin paral·leles o antiparal·leles. No obstant això, Astbury no comptà amb la informació suficient sobre la geometria dels enllaços dels aminoàcids per tal d'elaborar models precisos, sobretot perquè desconeixia la forma plana dels enllaços peptídics. Una versió millorada fou plantejada per Linus Pauling i Robert Corey el 1951.
Estructura i orientació
[modifica] |
 |
Geometria
[modifica]La majoria de les cadenes beta estan organitzades adjacents a les altres cadenes, formant una gran xarxa d'enllaços d'hidrogen amb els seus veïns; els grups N-H d'una cadena estableixen enllaços d'hidrogen amb els grups C=O de les cadenes adjacents. En les cadenes completament esteses, les successives cadenes laterals apunten cap amunt, després cap avall, novament cap amunt, etc. Les cadenes beta contigües en una làmina beta estan alineades, per tant, els seus àtoms de Cα són adjacents i les seves cadenes laterals prenen la mateixa direcció. L'aparença de làmina plegada de la làmina beta, ve determinada per l'estructura química tetraèdrica del Cα; per exemple, si una cadena lateral apunta cap amunt, llavors el pont amb el C' ha d'apuntar lleugerament cap avall, partint que l'angle d'enllaç és 109,5°. Aquest plegament provoca que la distància entre el i el sigui aproximadament de 6 Å, en lloc dels 7,5 Å (2 × 3,8 Å) esperats dels dos enllaços peptídics trans totalment estesos. La distància lateral entre els àtoms que formen els enllaços d'hidrogen de les cadenes beta és aproximadament de 5 Å.

Això no obstant, les cadenes beta poques vegades estan perfectament esteses; generalment presenten un gir a causa de la quiralitat dels components dels seus aminoàcids. Els angles energèticament preferits prop dels angles díedres (φ, ψ) = (–135°, 135°) (en termes generals, la regió superior esquerra del diagrama de Ramachandran) difereixen significativament amb els de la conformació totalment estesa (φ, ψ) = (–180°, 180°).[1] El gir està associat habitualment amb l'alternança de les fluctuacions en els angles díedres per prevenir que les cadenes beta se separin. Podem observar un bon exemple de resistent gir beta a la proteïna BPTI. Els radicals dels aminoàcids estan orientats, aproximadament, perpendiculars al pla de la làmina; es va alternant la cara de la làmina cap a la que apunten els successius radicals.
Els patrons de l'enllaç d'hidrogen
[modifica]Així com els pèptids presenten direccionalitat, donada pel seu N-terminal i C-terminal, a les cadenes beta també se’ls pot assignar una direcció. La làmina beta és habitualment representada com una fletxa apuntant cap al C-terminal als diagrames de topologia de les proteïnes. Les cadenes beta adjacents poden formar enllaços d'hidrogen organitzats de forma paral·lela, antiparal·lela o mixta.
En una organització antiparal·lela, les cadenes beta successives alternen la seva direcció de forma que l'N-terminal d'una cadena és adjacent al C-terminal del següent. Aquesta és la conformació que produeix l'estabilitat més forta, ja que permet als enllaços d'hidrogen ser plans, l'orientació més favorable per a ells. Els angles díedres del pèptid (φ, ψ) fan més o menys (–140°, 135°) en làmines antiparal·leles. En aquest cas, si dos àtoms i són adjacents en dues cadenes beta unides, formen dos enllaços d'hidrogen amb els grups pèptid que flanquegen, això és conegut com un parell d'enllaços d'hidrogen pròxims.
En una organització paral·lela, tots els N-terminals de les successives cadenes estan orientades en la mateixa direcció; aquesta orientació deu ser lleugerament menys estable perquè provoca que els enllaços d'hidrogen entre cadenes no siguin plans. Els angles díedres (φ, ψ) són, més o menys, de (–120°, 115°) en làmines paral·leles. És poc habitual trobar menys de cinc cadenes paral·leles interaccionant en un mateix motiu o domini, cosa que suggereix que un nombre més petit de cadenes deu ser inestable. No obstant això, també és més difícil formar làmines beta paral·leles perquè les cadenes amb els N-terminal i C-terminal alineats necessàriament han d'estar molt distants en la seqüència d'aminoàcids de la proteïna. També existeix l'evidència que la làmina beta paral·lela podria ser més estable, ja que en petites seqüències amiloidogèniques sembla que generalment els agregats de làmina beta estan formats per cadenes unides principalment de forma paral·lela, on es podria esperar que formessin làmines beta de forma antiparal·lela si aquesta conformació fos més estable.
En l'estructura de làmina beta paral·lela, si dos àtoms i són adjacents en dues cadenes beta unides per enllaços d'hidrogen, no formen un enllaç d'hidrogen entre ells; en lloc d'això, un residu forma el pont d'hidrogen amb el residu que flanqueja l'altre (però no viceversa). Per exemple, el residu i formaria un enllaç d'hidrogen amb els residus i ; això és conegut com un parell d'enllaços d'hidrogen ample. Per contra, els residus podran formar enllaços d'hidrogen amb residus diferents, o amb cap en absolut.
Finalment, una cadena individual pot presentar un patró d'unió mixt, amb una cadena paral·lela a un costat, i una cadena antiparal·lela a l'altre. Aquesta organització és menys comú que la que una distribució d'orientacions aleatòria podria suggerir, deixant veure que aquest patró és menys estable que l'organització antiparal·lela. Això no obstant, les anàlisis bioinformàtiques sempre tenen dificultats per extreure la termodinàmica estructural, ja que hi ha sempre moltes altres característiques presents en la totalitat de la proteïna. Les proteïnes també estan inherentment limitades per la cinètica del seu plegament, així com de la termodinàmica d'aquest procés; per tant, sempre s'ha de tenir cura al concluir l'estabilitat segons una anàlisi bioinformàtica.
La unió de cadenes beta mitjançant enllaços d'hidrogen no necessita ser perfecta, però pot presentar interrupcions localitzades conegudes com a “beta protuberàncies” (beta bulges, en anglès). Els enllaços d'hidrogen es troben aproximadament en el pla de la làmina, amb els grups carbonil del pèptid assenyalant en direccions alternades amb els successius residus; comparant amb l'hèlix alfa, els grups carbonil a l'hèlix sempre assenyalen en la mateixa direcció.
Tendències naturals dels aminoàcids
[modifica]Els aminoàcids amb grans residus aromàtics (Tirosina, Fenilalanina i Triptòfan) i els aminoàcids amb cadena ramificada (Treonina, Valina i Isoleucina) es troben normalment a les cadenes beta del centre de les làmines. Curiosament, els aminoàcids amb altres residus (com per exemple la Prolina) normalment es troben més a les cadenes situades als extrems de la làmina, segurament per evitar l'associació d'extrems de làmines de proteïnes que sinó formarien agregats i amiloides.[2] També es suggereix que els moments dipolars en làmines beta de conformació paral·lela, la direcció de la qual és del C-terminal (parcialment negatiu) al N-terminal (parcialment positiu) podria influir la tendència de certs aminoàcids (com la Lisina o l'Arginina) pels encapçalaments d'aquesta estructura.[3]
Motius estructurals comuns
[modifica]

Un dels detalls estructurals simples que participen en la formació de la làmina β és la forquilla β. Està formada per dos filaments antiparal·lels que s'uneixen a través d'un circuit curt constituït de dos a cinc residus, un dels quals és habitualment una glicina o una prolina. Ambdós residus poden assumir la inusual conformació en angle díedre, necessària per a fer el bucle tancat. No obstant això, els filaments individuals poden també enllaçar-se de maneres més complexes, mitjançant segments més llargs de residus que poden contenir hèlixs alfa o fins i tot dominis proteics sencers.
Motiu de la clau grega
[modifica]El motiu en clau grega consisteix en una successió de filaments antiparal·lels adjacents i els seus bucles d'enllaç. Tres dels quatre filaments antiparal·lels estan connectats mitjançant forquilles, mentre que el quart és adjacent al primer i enllaçat al tercer a través d'una corba més llarga. Aquest tipus d'estructura es forma fàcilment durant el procés de plegament de la proteïna.[4][5] Fou anomenat d'aquesta manera després d'aparèixer un patró comú en obres d'art ornamental grec (vegeu meander (art)).
Motiu β-α-β
[modifica]A causa de la quiralitat dels seus aminoàcids constituents, tots els filaments presenten un gir dextrogir evident en la majoria d'estructures de l'ordre superior de les làmines beta. Particularment, els bucles d'enllaç entre dos filaments paral·lels quasi sempre tenen un encreuament quiral dextrogir, el qual és fortament influït pels girs inherents de la làmina. Aquests bucles d'enllaç, freqüentment, contenen una regió helicoide; en aquest cas rep el nom de motiu β-α-β. Aquest motiu, a la vegada, té una estreta relació amb els anomenats motius β-α-β-α, que són els constituents bàsics de la majoria d'estructures terciàries que s'han observat comunament, el barril TIM.

Motiu β-meandre
[modifica]Són un simple tipus d'estructura proteica supersecundària que es compon de dos o més β-filaments antiparal·lels consecutius enllaçats per bucles forquilla.[6][7] Aquest motiu és comú a les fulles- β i poden trobar-se també en moltes estructures, inclosos els β-barrils i les β-hèlixs.

Motiu Psi-bucle
[modifica]El motiu psi-bucle, Ψ-bucle, consisteix en dos filaments antiparal·lels amb un filament intermedi, el qual està connectat a ambdós per ponts d'hidrogen.[8] Hi ha quatre tipus possibles de filaments pels psi-bucles simples com els citats per Hutchinson et al. (1990). Aquest motiu és estrany com també ho és el seu procés de formació, el qual sembla improbable que es doni durant el plegament de la proteïna. El Ψ-bucle va ser primerament identificat en la família de les aspartat-proteases.[9]
Arquitectura estructural de les proteïnes amb làmines beta
[modifica]Les làmines beta estan presents en tots els dominis all-β, α+β i α/β, d'acord amb la Classificació Estructural de les Proteïnes, i en molts pèptids o proteïnes petites amb l'estructura general mal definida. Els dominis All-β podrien formar, beta-barrils, beta-sandvitxos, beta-prismes, beta-propellers i beta-hèlixs.
Topologia estructural
[modifica]La topologia d'una fulla beta descriu l'ordre dels ponts d'hidrogen en els beta filaments al llarg de l'estructura. Per exemple, el plegament de la flavodoxina té una làmina beta formada per cinc filaments amb topologia 21345; així, els filaments dels extrems són beta filament 2 i beta filament 5 al llarg de l'estructura. Explicat de forma explícita, el beta filament 2 fa un enllaç d'hidrogen amb el beta filament 1, el qual s'enllaça també per pont d'hidrogen al filament 3. L'últim, a la vegada, s'enllaça de la mateixa manera amb el beta filament 4 i aquest amb el beta filament 5, que és l'altre filament que es troba a l'extrem. Amb el mateix sistema, el motiu de clau grega, descrit anteriorment, té una topologia 4123. L'estructura secundària de la làmina beta pot ser descrita aproximadament donant el nombre de filaments, la seva topologia, i indicant si els seus ponts d'hidrogen són paral·lels o antiparal·lels.

Les làmines β poden ser obertes, volent dir que presenten dos filaments laterals (com en els plegaments de les flavodoxines o de les immunoglobulines) o poden ser barrils beta tancats (com el barril TIM). Els barrils- β sovint es descriuen pel seu escalonament o el seu tall. Algunes làmines β obertes, estan molt plegades i corbades sobre si mateixes (com en els dominis SH3) o en forma de ferradura (com en l'inhibidor de la ribonucleasa). Les làmines beta obertes es poden muntar encarades entre elles (com en el domini beta-propeller o en les immunoglobulines plegades) o bé disposades lateralment formant una gran làmina beta.
Característiques dinàmiques
[modifica]Les làmines beta en proteïnes potser duen a terme un moviment de baixa freqüència que recorda a un acordió, com es va observar per l'espectroscòpia de Raman[10] analitzada amb el model quasi-continuum.[11]
β hèlixs paral·leles
[modifica]
Una beta hèlix està formada a partir de la repetició d'unitats estructurals consistents en dues o tres cadenes beta enllaçades per bucles curts. Aquestes unitats s'apilen una rere l'altra seguint un model helicoidal, de manera que les successives repeticions de la mateixa cadena s'uneixen mitjançant ponts d'hidrogen, orientats paral·lelament, entre elles. Vegeu l'article de l'hèlix beta per a obtenir més informació. En les hèlixs beta levogires, les cadenes estan, per elles mateixes, bastant rectes i sense torsió; i les superfícies helicoidals resultants són gairebé planes, adoptant la forma d'un prisma triangular regular, com es mostra a la dreta per l'anhidrasa carbònica 1QRE. Altres exemples són la síntesi de l'enzim LpxA i les proteïnes anticongelants dels insectes, que mitjançant una sèrie regular de residus de Thr en una banda imiten l'estructura del gel.[12]
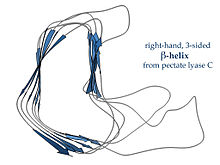
Les β hèlixs dextrogires, representades per l'enzim pectat liasa mostrat a l'esquerra o per la proteïna tailspike del virus P22, tenen una zona d'enllaç menys regular, més llarga i fragmentada en un dels costats. Dels tres bucles enllaçants, un és constantment format per dos residus i els altres són variables, sovint elaborats per formar un centre actiu o d'unió.[13] L'hèlix beta dextrogira de dues cares la trobem en alguns bacteris metaloproteases, els seus dos bucles estan formats ambdós per sis residus i s'uneixen a ions estabilitzadors de calci per preservar la integritat de la proteïna usant l'estructura central i els oxígens de les cadenes laterals d'àcid aspàrtic d'una seqüència motiu GGXGXD.[14] Aquest plegament s'anomena beta-roll en la classificació SCOP.
Patologia relacionada amb les làmines β
[modifica]Algunes proteïnes intrínsecament desorganitzades o helicoidals com els monòmers o com els beta amiloides (vegeu placa amiloide) poden formar estructures riques en làmines beta que s'associen a estats patològics. La forma oligomèrica de les proteïnes β amiloides està implicada en l'etiologia de l'Alzheimer. Però la seva estructura s'ha de determinar encara per complet, estudis recents suggereixen que podria assemblar-se a una hèlix beta atípica de dues cadenes.[15]
Les cadenes laterals dels aminoàcids trobats en una estructura de làmina beta poden ser disposades de manera que moltes de les cadenes laterals adjacents a la làmina siguin hidròfobes, mentre que a la vegada, moltes de les que són adjacents a l'altra cara de la làmina són polars o hidròfiles.[16] La qual cosa pot ser útil si la làmina ha d'actuar com a separació entre un medi polar i un medi apolar.
Vegeu també
[modifica]
Referències
[modifica]- ↑ Voet, Donald; Voet, Judith G.. Biochemistry. 3rd. Hoboken, NJ: Wiley, 2004, p. 227–231. ISBN 047119350X.
- ↑ Richardson, J.S., and Richardson, D.C. «Natural β-Sheet Proteins Use Negative Design to Avoid Edge-to-Edge Aggregation». Proc. Nat. Acad. Sci. USA, 99, 5, 2002, pàg. 2754–2759. DOI: 10.1073/pnas.052706099. PMC: 122420. PMID: 11880627.
- ↑ FarzadFard, Fahim [et al]. «β-Sheet capping: Signals that initiate and terminate β-sheet formation». Journal of Structural Biology, 161, 1, 2008, pàg. 101–110. DOI: 10.1016/j.jsb.2007.09.024. PMID: 18006332.
- ↑ Tertiary Protein Structure and Folds: section 4.3.2.1. From Principles of Protein Structure, Comparative Protein Modelling, and Visualisation
- ↑ Hutchinson EG, Thornton JM «The Greek key motif: extraction, classification and analysis». Protein Eng., 6, 3, abril 1993, pàg. 233–45. DOI: 10.1093/protein/6.3.233. PMID: 8506258.
- ↑ «SCOP: Fold: WW domain-like». Arxivat de l'original el 2012-02-04. [Consulta: 16 novembre 2011].
- ↑ «PPS '96 - Super Secondary Structure». Arxivat de l'original el 2016-12-28. [Consulta: 16 novembre 2011].
- ↑ Hutchinson, E.; Thornton, J. «PROMOTIF—A program to identify and analyze structural motifs in proteins». Protein Science, 5, 2, 1996, pàg. 212–220. DOI: 10.1002/pro.5560050204. PMC: 2143354. PMID: 8745398.
- ↑ Hutchinson EG, Thornton JM «HERA--a program to draw schematic diagrams of protein secondary structures». Proteins, 8, 3, 1990, pàg. 203-12. DOI: 10.1002/prot.340080303. PMID: 2281084.
- ↑ Painter PC, Mosher LE, Rhoads C «Low-frequency modes in the Raman spectra of proteins». Biopolymers, 21, 7, July 1982, pàg. 1469–72. DOI: 10.1002/bip.360210715. PMID: 7115900.
- ↑ Chou KC «Low-frequency motions in protein molecules. Beta-sheet and beta-barrel». Biophys. J., 48, 2, August 1985, pàg. 289–97. DOI: 10.1016/S0006-3495(85)83782-6. PMC: 1329320. PMID: 4052563.
- ↑ Liou, Y.C. et al. «Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein». Nature, 406, 6793, 2000, pàg. 322–324. DOI: 10.1038/35018604. PMID: 10917536.
- ↑ Branden, Carl; Tooze, John. Introduction to Protein Structure. Nova York: Garland, 1999, p. 20–32. ISBN 0815323050.
- ↑ Bauman, U. et al. «Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif». EMBO Journal, 12, 9, 1993, pàg. 3357–3364. PMC: 413609. PMID: 8253063.
- ↑ Nelson R, Sawaya MR, Balbirnie M, Madsen AØ, Riekel C, Grothe R, Eisenberg D «Structure of the cross-beta spine of amyloid-like fibrils». Nature, 435, 7043, June 2005, pàg. 773–8. DOI: 10.1038/nature03680. PMC: 1479801. PMID: 15944695.
- ↑ SHUGUANG ZHANG, TODD HOLME, CURTIS LOCKSHIN, AND ALEXANDER RICH. PNAS April 15, 1993 vol. 90 no. 8 3334-3338
Bibliografia
[modifica]- Cooper, J. "Super Secondary Structure - Part II" Arxivat 2016-12-28 a Wayback Machine., May 31, 1996. Accessed May 25, 2007.
- Structural Classification of Proteins (SCOP) "Open-sided Beta-meander" Arxivat 2012-02-04 a Wayback Machine., October 20, 2006. Accessed May 31, 2007.
Altres links
[modifica]- NetSurfP - Secondary Structure and Surface Accessibility predictor
- Interactive model of an anti-parallel β sheet Arxivat 2012-03-15 a Wayback Machine. (plug-in required)
- Interactive model of a parallel β sheet Arxivat 2012-07-04 a Wayback Machine. (plug-in required)
- Animated details of β-pleated sheet[Enllaç no actiu]
- Monooxygenase







