Lactama
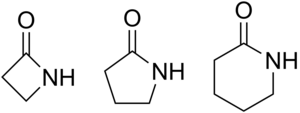 β-lactama, γ-lactama i δ-lactama | |
| Substància química | classe estructural d'entitats químiques |
|---|---|
Una lactama és una amida cíclica, això és un compost orgànic de la classe de les amides caracteritzat pel fet que el nitrogen del grup amida forma part de la cadena de carbonis cíclica que comença en el carboni del grup amida. Contenen el grup funcional . Llurs tautòmers contenen el grup , i s'anomenen lactimes. Es troben en purines, pirimidines i altres substàncies.[1]

S'empren en la síntesi de poliamides i com antibiòtics. En destaca la penicil·lina, descoberta l'any 1929 per Alexander Fleming (1881–1955), que representa una fita en la història de la medicina, ja que la seva introducció com a fàrmac als anys quaranta del segle xx revolucionà el tractament de les infeccions bacterianes.[2]
Etimologia
[modifica]

El mot «lactama» prové dels mots «lact(ona)» i «am(id)a», pel fet que les lactames tenen una estructura cíclica com les lactones, èsters cíclics, i pel fet tenir com a grup funcional el grup amida.[3] Per altra banda, el mot «lactima» prové de «lact(ona)» i «im(id)a», ja que les imides contenen el grup . Ambdós termes foren encunyats el 1882 pel químic alemany Adolf von Baeyer (1835–1917) i Spir. Oekonomides en un treball on estudiaren l'estructura de l'indi i la del compost de la seva oxidació, la isatina, essent la forma de lactima més estable que la de lactama.[4][5]
Estat natural
[modifica]
A la natura hom troba compostos que contenen anells de β, γ i δ-lactames, això és anells de quatre, cinc i sis àtoms (un nitrogen i la resta carbonis).
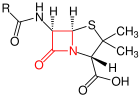
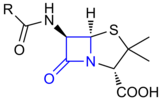
La penicil·lina fou el primer compost β-lactàmic descobert a partir de floridures de fongs Penicillium, principalment P. chrysogenum i P. rubens, i després es varen continuar descobrint tota una família de productes naturals caracteritzats per la possessió del distintiu anell β-lactàmic de quatre membres. Els estudis biosintètics han demostrat que la classe de productes naturals β-lactàmics es pot dividir en almenys quatre subgrups diferents segons l'origen de l'anell β-lactàmic. Aquests grups es denominen penicil·lines/cefalosporines, clavams, carbapenems i compostos monobactàmics.[2]
-
Fórmula general de les penicil·lines.
-
Estructura de l'àcid clavulànic, un clavam.
-
Estructura general dels carbapenems.
-
Estructura del tigemonam, un monobactàmic.

L'anell de γ-lactama està present en un gran nombre de compostos naturals biològicament actius. El ventall d'activitats biològiques cobertes per aquests compostos és molt ampli. S'han aïllat de fongs, com ara la codinaeopsina, de bacteris, per exemple la salinosporamida A i de plantes, com la cinometrina.[6] També s'han aïllat alguns compostos que contenen anells de δ-lactama de les fulles de Clausena lansium.[7]
-
Salinosporamida A.
-
Cinometrina.
Nomenclatura
[modifica]-
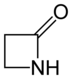
Trihidroazeta-2-ona, azetidina-2-ona o propano-3-lactama.
-
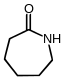
Hexahidroazepina-2-ona o hexano-6-lactama o caprolactama.
Les lactames i les lactimes s’anomenen com a cetones de compostos heterocíclics de nitrogen o, també, fent servir «–lactama» o «–lactima», respectivament, en substitució del sufix «–amida» després del nom de la cadena de carbonis i amb el corresponent localitzador.[1]
Tradicionalment, per indicar la mida de l'anell s'han utilitzat com a prefixos les lletres gregues α, β, γ, δ, etc. per referir-se a un anell de 3, 4, 5, 6, etc. àtoms, respectivament.
Síntesi
[modifica]Existeixen diversos mètodes per a la síntesi orgànica de les lactames. Els més importants són els següents.
Síntesi de Staudinger
[modifica]
La síntesi de Staudinger, també anomenada cicloaddició de cetè-imina de Staudinger, és una síntesi química en la qual una imina reacciona amb un cetè mitjançant una cicloaddició 2+2 no-fotoquímica per produir una β-lactama.[8] Aquesta reacció fou descoberta l'any 1907 pel químic alemany Hermann Staudinger (1881–1965).[9] La reacció no trobà cap aplicació fins a la dècada de 1940, quan es dilucidà l'estructura de la penicil·lina. La part β-lactama de la primera penicil·lina sintètica se sintetitzà mitjançant aquesta cicloaddició,[10] i continua sent una eina valuosa en química orgànica sintètica.

Reacció de Kinugasa
[modifica]A la reacció de Kinugasa, una nitrona i un acetílid de coure reaccionen per formar, finalment, una β-lactama. És una cicloaddició 1,3-dipolar. Aquesta síntesi fou descrita pel químic japonès Manabu Kinugasa, de la Universitat Doshisha de Kyoto, el 1972.[11]
Reacció de Schmidt
[modifica]
La reacció de Schmidt és una reacció orgànica en la qual una azida reacciona amb un derivat del carbonil, generalment un aldehid, cetona o àcid carboxílic, en condicions àcides per generar l'àcid hidrazoic i donar una amina o amida, amb expulsió de nitrogen. Porta el nom del químic alemany Karl Friedrich Schmidt (1887–1971), que la comunicà per primera vegada el 1924 convertint amb èxit la benzofenona i l'àcid hidrazoic en benzanilida. Si s'empra una cetona cíclica, s'obtenen lactames.[12]
Condensació intramolecular
[modifica]
Les lactames es poden sintetitzar per condensació intramolecular entre un grup carboxi i un grup amino present a la mateixa molècula. Les lactames es generen fàcilment quan es forma un anell de cinc àtoms (γ-lactames) o un anell de sis àtoms (δ-lactames). Les β-lactames no es formen com a resultat de l'eliminació tèrmica de l'aigua entre i de la mateixa molècula.[13]
Aplicacions
[modifica]Antibiòtics
[modifica]Les β-lactames constitueixen el 65 % dels antibiòtics que s'empren en l'actualitat en medicina i en veterinària. Algunes són naturals, com la penicil·lina G o benzilpenicil·lina, i d'altres s'han sintetitzat modificant les estructures naturals, com l'amoxicil·lina. El seu ampli ús és degut a la seva excel·lent eficàcia contra les infeccions bacterianes, la seva alta velocitat d'acció, la seva baixa toxicitat i la seva sinergia amb altres antibiòtics.[14]
-
Penicil·lina, fórmula general.
-
Publicitat dels efectes de la penicil·lina.
-
Càpsules d'amoxicil·lina.
-
Comprimits d'amoxicil·lina i àcid clavulànic.
Síntesi de poliamides
[modifica]
Les lactames, especialment la butano-3-lactama o butirolactama, la pentano-4-lactama o valerolactama i l'hexano-5-lactama o caprolactama són substàncies químiques importants en la indústria química perquè s'usen com a monòmers per a la fabricació de poliamides. La lactama C6, la caprolactama, s'ha utilitzat més àmpliament per fabricar poliamida-6, també coneguda com a niló 6, un dels materials de construcció més significatius utilitzats a les indústries. Altres dues lactames, butirolactama i valerolactama, també s'utilitzen per fer diversos polímers com la poliamida-4, la poliamida-5 i la poliamida-6.[15]
Vegeu també
[modifica]- β-lactam, present en l'estructura de molts antibiòtics, entre ells, la penicil·lina.
- Lactona, un èster cíclic.
- Caprolactama
Referències
[modifica]- ↑ 1,0 1,1 Unió Internacional de Química Pura i Aplicada. Comissió de Nomenclatura de Química Orgànica. Guia de la IUPAC per a la nomenclatura de compostos orgànics : recomanacions del 1993 (incloent-hi les revisions, tant publicades com no publicades fins ara, de l'edició del 1979 de la Nomenclature of organic chemistry), febrer del 2017. ISBN 978-84-9965-333-4.
- ↑ 2,0 2,1 Tooke, Catherine L.; Hinchliffe, Philip; Bragginton, Eilis C.; Colenso, Charlotte K.; Hirvonen, Viivi H. A. «β-Lactamases and β-Lactamase Inhibitors in the 21st Century» (en anglès). Journal of Molecular Biology, 431, 18, 23-08-2019, pàg. 3472–3500. DOI: 10.1016/j.jmb.2019.04.002. ISSN: 0022-2836. PMC: PMC6723624. PMID: 30959050.
- ↑ «lactam - WordReference.com Dictionary of English» (en anglès). [Consulta: 20 abril 2022].
- ↑ Partington, J. R.. History of Chemistry. Londres: Macmillan Education, Limited, 1964. ISBN 978-1-349-00554-3.
- ↑ Baeyer, Adolf; Oekonomides, Spir. «Ueber das Isatin» (en anglès). Berichte der deutschen chemischen Gesellschaft, 15, 2, 7-1882, pàg. 2093–2102. DOI: 10.1002/cber.188201502145. ISSN: 0365-9496.
- ↑ Caruano, J.; Muccioli, G. G.; Robiette, R. «Biologically active γ-lactams: synthesis and natural sources» (en anglès). Organic & Biomolecular Chemistry, 14, 43, 2016, pàg. 10134–10156. DOI: 10.1039/C6OB01349J. ISSN: 1477-0520.
- ↑ Shen, De-Yang; Nguyen, Thi Ngan; Wu, Shwu-Jen; Shiao, Young-Ji; Hung, Hsin-Yi «γ- and δ-Lactams from the Leaves of Clausena lansium». Journal of Natural Products, 78, 11, 02-11-2015, pàg. 2521–2530. DOI: 10.1021/acs.jnatprod.5b00148. ISSN: 0163-3864.
- ↑ Li, Jie Jack. Name reactions for carbocyclic ring formations. Hoboken, N.J.: Wiley, 2010. ISBN 978-0-470-87221-5.
- ↑ Staudinger, Hermann «Zur Kenntniss der Ketene. Diphenylketen» (en alemany). Justus Liebig's Annalen der Chemie, 356, 1-2, 1907, pàg. 51–123. DOI: 10.1002/jlac.19073560106.
- ↑ Sheehan, John C.; Buhle, Emmett L.; Corey, Elias J.; Laubach, Gerald D.; Ryan, James J. «THE TOTAL SYNTHESIS OF A 5-PHENYL PENICILLIN: METHYL 5-PHENYL-(2-CARBOMETHOXYETHYL)-PENICILLINATE» (en anglès). Journal of the American Chemical Society, 72, 8, 8-1950, pàg. 3828–3829. DOI: 10.1021/ja01164a534. ISSN: 0002-7863.
- ↑ Kinugasa, Manabu; Hashimoto, Shizunobu «The reactions of copper(I) phenylacetylide with nitrones» (en anglès). Journal of the Chemical Society, Chemical Communications, 8, 01-01-1972, pàg. 466–467. DOI: 10.1039/C39720000466. ISSN: 0022-4936.
- ↑ Laue, Thomas; Plagens, Andreas. Named organic reactions. J. Wiley & Sons, 2005. ISBN 0-470-01040-1.
- ↑ Moldoveanu, Serban C. Chapter 14 - Pyrolysis of Various Derivatives of Carboxylic Acids (en anglès). Elsevier, 2019, p. 635–696. DOI 10.1016/b978-0-444-64000-0.00014-7. ISBN 978-0-444-64000-0.
- ↑ Janecki, Tomasz. Natural lactones and lactams: synthesis, occurrence and biological activity. Weinheim, Germany: John Wiley & Sons, 2014. ISBN 978-3-527-33414-8.
- ↑ Liu, Yuzhong; Gan, Fei; Cruz-Morales, Pablo; Keasling, Jay D. 6.16 - Engineering Natural Product Biosynthetic Pathways to Produce Commodity and Specialty Chemicals (en anglès). Oxford: Elsevier, 2020, p. 352–376. DOI 10.1016/b978-0-12-409547-2.14825-5. ISBN 978-0-08-102691-5.