Malaltia d'Alexander
 | |
| Tipus | leucodistròfia, malaltia neurodegenerativa hereditària, malaltia degenerativa dels ulls, malaltia autosòmica dominant i malaltia |
|---|---|
| Epònim | William Stewart Alexander (en) |
| Especialitat | endocrinologia i neurologia |
| Patogènesi | |
| Associació genètica | GFAP (en) |
| Classificació | |
| CIM-11 | 8A44.2 |
| CIM-10 | E75.2 |
| CIM-9 | 331.89 |
| Recursos externs | |
| Enciclopèdia Catalana | 0002350 |
| OMIM | 203450 |
| DiseasesDB | 30685 |
| MeSH | D038261 |
| GeneReviews | Panoramica |
| Orphanet | 58 |
| UMLS CUI | C0270726 |
| DOID | DOID:4252 |
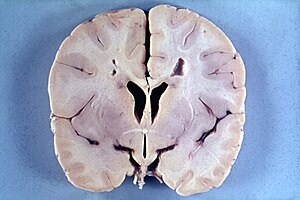
La malaltia d'Alexander és una malaltia genètica extremadament rara, normalment d'aparició en la infància i pertanyent al grup de les leucodistròfies. Aquest grup de malalties neurològiques es caracteritza per la destrucció progressiva de la substància blanca del cervell. La malaltia d'Alexander es manifesta per l'aparició de retard mental i anormalitats físiques, especialment macrocefàlia, per la presència de fibres de Rosenthal i patrons de neuroimatge característics. La malaltia progressa fins a un desenllaç mortal en la major part dels casos. La malaltia rep el nom pel patòleg neozelandès William Stuart Alexander, que va descriure la síndrome el 1949 juntament amb la professora Dorothy Rusell en el London Hospital.[1]
Epidemiologia
[modifica]La prevalença de la malaltia és desconeguda. La major part dels casos es donen de forma esporàdica, sense que existeixi un historial familiar de propensió a la malaltia. Entre altres coses, això significa que els pares que tenen un fill amb la malaltia, tenen una probabilitat molt baixa que següents fills la tinguin, no obstant això, existeixen algunes famílies amb més d'un fill afectat. És possible que existeixi una heretabilitat de la propensió a patir mutacions "de novo" en general en la descendència. Així mateix, existeixen dos casos de famílies en què la malaltia s'hereta de forma dominant.[2] En tots dos, l'aparició és posterior als 25 anys. Fins al 2005 existien tan sols 57 casos descrits. S'han publicat 500 casos des de la seva descripció el 1949.[3]La malaltia és més freqüent en dones (proporció 3:1). És una malaltia degenerativa.
Etiologia
[modifica]
En principi, es va observar l'acumulació en el cervell entorn dels astròcits i a la barrera hematoencefàlica d'unes estructures característiques eosinòfiles i vermiformes que es van cridar fibres de Rosenthal, en honor del patòleg alemany Werner Rosenthal qui les va descriure en 1989 en la siringomielia. Aquestes estructures eren riques en PAFG i en una proteïna de xoc tèrmic anomenada α-B-Cristal·lina.
L'alteració subjacent va ser caracteritzada el 2001 per Messing i col·laboradors.[4] Es tracta d'una malaltia de caràcter genètic autosòmica dominant, originada en la major part dels casos per una mutació puntual de novo en el gen de la proteïna àcida fibrilar glial. Aquest gen està situat en la banda q21 del cromosoma 17 (17 q21). Li i col·laboradors van observar que en 24 de 28 casos del seu estudi, el cromosoma portador és el patern, amb el que sembla que la mutació es dona molt més en l'espermiogènesis que durant el desenvolupament embrionari. Sembla que no hi ha una relació amb l'edat del pare.[5]S'han descrit més de 49 mutacions o al·lels patològics que poden desencadenar la malaltia:
- Diana Rodríguez i diversos col·laboradors van trobar en nou pacients mutacions en el domini central en forma de bastó de la proteïna, habitualment en els segments 1A, 2A i 2B. La major part donaven canvis en residus arginina (quatre en la posició R79H, quatre en R239C i una en R239H, 2R88C i 1R88S, aquestes dues últimes desconegudes fins a aquest moment). Els dos casos restants de l'estudi afectaven a altres aminoàcids (1L76F i 1N77I). L'aminoàcid afectat semblava determinar la severitat del curs de la malaltia.[6]
- En 2007 Meins i col·laboradors van detectar altres mutacions puntuals en un altre domini (la posició del qual està propera al C terminal de la proteïna) que determinaven l'aparició primerenca de la malaltia, en concret A364 V i I366C. Es va observar que mutacions idèntiques en uns altres filaments intermedis, per exemple en la queratina, donaven lloc a problemes similars, amb el que se suggereix que aquestes seqüències són crítiques per a l'estabilitat d'aquests filaments.[7]
Patogènia
[modifica]Fins avui, el mecanisme proposat més acceptat per explicar la malaltia seria el següent:[8]
- L'acumulació de proteïna àcida fibrilar glial (PAFG) i la consegüent formació d'agregats característics, denominats fibres de Rosenthal en diversos tipus cel·lulars, i especialment els astròcits. Sembla que l'acumulació es deu a un guany de funció per causa de la mutació que bloqueja parcialment l'assemblatge dels filaments de PAFG.[9]
- Segrest posterior d'ubiquitina i les proteïnes xaperones α-B-cristal·lina i HSP27 en les fibres de Rosenthal.
- Activació tant de la proteïna Jnk com de la resposta d'estrès.
Anatomia patològica
[modifica]
La malaltia d'Alexander és primàriament una alteració dels astròcits, que formen part de les cèl·lules de suport de les neurones (neuròglia). Entre els astròcits, els més comuns en la substància blanca són els de tipus fibrós.[10]Aquests últims es caracteritzen perquè en el seu citoesquelet contenen un filament intermedi, la ja esmentada PAFG, que en mutar construeix una estructura proteica defectuosa. Aquesta s'emmagatzema juntament amb la ubiquitina i altres dues proteïnes de xoc tèrmic, les ja conegudes fibres de Rosenthal. Es poden localitzar en tot el sistema central, tant en el cervell com en la medul·la espinal, però especialment en el veïnatge dels vasos sanguinis de la superfície del cervell. Les imatges per microscòpia electrònica mostren un vincle estret entre les fibres de Rosenthal i els filaments intermedis. A més existeix desmielinització histològicament parlant en els afectats tardans, o absència de mielinització en els nens. Es troben afectades igualment les fibres sensorials i les motores. En l'aparició primerenca amb macrocefàlia és comuna la degeneració de la substància blanca i de vegades s'acompanya també d'hidrocefàlia.
No obstant això, les àrees desmielinitzades no coincideixen amb la distribució de les fibres de Rosenthal, per això sembla que la desmielinització i l'aparició de fibres semblen ser manifestacions independents de la malaltia. No obstant això s'assumeix que la desmielinització es produeix per la degeneració final dels astròcits.
| Taula1: QUADRE CLÍNIC de malalts diagnosticats mitjançant MRI de malaltia d'Alexander en una mostra de 5 i 14 pacients respectivament, segons van der Knaap i d'altres[11] | ||
|---|---|---|
| Signes observats | Variant infantil | variant juvenil |
| Nº de pacients | 5 | 14 |
| Edat de primeres manifestacions | naixement a 4 setmanes | <2 anys |
| Retard desenvolupament motor | sever(5) | sever(2)moderat(11)no observat(1) |
| Principal indicador motor | cap(3)agafar(2) | marxa(12)asseure's(2) |
| Retard desenvolupament mental | Sever(5) | moderat(13) |
| Problemes de conducta | 2 | 9 |
| Epilèpsia | Severa (5) | Moderada (11) |
| Problemes d'alimentació | 5 | 12 |
| Vòmits | 5 | 6 |
| Dificultats per empassar/asfíxia | 4 | 11 |
| guany pes insuf | 5 | 5 |
| Problemes de parla | 2, no aplicable en 3 | 14 |
| Macrocefàlia | 4,98º percentil en 1 | 9,98º percentil en 2/no obs. en 3 |
| Pobre contacte visual | 5 | 0 |
| Hipotonia | Generalitzada (2) axial(3) |
Generalitzada (3) |
| Hipertonia de membres | 3 | 8 |
| Hiperreflexia | 5 | 14 |
| Atàxiacerebel·lar | No comprovable | 12 |
| Signes extrapiramidals | 3 | 3 |
| Deterioració | ràpid(3)moderat(2) | lent(11)moderat(1) |
| Edat de defunció | 4 mesos a 2¹/₂ anys | 7-18 anys en 4 casos |
Quadre clínic
[modifica]La malaltia té diverses formes que difereixen en el seu quadre clínic i en l'edat d'aparició, tenint totes elles el tret distintiu de la degeneració fibrinoide dels astròcits amb fibres de Rosenthal. Des de 1976 es reconeixen tres formes de la malaltia:[12]
- Forma infantil:
- Apareix des del naixement fins als 2 anys.
- És la més comuna.
- Pot cursar amb o sense macroencefàlia, encara que el més corrent és que aparegui (Rodríguez, 2001).
- S'observen atacs i retard o involució en el desenvolupament. La funció motora es deteriora progressivament fins a la cuadriparesis i espasticidad.
- Hidrocefàlia, en ocasions associada a estenosi de l'aqüeducte de Silvio.[13] Encara que no s'ha observat associació entre l'estenosi i l'acumulació de fibres de Rosenthal.
- Retard mental profund en la majoria dels casos, encara que de vegades no s'ha observat.
- Atàxia i atacs epilèptics.
- vòmits i elevada tensió intracraneal.
- Forma juvenil:[14]
- Comença en l'edat escolar, als 9,5 anys de mitjana
- La simptomatologia consisteix principalment en paraplegia espàstica i signes bulbars progressius.
- Normalment es preserven les funcions cognitives.
- Dificultats per empassar o parlar, vòmits, atàxia i/o espasticitat.
- Pot donar-se cifescoliosi
- Mentre la forma infantil afecta generalment al cervell, la juvenil afecta més al tronc cerebral. Hi ha moltes fibres de Rosenthal, però la desmielinització és menys important que en la forma infantil.
- Forma adulta:
- És la forma més benigna i rara de la malaltia. S'han observat casos d'aparició fins als 36 anys. Recorda a l'esclerosi múltiple o un tumor.
- L'atàxia és molt freqüent, així com dificultats de parla, deglució i problemes en el somni.
- Els símptomes són similars a la malaltia juvenil, però més suaus.
Diagnòstic
[modifica]El diagnòstic havia estat durant molt temps difícil, a causa que la majoria dels signes podien donar-se també en altres leucodistròfies, de manera que la prova diagnòstica de confirmació consistia en una biòpsia cerebral que revelés les fibres de Rosenthal. En ocasions això s'efectuava post mortem en la necròpsia. No obstant això, aquesta prova resulta bastant invasiva i es va veure la necessitat de buscar altres possibilitats aprofitant les noves tècniques d'imatge per MRI. El març de 2001 l'eminent neuròloga Marjo van der Knaap i el seu equip van poder establir una sèrie de criteris que provaven en un 90% dels casos l'existència de la malaltia.[11] Es considera que la presència d'almenys 4 dels següents criteris donen un resultat diagnòstic positiu:
- Presència d'anormalitats extenses en la matèria blanca amb una preponderància frontal o bé quant a l'extensió d'aquestes anormalitats, en el grau d'inflor, en el grau de canvi de senyal o en el de pèrdua de teixit (per atròfia o degeneració cística).
- Presència d'una vora periventricular de descens d'intensitat de senyal en les imatges potenciades en T2 i elevació de la intensitat en imatges potenciades en T1.
- Anormalitats en els ganglis basals i tàlems, consistents en una elevació en la intensitat del senyal i inflor o en atròfia i augment o descens de la intensitat del senyal en imatges potenciades en T2.
- Anormalitats en el tronc encefàlic, en particular incloent el cervell mitjà i la medul·la.
- Augment de contrast que implica un o més de les següents estructures: bord ventricular, cèrcol de teixit periventricular, substància blanca dels lòbuls frontals, quiasma òptic, fòrnix, ganglis basals, tàlem, nucli dentat i estructures troncoencefàliques.
Referències
[modifica]- ↑ Alexander W (1949) Progressive fibrinoid degeneration of fibrillary astrocytes associated with mental retardation in a hydrocephalic infant. Brain 72:373–381 PMID: 15409268
- ↑ Schwankhaus JD, Parisi JE, Gulledge WR, Chin L, Currier RD (1995) Hereditary adult-onset Alexander's disease with palatal myoclonus, spastic paraparesis, and cerebellar atàxia. Neurology 45:2266?2271 PMID: 8848205
- ↑ Malaltia d'Alexander en Genetics Home Reference
- ↑ Brenner M, Johnson AB, Boespflug-Tanguy O, Rodriguez D, Goldman JE, Messing A (2001) Mutations in GFAP, encoding glial fibrillary acidic protein, are associated with Alexander disease. Nature Genet 27:117?120 PMID: 11138011
- ↑ Li, R.; Johnson, A. B.; Salomons, G. S.; van der Knapp, M. S.; Rodriguez, D.; Boespflug-Tanguy, O.; Gorospe, J. R.; Goldman, J. I.; Messing, A.; Brenner, M. : Propensity for paternal inheritance of de novo mutations in Alexander disease. Hum. Genet. 119: 137-144, 2006. PMID: 16365765
- ↑ RODRIGUEZ D i uns altres: Infantile Alexander disease: spectrum of GFAP mutations and genotype-phenotype correlation Am J Hum Genet. 2001 Nov;69(5):1134-40 PMID: 11567214
- ↑ MEINS, M i uns altres: Novell mutations in exon 6 of the GFAP gene affect a highly conserved if motif in the rod domain 2B and are associated with early onset infantile Alexander disease. Neuropediatrics. 2007 Jun;38(3):143-7 PMID: 17985264
- ↑ Quinlan RA, Brenner M, Goldman JE i Messing A: GFAP and its role in Alexander disease. Exp Cell Res. 2007 Jun 10;313(10):2077-87 PMID: 17498694
- ↑ JOHNSON, AB: Alexander disease: a review and the gene. Int J Dev Neurosci. 2002 Jun-Aug;20(3-5):391-4 PMID: 12175878
- ↑ Fawcet, D i Jensh, RP: Compendio de Histología. McGraw-Hill-Interamericana,1999 pàgs. 123-124 ISBN 84-486-0264-1
- ↑ 11,0 11,1 van der Knaap, MS i uns altres: Alexander Disease:Diagnosi with MR Imaging. AJNR Am J Neuroradiol 22:541-552, març de 2001
- ↑ Russo LS Jr, Aron A, Anderson PJ: Alexander's disease: a report and reappraisal. Neurology. 1976 Jul;26(7):607-14 PMID: 180453
- ↑ Ni Q, Johns GS, Manepalli A, Martin DS, Geller TJ:Infantile Alexander's disease: serial neuroradiologic findings. J Child Neurol. 2002 Jun;17(6):463-6 PMID: 12174972
- ↑ Diana Rodríguez sobre la malaltia d'Alexander en Orphanet
Bibliografia
[modifica]- Lazzarini, RA: Myelin Biology and Disorders. Academic Press, 2004 páginas 851 y stes. ISBN 0-12-439510-4
- The Official Parent's Sourcebook on Alexander Disease: Updated Directory for the Internet Age. Icon Health Publications, edición revisada (diciembre de 2003) ISBN 0-597-83776-7. Manual de referencia en investigación, diagnosis y consejos para padres y cuidadores.
- Parker, PM: Alexander Disease - A Bibliography and Dictionary for Physicians, Patients, and Genome Researchers. ICON Group International, Inc. (19 de julio de 2007) ISBN 0-497-11320-1.
