Metanotiol
 Cilindre de metanotiol gasós | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 48,003 Da |
| Trobat en el tàxon | |
| Estructura química | |
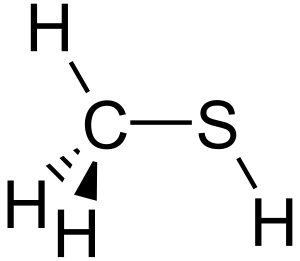
| Fórmula química | CH₄S |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 0,9 g/cm³ (a 32 °F, líquid) |
| Solubilitat | 2 g/100 g (aigua, 20 ℃) |
| Moment dipolar elèctric | 1,52 D |
| Punt de fusió | −121 ℃ −123 ℃ |
| Punt d'ebullició | 6 ℃ (a 760 Torr) 5,96 ℃ (a 101,325 kPa) |
| Moment dipolar elèctric | 1,52 D |
| Pressió de vapor | 1,7 atm (a 20 ℃) |
| Perill | |
| Límit inferior d'explosivitat | 3,9 % (V/V) |
| Límit superior d'explosivitat | 21,8 % (V/V) |
| Límit d'exposició sostre | 1 mg/m³ (cap valor) 20 mg/m³ (Estats Units d'Amèrica) |
| Punt d'inflamabilitat | 0 °F |
| IDLH | 296 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Altres | |
| gas inflamable | |
El metanotiol (també conegut com a metil mercaptan) és un gas incolor amb una olor com a col podrida. És una substància natural que es troba a la sang i el cervell en els humans i altres animals com també en teixits vegetals. Es troba en la femta. Es troba de manera natural en alguns aliments, com en alguns fruits secs en núcula i formatges. També és un dels productes químics responsables del mal alè i la pudor de les ventositats. La seva fórmula química és CH₃SH; està classificat com un tiol. De vegades apareix abreujat com MeSH. És molt inflamable.
Presentació
[modifica]El metanotiol s'allibera de la matèria orgànica en descomposició en aiguamolls i es troba en el gas natural de certes regions, en derivats del carbó i en alguns petrolis crus.
En la superfície de l'aigua marina, el metanotiol és el principal producte de la degradació del metabòlit de les algues anomenat dimetilsulfoniopropionat (DMSP). Els bacteris marins sembla que obtenen la majoria del sofre de les seves proteïnes per la degradació del DMSP i la incorporació de metanotiol malgrat que la proporció d'aquest en l'aigua marina és molt menor que la de sulfat. Tant DMS com el metanotiol el poden usar certs microbis com substrat per la metanogènesi en alguns sòls anaeròbis. El metanotiol és un àcid feble amb un pKa de ~10.4. Aquesta acidesa el permet reaccionar ambmetalls dissolts en solucions aquoses.
L'olor penetrant del metanotiol proporcina avís de concentracions perilloses. S'ha informat d'un llindar d'1 part per milió.[1]
Preparació
[modifica]Comercialment el metanotiol es prepara reaccionant metanol amb sulfur d'hidrogen gasós.[2] I es pot preparar reaccionant iodur de metil amb tiourea.[3]
Usos
[modifica]El principal ús del metanotiol és per produir metionina, la qual es fa servir de component dietètic en pinsos.[2] També es fa servir el metanotil en els plàstics i precursor de pesticides. És un subproducte de la polpa de la fusta per a fer paper.
Algunes bombes pudentes tenen el metanotiol com a component.
Espàrrecs
[modifica]El metanotiol és un subproducte del metabolismes dels espàrrecs.[4][5] El canvi de l'olor de l'orina després de menjar espàrrecs, en la qual intervé el metanotiol, triga 15 minuts.[6]
Referències
[modifica]- ↑ Devos, M; F. Patte, J. Rouault, P. Lafort, L. J. Van Gemert. Standardized Human Olfactory Thresholds. Oxford: IRL Press, 1990, p. 101. ISBN 0199631468.
- ↑ 2,0 2,1 Norell, John; Louthan, Rector P. «Thiols». A: Kirk-Othmer Concise Encylclopedia of Chemical Technology. 3rd. Nova York: John Wiley & Sons, Inc., 1988, p. 946–963. ISBN 978-0471801047.
- ↑ Reid, E. Emmet. Organic Chemistry of Bivalent Sulfur. 1. Nova York: Chemical Publishing Company, Inc., 1958, p. 32–33,38.
- ↑ Richer, Decker, Belin, Imbs, Montastruc, Giudicelli: "Odorous urine in man after asparagus" Arxivat 2013-08-01 at Archive.is, British Journal of Clinical Pharmacology, May 1989
- ↑ Lison M, Blondheim SH, Melmed RN. «A polymorphism of the ability to smell urinary metabolites of asparagus». Br Med J, 281, 6256, 1980, pàg. 1676. DOI: 10.1136/bmj.281.6256.1676. PMC: 1715705. PMID: 7448566.
- ↑ «Skinny On : Discovery Channel». Arxivat de l'original el 2008-02-29. [Consulta: 28 octubre 2012].
