Nitrat de sodi
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 84,978 Da |
| Rol | cancerigen |
| Estructura química | |
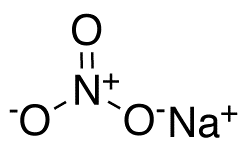
| Fórmula química | NaNO₃ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 2,257 g/cm³ |
| Punt de fusió | 308 ℃ 307 ℃ |
| Punt de descomposició | 380 ℃ |
| Entalpia estàndard de formació | −257 kJ/mol |
| Perill | |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Identificador Kemler | 50 |
El nitrat de sodi és un compost químic inorgànic de fórmula , una sal constituïda per anions nitrat i cations sodi enllaçats mitjançant enllaç iònic. Aquesta sal també es coneix amb el nom de salpetre de Xile o salnitre de Xile perquè pràcticament només existeixen grans dipòsits naturals al desert d'Atacama al nord de Xile.[1] El salpetre ordinari és el nitrat de potassi . La forma mineral també es coneix com a nitratina.
El nitrat de sodi és un sòlid blanc molt soluble en aigua. És una font de fàcil accés de l'anió nitrat, útil en diverses reaccions realitzades a escala industrial per a la producció d'adobs, pirotècnia i bombes de fum, vidre i esmalts de ceràmica, conservant d'aliments i propulsor sòlid de coets. Ha estat minat àmpliament amb aquests propòsits.
Estat natural i obtenció
[modifica]
Hi ha grans dipòsits del mineral nitratina, constituïda per nitrat de sodi, al desert d'Atacama, al nord de Xile, una regió de gairebé 650 km de nord a sud i de 50 a 65 km d'ample. La nitratina es troba damunt la roca sedimentària calitx, amb gruixes que van d'uns pocs centímetres fins a un metre o més. El calitx és generalment de mig a vint metres per sota de la superfície. Els dipòsits sovint contenen traces de iodat, perclorat, cromat i dicromat, espècies altament oxidades poques vegades trobades en altres llocs a la natura.

L'origen d'una quantitat tan gran de nitrat de sodi s'ha investigat àmpliament, però no hi ha consens. L'únic acord és que el desert d'Atacama és tan sec que en formar-se el nitrat de sodi no es renta per precipitacions o nevades. A causa de la coneguda formació de nitrat dels fems, un dels primers suggeriments fou que els nitrats es produïen a partir de guano fòssil. Tanmateix s'ha demostrat que no hi ha hagut suficient guano. Els dipòsits d'Atacama foren considerats únics fins al 1962 quan es descobrí un dipòsit similar al llarg del marge occidental del mar de Ross a l'Antàrtida. La zona és seca, ventosa, a uns 600 metres sobre la mar i no conté cap guano fòssil. Com el dipòsit d'Atacama el nitrat de sodi es produeix en un calitx de tres a cinc centímetres per sota de la superfície i conté traces de iodat.[2]
Malgrat se segueixen explotant els dipòsits de Xile, actualment s'obté majoritàriament per reacció de l'àcid nítric i carbonat de sodi:
Història
[modifica]
Entre 1810 i 1812, els dipòsits naturals del desert d'Atacama, situat aleshores al Virregnat del Perú, foren explotats pels espanyols prop de la ciutat de Zapiga, a un centenar de quilòmetres al sud de l'actual frontera amb el Perú, per a produir pólvora. Aquesta és la part més septentrional i accessible del desert d'Atacama. Més al sud, el desert queda tallat del mar per una costa de muntanyes que s'eleven abruptament entre 300 i 600 m des del mar, dificultant l'accés al desert interior. Els llits de nitrats de sodi no foren explotats àmpliament fins al 1830 quan els enviaments tant de nitrat de sodi com de guano a Europa començaren, principalment per adobs en lloc de municions. Els agricultors europeus tot just començaven a apreciar el valor dels fertilitzants en aquell moment. Per a explosius, el nitrat de sodi es convertia en nitrat de potassi dissolent-lo en aigua calenta i afegir clorur de potassi. Sobre potes de refrigeració el nitrat de potassi cristal·litza:
En el moment de la Guerra Civil americana, la Unió bloquejà ports del sud per evitar que la Confederació finançàs la guerra amb el cotó exportat i la importació de materials de guerra com el nitrat de Xile. Els estats del sud van recórrer a l'antic mètode d'extreure'l dels sòls de brutícia de les cavernes. El 1826 Bolívia s'independitzà d'Espanya, quedant els dipòsits de nitrats en territori bolivià, que en aquell moment arribaven al mar. Tanmateix les empreses xilenes i britàniques posseïen les mines i els treballadors eren principalment xilens. A uns 400 quilòmetres al sud, Xile començà a extreure nitrats a finals de la dècada de 1850. Quan es descobrí que els jaciments més importants estaven a l'interior del desert, s'inicià una disputa fronterera entre Xile i Bolívia. El resultat fou la Guerra del Pacífic (1879-1883) en què Xile s'enfrontà a una aliança de Bolívia i el Perú. Xile guanyà la guerra i aconseguí tots els jaciments de nitrats.[2]
A l'esclat de la Primera Guerra Mundial, les potències aliades van prendre mesures per evitar que Alemanya importés nitrat de Xile. No obstant això, l'Imperi Alemany inicià la producció a gran escala d'amoníac a través del procés Haber-Bosch emprant com a reactius hidrogen i nitrogen:
L'oxidació de l'amoníac a àcid nítric pel procediment Ostwald i la posterior reacció d'aquest amb carbonat de sodi, possibilità a l'Imperi Alemany de disposar de nitrat de sodi sintètic, la qual cosa allargà la guerra dos o tres anys, ja que s'hauria quedat sense nitrats per produir explosius. Després de la Primera Guerra Mundial, el procés Haber-Ostwald es convertí en la font més econòmica de nitrat i la mineria xilena acabà gairebé el 1930.[2]
Propietats
[modifica]Propietats físiques
[modifica]
El nitrat de sodi a temperatura ambient és un sòlid cristal·lí, de color blanc i inodor. Els cristalls pertanyen al sistema cristal·lí trigonal o romboèdric. La unitat de romboedre del nitrat de sodi és una estructura centrada en el cos que conté dos grups ,[3] grup espacial 3m.[4] El seu punt de fusió és de 308 °C i descompon a 380 °C en òxid de dinitrogen i òxid de sodi. La seva densitat és de 2,26 g/cm³.
En aigua, el nitrat de sodi és molt soluble, 73 g en 100 g d'aigua a 0 °C i 91,2 g en 100 g d'aigua a 25 °C. La seva solubilitat augmenta amb la temperatura. És soluble en etanol i metanol. Les seves dissolucions en aigua són neutres (pH = 7). En aire humit és deliqüescent.[5]
Propietats químiques
[modifica]El nitrat de sodi és un agent oxidant fort; reacciona violentament amb materials inflamables, combustibles, molts compostos orgànics, i altres agents reductors com alumini granulat o en pols, magnesi i altres metalls, que sovint provoquen incendis i explosions.
Reaccions àcid-base
[modifica]Amb els àcids forts el nitrat de sodi actua com a base. És el cas de la reacció amb l'àcid sulfúric que fou emprada per a l'obtenció industrial d'àcid nítric:
Oxidació
[modifica]
Les propietats oxidants del nitrat de sodi s'han emprat per preparar explosius o per preparar amb glúcids propel·lents per a cohets casolans. La reacció amb glucosa és:[6]
Descomposició
[modifica]A temperatures per damunt dels 380 °C, ja en estat líquid, i per sota dels 800 °C el nitrat de sodi es descompon en nitrit de sodi i oxigen:[7]
Si la temperatura supera els 800 °C es produeix òxid de sodi, nitrogen i oxigen:
Usos
[modifica]El nitrat de sodi es consumeix principalment en vidre, explosius, indústria agrícola, química i altres.
Indústria del vidre
[modifica]El vidre és el camp d'aplicació més gran, que va trigar aproximadament el 47,42 % el 2017. El nitrat de sodi està involucrat en un procés de dues etapes per a la fabricació de vidres reforçats químicament. L'article de vidre se submergeix primer en un bany de nitrat de sodi que enriqueix la superfície del vidre amb ions sòdi(+1) augmentant la força del producte acabat. El vidre reforçat químicament és resistent a les ratllades, i ha millorat l'impacte i la força de flexió, així com una major estabilitat de temperatura. També es trenca en trossos més grans que el vidre no enfortit. És útil per a la marquesina d'aeronaus d'alguns avions de caça i altres situacions en què el vidre requereix tenacitat i claredat òptica. El nitrat de sodi també s'utilitza per aclarir vidre fos en la producció d'ulleres d'alta qualitat.[8]
Explosius
[modifica]L'explosiu també és una aplicació important de nitrat de sodi que s'utilitza principalment a Amèrica del Sud. El nitrat de sodi és un ingredient en els propulsors de coets. S'ha utilitzat com a substitut del nitrat de potassi en polvora negra, tot i que el seu rendiment és menor. Com a ingredient en un nitrat explosiu, el nitrat de sodi té diversos avantatges: és barat, estable, no tòxic i no verinós. No obstant això, té una velocitat de cremada lenta.[8]
Fertilitzants
[modifica]El nitrat de sodi també es consumeix àmpliament a la indústria agrícola a Europa i als EUA.[9] El nitrat de sodi conté nitrogen important en el creixement de les plantes. L'excés de nitrogen pot retardar la producció de fruita i flors, i massa poc pot conduir a un creixement impressionant de la planta. El nitrogen dels fertilitzants de nitrat de sodi està immediatament disponible per a les arrels de les plantes.
Alimentació
[modifica]
El nitrat de sodi s'utilitza a la indústria alimentària com a conservant (E-251). El nitrat de sodi és un conservant que es troba en carns processades, com ara botifarra, salami, pernil i altres carns. Evita el creixement dels bacteris que fan malbé la carn i conserva la carn com a color vermell o rosa. El nitrat de sodi no s'afegeix al pollastre ni a la tonyina, ja que no hi ha color vermell per conservar. Hi ha algunes evidències que també prevé el botulisme, causat per la toxina botulínica produïda pel bacteri Clostridium botulinum, tot i que els nitrits tenen més probabilitats d'estar involucrats en aquest procés. El nitrat de sodi s'utilitza en la curació del pernil de pagès a causa del llarg temps d'envelliment requerit.[8]
Fàrmacs
[modifica]El nitrat de sodi està catalogat com l'ingredient inactiu en una varietat de col·liris, presumiblement com a conservant. El nitrat de sodi s'utilitza sovint pel nitrogen que conté, com a compost de control en lloc d'un ingredient actiu en medicina que també tengui nitrogen.[8]
Toxicologia
[modifica]
El nitrat de sodi i el nitrit de sodi s'utilitzen com a conservants en embotits, com la cansalada, l'embotit i el pernil, i en alguns formatges. Tot i que no s'ha demostrat que cap sal sigui cancerígena, hi ha certa preocupació perquè els nitrats poden reaccionar amb amines nitrosades presents en els aliments, per formar nitrosamines, moltes de les quals són cancerígenes; aquesta reacció pot ocórrer en les condicions àcides de l'estómac. També amb amides poden formar nitrosamides. Atès que el nitrat es pot convertir en nitrit, sigui en un producte alimentari o en la boca o el tracte gastrointestinal per acció bacteriana, tant el nitrat com el nitrit s'han de considerar junts per avaluar qualsevol possible perill.[10]
Hi ha diverses fonts dietètiques de nitrat i nitrit a més dels embotits, incloses les verdures i algunes aigües potables. En les últimes dècades, els nivells de nitrat i nitrit en embotits s'han reduït considerablement, i el potencial de formació de nitrosamines s'ha mitigat encara més amb l'addició a embotits d'antioxidants com l'àcid ascòrbic, que inhibeixen la nitrosació de les amines. Els peixos conservats amb sal i els aliments fumats es troben entre les altres fonts de nitrosamines en la dieta humana. Tot i que hi ha algunes dades que indiquen que el càncer de faringe, esòfag i estómac és més comú en poblacions que consumeixen alts nivells de nitrat o certs tipus de carn o peix conservats, encara s'ha d'aclarir el paper específic de les nitrosamines o de nitrat o nitrit afegit en el càncer humà. És possible que la presència d'inhibidors de nitrosació en fruites i verdures fresques sigui un factor per explicar per què el consum d'aquests aliments sembla tenir un efecte protector contra el càncer en les poblacions humanes.[10]
-
Cartell publicitari difós a Espanya i Portugal, obra de l'arquitecte Adolfo López-Duran Lozano (1902-?), realitzat essent estudiant a la Institución Libre de Enseñanza.[11]
Referències
[modifica]- ↑ Mutic, Anja «The ghost towns of northern Chile». Washington Post, 26-10-2012 [Consulta: 6 abril 2020]. Arxivat 27 de maig 2019 a Wayback Machine.
- ↑ 2,0 2,1 2,2 Barnum, Dennis W. «Some History of Nitrates». Journal of Chemical Education, 80, 12, 12-2003, pàg. 1393. Arxivat de l'original el 2024-05-16. DOI: 10.1021/ed080p1393. ISSN: 0021-9584 [Consulta: 22 abril 2021].
- ↑ Wyckoff, Ralph W. G. «The Crystal Structure of Sodium Nitrate». Physical Review, 16, 2, 01-08-1920, pàg. 149–157. Arxivat de l'original el 2024-05-16. DOI: 10.1103/PhysRev.16.149 [Consulta: 16 maig 2024].
- ↑ «mp-4531: NaNO3 (trigonal, R-3c, 167)». Arxivat de l'original el 2021-04-25. [Consulta: 25 abril 2021].
- ↑ PubChem. «Sodium nitrate» (en anglès). Arxivat de l'original el 2021-04-22. [Consulta: 23 abril 2021].
- ↑ «John Straub's lecture notes». Arxivat de l'original el 2021-09-24. [Consulta: 25 abril 2021].
- ↑ Kawai, Kota; Fukuda, Tatsuya; Nakano, Yoshio; Takeshita, Kenji «Thermal decomposition analysis of simulated high-level liquid waste in cold-cap» (en anglès). EPJ Nuclear Sciences & Technologies, 2, 2016, pàg. 44. Arxivat de l'original el 2023-12-10. DOI: 10.1051/epjn/2016038. ISSN: 2491-9292 [Consulta: 16 maig 2024].
- ↑ 8,0 8,1 8,2 8,3 «Uses of Sodium Nitrate» (en anglès). Arxivat de l'original el 2021-04-23. [Consulta: 23 abril 2021].
- ↑ «Sodium Nitrate Market Share 2021 Developments, Industry Size, Types, Applications, Major Regions, Top Key Players and Forecast to 2026» (en anglès). Arxivat de l'original el 2021-04-23. [Consulta: 23 abril 2021].
- ↑ 10,0 10,1 «CANCER | Carcinogens in the Food Chain» (en anglès). , 01-01-2003, p. 799–804. DOI: 10.1016/B0-12-227055-X/00155-3.
- ↑ Barbas Nieto-Laina, Ricardo L. «La Publicidad del nitrato de Chile en el primer tercio del siglo XX. Ejemplos de Art Deco en el Valle del Henares. Azulejería, cerámica y publicidad». Arxivat de l'original el 23 d’abril 2021. [Consulta: 23 abril 2021].













![Cartell publicitari difós a Espanya i Portugal, obra de l'arquitecte Adolfo López-Duran Lozano (1902-?), realitzat essent estudiant a la Institución Libre de Enseñanza.[11]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/64/Nitrato_de_Chile_01_by-dpc.jpg/98px-Nitrato_de_Chile_01_by-dpc.jpg)