Nombre quàntic magnètic
El nombre quàntic magnètic (símbol ml), és un dels quatre nombres quàntics necessaris per a descriure l'estat de cada electró d'un àtom. Els altres nombres quàntics necessaris per a descriure l'estat d'un electró són: el nombre quàntic principal (amb símbol n), el nombre quàntic azimutal (ℓ) i el nombre quàntic d'espín (s). El nombre quàntic magnètic distingeix els orbitals atòmics disponibles dins d'una capa d'electrons i es fa servir per calcular el component azimutal de l'orientació de l'orbital a l'espai. Els electrons en una determinada capa (per exemple s, p, d o f) prenen certs valors en ℓ (0, 1, 2, o 3, respectivament). Aleshores, els valors possibles de ml són: -ℓ, -ℓ+1, ..., 0, ..., ℓ-1, ℓ. Per tant, les capes s, p, d i f tenen valors de ml dins dels rangs 0, ±1, ±2, ±3 respectivament, tenen per tant 1, 3, 5 i 7 orbitals respectivament. Cadascun d'aquests orbitals poden tenir fins a dos electrons (cadascun amb espins oposats) el que forma la base de la taula periòdica.
Derivació
[modifica]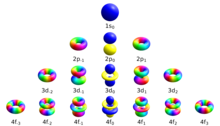
Hi ha un conjunt de nombres quàntics associats amb els estats d'energia dels electrons a l'àtom. Aquests són els tres nombres atòmics: , , i, en el cas que sigui present un camp magnètic, el nombre quàntic . Aquests quatre nombres quàntics especifiquen de forma completa, unívoca i única l'estat quàntic d'un electró en un àtom i per tant la seva funció d'ona. L'equació de Schrödinger per la funció d'ona d'un àtom amb un sol electró és una equació diferencial parcial separable (això no és possible per àtoms amb més d'un electró com l'heli on es necessiten altres mètodes més sofisticats per a trobar una solució.[1] Això significa que la funció d'ones expressada en el sistema de coordenades esfèriques pot ser expressada com el producte de tres funcions on cadascuna depenen d'una de les variables: radi, angle polar i azimut.[2]
L'equació diferencial per es pot resoldre amb una solució tipus . Donat que els valors d'angle azimut que difereixen en 2 (360 graus en radians) representen la mateixa posició a l'espai i que per tant la magnitud de no ha de créixer de forma arbitràriament gran, el coeficient ha de ser quantitzat amb nombres sencers múltiples de , obtenint així un exponent imaginari: .[2] Aquests nombres sencers són els nombres quàntics magnètics. La mateixa constant apareix en l'equació de l'angle polar, on valors més alts de ² fan decréixer la magnitud de i els valors de més grans que del nombre quàntic azimutal, , no permeten cap solució per .
| Relació entre Nombres Quàntics | |||
|---|---|---|---|
| Orbital | Valors Permesos | Nombre de Valors per [3] | Electrons per capa |
| s | 1 | 2 | |
| p | 3 | 6 | |
| d | 5 | 10 | |
| f | 7 | 14 | |
| g | 9 | 18 | |
Com a component del moment angular
[modifica]
L'eix emprat aquí per les coordenades polars s'han escollit arbitràriament. El nombre quàntic fa referència a la projecció del moment angular a aquesta direcció escollida arbitràriament que per convenció s'anomena eix de quantització . , la magnitud del moment angular en la direcció , ve donada per la fórmula :[3]
- .
Aquest és un component del moment angular total de l'electró atòmic , la magnitud del qual es relaciona amb el nombre quàntic azimutal de la seva capa per l'equació:
- ,
on és la constant de Planck reduïda. Cal notar que per i que s'aproxima a per valors elevats de . No és possible mesurar el moment angular de l'electró per tots tres eixos simultàniament. Aquestes propietats van ser demostrades per primer cop a l'experiment de Stern–Gerlach.
Efecte en camps magnètics
[modifica]El nombre quàntic fa referència, de forma vaga, a la direcció del vector moment angular. El nombre quàntic magnètic només afecta a l'energia del electró si està immers en un camp magnètic perquè en la seva absència, tots els harmònics esfèrics corresponents als diferents valors arbitraris de són equivalents. El nombre magnètic quàntic determina el canvi d'energia d'un orbital atòmic degut al camp magnètic extern, efecte Zeeman. D'aquí ve el nom de nombre magnètic quàntic. No obstant, el moment magnètic d’un electró d’un orbital atòmic no només s'origina del seu moment angular, també del seu espín, nombre quàntic d'espín.
Donat que en un camp magnètic cada electró té un moment magnètic, aquest estarà subjecte a un parell de forces que tendeix a fer el vector paral·lel al camp. Aquest fenomen es coneix com precessió de Larmor.
Referències
[modifica]- ↑ «Helium àtom» (en anglès). [Consulta: 23 març 2021].
- ↑ 2,0 2,1 «Hydrogen Schrodinger Equation» (en anglès). hyperphysics.phy-astr.gsu.edu.
- ↑ 3,0 3,1 Herzberg, Gerhard. Molecular Spectra and Molecular Structure (en anglès). D van Nostrand Company, 1950, p. 17-18.
Bibliografia
[modifica]- Eisberg, Robert; Resnick, Robert. Quantum Physics of Atoms, Molecules, Solids, Nuclei, and Particles. 2nd. Wiley, 1985. ISBN 978-0-471-87373-0.
































