Organosulfat
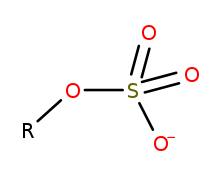
Els organosulfats són compostos de la química orgànica del sofre que comparteixen un grup funcional comú amb l'estructura R−O−SO−3. La part SO4 de la molècula és un grup sulfat i el grup R és qualsevol radical orgànic. Conceptualment tots els organosulfats són èsters derivats d'alcohols i àcid sulfúric (H2SO4), encara que molts no es preparen d'aquesta manera. Molts intervenen en la formulació de detergents i alguns són reactius útils. Els alquilsulfats consisteixen en una cadena hidrocarbonada hidrofòbica, un grup sulfat polar (que conté un anió) i un catió o una amina que neutralitza el grup sulfat. Alguns exemples: laurilsulfat de sodi (també conegut com a sal sòdica de monododecil èster d'àcid sulfúric) i sals de potassi i amoni anàlogues.
Aplicacions
[modifica]Els alquilsulfats s'utilitzen habitualment com a tensioactius aniònics en sabons líquids i detergents utilitzats per a netejar la llana, com a netejadors de superfícies i com a ingredients actius en detergents, xampús i condicionadors de cabell. També es poden trobar en productes de la llar com la pasta de dents, antiàcids, cosmètics i diversos aliments. Generalment es troben en productes de consum a concentracions que oscil·len entre el 3 i el 20%.
Organosulfats sintètics
[modifica]
Un exemple comú és el laurilsulfat de sodi, amb la fórmula CH3(CH2)11OSO3Na. També són habituals en els productes de consum els èsters sulfatats dels alcohols grassos etoxilats com els derivats de l'alcohol laurílic. Un exemple és el lauril èter sulfat de sodi, un ingredient d'alguns cosmètics.[1]
L'alquilsulfat es pot produir a partir d'alcohols, que al seu torn s'obtenen per hidrogenació d'olis i greixos, animals o vegetals, o mitjançant el procés Ziegler o per síntesi oxo. Si es produeix a partir de matèries primeres oleoquímiques o del procés Ziegler, la cadena d'hidrocarburs de l'alcohol serà lineal. Si es deriva mitjançant el procés oxo, apareixerà un nivell baix de ramificació generalment amb un grup metil o etil en la posició C-2, que conté quantitats parells i senars de cadenes alquíliques.[2] Aquests alcohols reaccionen amb l'àcid clorosulfúric:
- ClSO3H + RCH2OH → RCH2OSO3H + HCl
Alternativament, els alcohols es poden convertir en èsters de mig sulfat mitjançant triòxid de sofre:[3]
- SO3 + RCH2OH → RCH2OSO3H
Rutes de laboratori
[modifica]Els organosulfats especialitzats es poden preparar mitjançant la reacció d'Elbs (oxidació de fenols amb persulfat) i l'oxidació de Boyland-Sims d'anilines.
Dialquilsulfats
[modifica]
Una família menys coneguda d'organosulfats té la fórmula RO-SO2-OR'. Es preparen a partir d'àcid sulfúric i l'alcohol. Els principals exemples són el sulfat de dietil i el sulfat de dimetil, líquids incolors que s'utilitzen com a reactius en la síntesi orgànica. Aquests compostos són agents alquilants potencialment perillosos. Els dialquilsulfats no es troben a la natura.[4]
Organosulfats naturals
[modifica]
Existeixen diverses classes d'organosulfats a la natura. Especialment comuns són els derivats del sucre com el sulfat de queratà, el sulfat de condroitina i l'heparina, un anticoagulant.[5] Les modificacions post-traduccionals d'algunes proteïnes comporten sulfatació, sovint en el grup fenol dels residus de tirosina.[6] Un sulfat esteroide és el sulfat d'estradiol, un precursor latent de l'hormona estrògen.
Una part important del sofre del sòl es troba en forma d'èsters de l'àcid sulfúric, és a dir, d'organosulfats.[7]
Metabolisme
[modifica]El sulfat és un anió inert; la naturalesa l'activa mitjançant la formació d'un derivat èster de l'adenosina 5'-fosfosulfat (APS) i 3'-fosfoadenosina-5'-fosfosulfat (PAPS). Molts organismes utilitzen aquestes reaccions amb finalitats metabòliques o per a la biosíntesi de compostos de sofre necessaris per a la vida.[8] La formació i hidròlisi dels èsters de sulfat naturals són catalitzades per sulfatases (també coneguts com sulfohidrolases).[4]
Seguretat
[modifica]Com que s'utilitzen àmpliament en productes comercials, els aspectes de seguretat dels organosulfats estan molt investigats.[9]
Salut humana
[modifica]Si els alquilsulfats s'ingereixen s'absorbeixen bé i es metabolitzen en un sulfat C3, C4 o C5 i un metabòlit addicional. L'irritant més alt és el laurilsulfat de sodi, amb el llindar abans de la irritació a una concentració del 20%. Els tensioactius dels productes de consum es barregen normalment, reduint la probabilitat d'irritació. Segons l'OCDE TG 406, els alquilsulfats en estudis amb animals no s'han trobat com a sensibilitzadors de la pell.[9][10]
Els estudis de laboratori no han trobat que els alquilsulfats siguin genotòxics, mutagènics o cancerígens. No s'han trobat efectes reproductius a llarg termini.[11]
Medi ambient
[modifica]L'eliminació principal del sulfat d'alquil dels productes comercials usats són les aigües residuals. La concentració d'alquilsulfats a l'efluent de les plantes de tractament d'aigües residuals (EDAR) s'ha mesurat en 10 micrograms per litre o inferior. Els alquilsulfats es biodegraden fàcilment, fins i tot començant probablement abans d'arribar a l'EDAR. Un cop a la depuradora, s'eliminen ràpidament per biodegradació. S'ha trobat que els invertebrats són el grup tròfic més sensible als alquilsulfats. També que el laurilsulfat de sodi provat a Uronema parduczi, un protozou, tenia el valor d'efecte més baix amb el 20 h-EC5 de 0,75 mil·ligrams per litre. Les proves d'exposició crònica amb C12 a C18 amb l'invertebrat Ceriodaphnia dubia van comprovar que la toxicitat més alta es dóna amb C14 (el NOEC va ser de 0,045 mg/L).
Pel que fa a l'estabilitat tèrmica, els alquilsulfats es degraden molt abans d'arribar al seu punt d'ebullició a causa de la baixa pressió de vapor (per al C8-18 de 10-11 a 10-15 hPa). L'absorció del sòl és proporcional a la longitud de la cadena de carboni; longituds de 14 o més tenen la taxa d'absorció més alta. S'ha trobat que les concentracions del sòl varien entre 0,0035 i 0,21 mil·ligrams per quilogram.
Referències
[modifica]- ↑ Eduard Smulders, Wolfgang von Rybinski, Eric Sung, Wilfried Rähse, Josef Steber, Frederike Wiebel, Anette Nordskog "Laundry Detergents" in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. doi:10.1002/14356007.a08_315.pub2.
- ↑ Klaus Noweck, Wolfgang Grafahrend, "Fatty Alcohols" in Ullmann’s Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a10_277.pub2
- ↑ Holmberg, Krister. «Surfactants». A: Ullmann's Encyclopedia of Industrial Chemistry, 2019, p. 1–56. DOI 10.1002/14356007.a25_747.pub2. ISBN 978-3-527-30673-2.
- ↑ 4,0 4,1 Cleland, W. Wallace; Hengge, Alvan C. «Enzymatic Mechanisms of Phosphate and Sulfate Transfer». Chemical Reviews, vol. 106, 8, 2006, pàg. 3252–3278. DOI: 10.1021/cr050287o. PMID: 16895327.
- ↑ J. W. Fitzgerald «Sulfate ester formation and hydrolysis: a potentially important yet often ignored aspect of the sulfur cycle of aerobic soils». Bacteriological Reviews, vol. 40, 3, 1976, pàg. 698–721. DOI: 10.1128/br.40.3.698-721.1976. PMC: 413977. PMID: 791238.
- ↑ Moore, Kevin L. «The Biology and Enzymology of Protein Tyrosine O-Sulfation». Journal of Biological Chemistry, vol. 278, 27, 2003, pàg. 24243–24246. DOI: 10.1074/jbc.R300008200. PMID: 12730193.
- ↑ Scherer, H.W. «Sulphur in crop production — invited paper». European Journal of Agronomy, vol. 14, 2, 2001, pàg. 81–111. DOI: 10.1016/S1161-0301(00)00082-4.
- ↑ M. T. Madigan, J. M. Martinko, J. Parker "Brock Biology of Microorganisms" Prentice Hall, 1997. ISBN 0-13-520875-0.
- ↑ 9,0 9,1 SDA/Alkylsulfate Consortium. «SIDS Initial Assessment Profile. SIAM 25: Alkyl Sulfates, Alkane Sulfonates, and α-Olefin sulfonates». OECD SIDS, 2007. Arxivat de l'original el 2016-03-03. [Consulta: 14 octubre 2011].
- ↑ DE/ICCA. «SIDS Initial Assessment Profile SIAM 25: Alkyl Sulfates, Alkane Sulfonates, and α-Olefin sulfonates». OECD, 2009.
- ↑ Wibbertmann, A «Toxicological properties and risk assessment of the anionic surfactants category: Alkyl sulfates, primary alkane sulfonates, and α-Olefin sulfonate». Ecotoxicology and Environmental Safety, vol. 74, 5, 2011, pàg. 1089–1106. DOI: 10.1016/j.ecoenv.2011.02.007. PMID: 21463896.
