Oxiclorur de fòsfor
Aparença
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 151,875 Da |
| Estructura química | |
| Fórmula química | Cl₃OP |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 1,65 g/cm³ (a 77 °F) |
| Moment dipolar elèctric | 2,54 D |
| Punt de fusió | 1 ℃ 1 ℃ |
| Punt d'ebullició | 106 ℃ (a 760 Torr) 105,5 ℃ (a 101,325 kPa) |
| Moment dipolar elèctric | 2,54 D |
| Pressió de vapor | 40 mmHg (a 27 ℃) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 0,6 mg/m³ (10 h, cap valor) |
| Límit d'exposició a curt termini | 3 mg/m³ (cap valor) |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () Regulació europea de productes químics (GHS05: corrosiu, GHS06: calavera i tíbies, GHS08: perill per a la salut) | |
| Identificador Kemler | X668 |
| Codi de classificació ONU | TC3 |
El oxiclorur de fòsfor o clorur de fosforil (en anglès: phosphoryl chloride o phosphorus oxychloride) és un líquid incolor amb la fórmula POCl₃. Amb el seu punt de congelació a 1 °C i el d'ebullició a 106 °C, el rang de líquid és molt similar al de l'aigua. S'hidrolitza en l'aire humit alliberant àcid fosfòric i clorur d'hidrogen. A gran escala es fabrica a partir del triclorur de fòsfor i oxigen o pentaòxid de fòsfor. Principalment, es fa servir per fer èsters fosfats com el fosfat de tricresil.
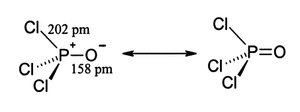
La seva estructura és en tetraedre.[1]
- 85%
Propietats químiques
[modifica]El POCl₃ reacciona amb aigua i alcohols per donar clorur d'hidrogen i àcid fosfòric o clorur d'hidrogen i èster fosfats, respectivament:
- O=PCl₃ + 3 H₂O → O=P(OH)₃ + 3 HCl
- O=PCl₃ + 3 ROH → O=P(OR)₃ + 3 HCl
Referències
[modifica]- ↑ D. B. Chesnut «The Electron Localization Function (ELF) Description of the PO Bond in Phosphine Oxide». Journal of the American Chemical Society, 121, 10, 1999, pàg. 2335–2336. DOI: 10.1021/ja984314m.
Bibliografia
[modifica]- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- A. D. F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK, 1973.
- L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- B. J. Walker, Organophosphorus chemistry, p101-116, Penguin, Harmondsworth, UK, 1972.
- CDC - NIOSH Pocket Guide to Chemical Hazards