Oxoàcid
Un oxoàcid és un compost químic que conté oxigen, almenys un altre element i almenys un hidrogen lligat a l'oxigen, , i que produeix una base conjugada per la pèrdua d'ions d'hidrogen (hidrons) positius, . Són exemples d'oxoàcids inorgànics l'àcid nítric , l'àcid sulfúric i l'àcid fosfòric .[1][2] Qualsevol àcid carboxílic és un exemple d'oxoàcid orgànic.[3]
-
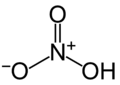
Estructura de l'àcid nítric
-
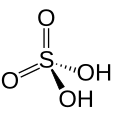
Estructura de l'àcid sulfúric
-
Estructura de l'àcid fosfòric
-
Estructura de l'àcid acètic
Els oxoàcids inorgànics presenten enllaços del tipus hidrogen-oxigen-heteroàtom amb una fórmula general . Si és un no-metall o un metal·loide, aquestes espècies acostumen a ser àcids de Brønsted. Amb molt poques excepcions, principalment els oxoàcids de fòsfor, l'hidrogen està enllaçat exclusivament amb l'oxigen i no amb l'heteroàtom.
La força àcida dels oxoàcids depèn de diversos factors. Si té més d'un hidrogen ionitzable, les constants d'acidesa segueixen l'ordre Ka1 > Ka2 > Ka3. Com a regla general, les successives constants d'acidesa estan separades per uns cinc ordres de magnitud, per exemple per a l'àcid fosfòric : pKa1 = 2,1, pKa2 = 7,2 i pKa3 = 12,4. Les reaccions són:
Per altra banda, l'acidesa és més gran com més electronegatiu és l'heteroàtom. Per exemple el valor de Ka augmenta segons la sèrie , ja que les electronegativitats d'aquests heteroàtoms d'un mateix període de la taula periòdica varien igual: 2,1 < 2,5 < 3,0. També l'acidesa augmenta en la sèrie d'oxoàcids d'elements del mateix grup de la taula periòdica, com ara els halògens. Així hom troba l'ordre perquè les electronegativitats augmenten: 2,5 < 2,8 < 3,0. A més, l'acidesa s'incrementa per l'addició de grups atraients d'electrons, com o , sobre l'heteroàtom, per exemple . Finalment l'acidesa augmenta en augmentar el nombre d'àtoms d'oxigen que conté l'oxoàcid. Per exemple, per als oxoàcids del clor, Ka augmenta en el sentit . De nou aquí la diferència entre les successives constants d'acidesa és d'aproximadament cinc ordres de magnitud.[3]
Ús industrial
[modifica]
Els oxoàcids més importants des del punt de vista industrial són l'àcid sulfúric i l'àcid nítric. L'àcid sulfúric és un dels productes químics industrials de major volum produïts al món. La producció de fertilitzants, especialment els fertilitzants a partir d'àcid fosfòric de procés humit, és el principal mercat d'ús final de l'àcid sulfúric, que representa més del 60% del consum mundial total el 2017. La Xina és el principal mercat, que representà més del 37% del consum el 2017, seguit d'Amèrica del Nord amb prop d'un 16%.[4] Se'n produeixen aproximadament 165 milions de tones anuals a tot el món.[5] El mercat més gran d'àcid nítric és la producció de nitrat d'amoni i nitrat d'amoni i calci , que representà gairebé el 77% del consum mundial d'àcid nítric el 2016. L'ús final principal del nitrat d'amoni per a fertilitzants està en davallada a causa de les preocupacions sobre la contaminació per nitrats i problemes de seguretat, ja que pot emprar-se com explosiu.[6] La producció el 2016 fou de 62,2 milions de tones.[7]
Referències
[modifica]- ↑ «oxoàcid | enciclopèdia.cat». [Consulta: 5 novembre 2019].
- ↑ «IUPAC - oxoacids (O04374)». IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Blackwell Scientific Publications, 1997. DOI: 10.1351/goldbook. [Consulta: 5 novembre 2019].
- ↑ 3,0 3,1 «Diccionari de química | TERMCAT». [Consulta: 5 novembre 2019].
- ↑ «Sulfuric Acid - Chemical Economics Handbook (CEH) | IHS Markit». [Consulta: 5 novembre 2019].
- ↑ «Sulfuric Acid» (en anglès). [Consulta: 5 novembre 2019].
- ↑ «Nitric Acid - Chemical Economics Handbook (CEH) | IHS Markit». [Consulta: 5 novembre 2019].
- ↑ «Nitric Acid» (en anglès). [Consulta: 5 novembre 2019].











![{\displaystyle {\ce {H3PO4 + H2O <=>[K_{a1}] H2PO4- + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b73d07288375e82e18b6616117a48908291d390)
![{\displaystyle {\ce {H2PO4- + H2O <=>[K_{a2}] HPO4^2- + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dc6a469590f941ea1770cdc0c450be1cd0684927)
![{\displaystyle {\ce {HPO4^2- + H2O <=>[K_{a3}] PO4^3- + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e807c416a1567434b1f8706b1716cc61aaac599)







