Parvovirus porcí
| Porcine parvovirus | |
|---|---|
 Parvovirus en sang | |
| Dades | |
| Genoma | Grup II (ssDNA) |
| Taxonomia | |
| Regne | Shotokuvirae |
| Fílum | Cossaviricota |
| Classe | Quintoviricetes |
| Ordre | Piccovirales |
| Família | Parvoviridae |
| Gènere | Protoparvovirus |
| Espècie | Ungulate protoparvovirus 1 |
| Cap valor | Porcine parvovirus |
El parvovirus porcí (Porcine Parvovirus, PPV) és un virus DNA monocatenari, sense envoltura, amb una morfologia icosaèdrica i mida petita (20nm) que afecta a la família dels súids. La seva infecció causa infertilitat, descens proliferatiu, momificació i mort fetal, normalment en absència de signes clínics en la mare. Pot ser associat també a un creixement deficient al període postnatal. La malaltia es desenvolupa principalment quan individus seronegatius són exposats al virus via oronasal a qualsevol moment durant la primera meitat de la gestació (primers 57 dies, tenint en compte que en té una durada mitjana de 114), i posteriorment els fetus queden infectats via transplacentària abans que esdevinguin immunocompetents. El PPV és molt freqüent entre tots els porcs d'arreu del món i és enzoòtic a la majoria de col·lectius estudiats. Les enquestes epidemiològiques de la malaltia indiquen que el PPV és la principal causa infecciosa de mort embrionària i fetal. A més del seu efecte directe quant a la falla reproductiva, el PPV pot potenciar els efectes de la infecció per circovirus porcí de tipus II (PCV2) en el curs clínic de la síndrome d'aprimament multisistèmic postdelletament (PMWS).[1]
Etiologia
[modifica]El PPV és un virus DNA monocatenari, sense envoltura, de simetria icosaèdrica i amb una mida petita (20nm) que pertany al gènere Parvovirus (llatí parvus = petit) de la família Parvoviridae. Tots els PPV aïllats que han estat comparats han resultat ser antigènicament similars, si bé no idèntics. El PPV també està relacionat antigènicament a diversos membres del gènere. La seva identificació pot ser duta a terme, no obstant, a través de proves serològiques estrictes com ara la neutralització del virus (VN) i la inhibició de l'hemaglutinació (HI).[1]
Propietats biofísiques i bioquímiques
[modifica]Un virió madur té simetria cúbica, dues o tres proteïnes que formen la càpside, un diàmetre aproximat de 20 nm, 32 capsòmers, sense envoltura ni lípids essencials, i un pes de 5'3 x 10⁶ daltons. El genoma viral és àcid desoxiribonucleic (DNA) monocatenari amb un pes molecular d'1,4 x 10⁶ (representa aproximadament un 25% del pes total del virió). Les densitats de flotació (g/ml en clorur de cesi) dels virions infecciosos complets, virions incomplets "buids", i virions als que se'ls ha extret el DNA són, respectivament, 1'38-1'395, 1'30-1'315 i 1'724.
La infectivitat viral, l'activitat hemaglutinant i l'antigenicitat són especialment resistents a la calor, a un ampli interval de pH i a enzims.[1] El PPV es manté estable a un pH de 3 a 10 durant 1 hora a 37 °C i pot resistir una temperatura de 56 °C durant 2 dies, però és inactivat de forma permanent després d'haver estat exposat a 80 °C durant 5 minuts. El virus causa hemaglutinació en eritròcits d'humans, pollastres i conillets d'Índia. L'antigenicitat sembla romandre a les tres proteïnes de la càpside: VPI (81kDa), VP2 (66kDa) i VP3 (62kDa). El virus es replica en cèl·lules que es troben a punt de dividir-se (macròfags alveolars i limfòcits) i pot ser cultivat 'in vitro' en monocapes cel·lulars de ronyó de porc o en línies cèl·lulars contínues. Els efectes citopàtics com ara les inclusions intracel·lulars i l'arrodoniment cel·lular poden ser transitoris als primers estadis de l'aïllament i les cèl·lules poden ser identificades a través de tècniques d'immunofluorescència, immunoperoxidasa, proves de DNA, PCR, reaccions d'hemadsorció i hemaglutinació i mitjançant ELISA.[2]
Replicació
[modifica]La replicació del PPV in vitro és citocida i es caracteritza per l'arrodoniment, picnosi i lisi de les cèl·lules. Molts dels fragments cel·lulars acostumen a romandre enganxats, atorgant al cultiu afectat una aparença esparracada. Els canvis citopàtics són extensos quan el virus adaptat al cultiu cel·lular es propaga sota condicions apropiades. L'ús de la microscopia d'immunofluorescència (IF) incrementa en gran manera la probabilitat de detectar cultius mínimament infectats.
Els cultius cel·lulars primaris i secundaris de cèl·lules de ronyó de fetus o neonats porcins són els més utilitzats per a la propagació i titració de PPV, tot i que altres tipus de cultius són també susceptibles. La replicació es veu reforçada per la infecció de cultius mitòticament actius. Moltes de les cèl·lules d'aquests es troben en fase S (la fase de síntesi de DNA) del seu cicle cel·lular, on es troben disponibles les DNA-polimerases necessàries per a la replicació del virus.
L'efecte del sèrum a les cèl·lules té també una especial importància, ja que l'activitat mitòtica afecta la replicació del PPV. A més, seria convenient comprovar que els cultius cel·lulars no estiguin contaminats per PPV, perquè a vegades alguns d'ells són preparats a partir de teixits de fetus o nounats infectats sense tenir-ne coneixement. A més, el PPV pot ser introduït de forma accidental als cultius a través de diverses formes, incloent l'ús de tripsina contaminada. Si es detecta la contaminació abans que totes les cèl·lules s'infectin, el virus pot ser eliminat a través de l'elaboració repetitiva de subcultius cel·lulars que continguin antisèrum PPV al medi de cultiu.
Molts són els investigadors que han utilitzat la microscopia d'immunofluorescència per tal de seguir el desenvolupament del PPV en cultius cel·lulars. En general, la seqüència dels events és la següent. Es detecta l'antigen viral al citoplasma de les cèl·lules poc després de la infecció si l'inòcul conté un títol elevat del virus i de l'antigen viral. La majoria, si no tota, d'aquesta fluorescència citoplasmàtica és el resultat de l'antigen fagocitat de l'inòcul. A través d'examinacions seqüencials, tal antigen pot ser primer mostrat a la superfície externa de la membrana citoplasmàtica i després dins del citoplasma, sovint concentrat relativament a una posició juxtanuclear. La primera evidència inequívoca de la replicació viral és l'aparició emergent d'antigen viral al nucli. En almenys algunes cèl·lules infectades, aquest antigen incipient apareix després al citoplasma en una quantitat suficient perquè tant el citoplasma com el nucli desprenguin fluorescència. Sovint les cèl·lules infectades observades als pulmons dels fetus que desenvolupen un major títol d'anticòs per a PPV representen aquest estadi de replicació. Les cèl·lules comencen a adoptar una forma arrodonida, esdevenen picnòtiques i es desintegren amb l'alliberament del virus i de l'antigen viral. Altres cèl·lules del cultiu que no es troben a la fase apropiada per la replicació viral continuen fagocitant i acumulant antigen viral al seu citoplasma. És possible induir una segona onada de replicació si s'estimulen aquestes cèl·lules a entrar a la fase S del cicle cel·lular a través de, per exemple, l'addició de medi de cultiu fresc.[3]

Hemaglutinació
[modifica]El PPV provoca hemaglutinació als eritròcits d'humans, micos, conillets d'Índia, gats, pollastres, rates i ratolins. S'ha observat que altres espècies animals en què s'han fet assajos són relativa o completament insensibles, o bé, els resultats van ser erronis.
Alguns paràmetres de la prova de l'hemaglutinació (HA) com la temperatura d'incubació, les espècies d'eritròcits usades i, en el cas dels pollastres, el component genètic i l'edat del donant, poden afectar els resultats.
La prova de l'hemaglutinació es duu a terme a temperatura ambient, a un pH neutre i normalment amb eritròcits de conillets d'Índia.
Els nivells més alts d'hemaglutinació s'han registrat quan el diluent utilitzat a la prova era el tampó veronal en lloc de la solució salina amb fosfat.
L'elució del virus pot ser induïda mitjançant la suspensió d'eritròcits en tampó alcalí, pH 9.[1]
Infectivitat
[modifica]Les valoracions de la infectivitat del PPV es duen a terme d'una manera estàndard, tenint en compte que, els canvis citopàtics a dilucions terminals són molt lents, els punts finals d'infectivitat es determinen molt sovint mitjançat l'examen de cultius cel·lulars d'inclusions intranuclears després d'una tinció adequada o bé amb l'examen del medi de cultiu cel·lular per hemaglutinina viral.
Els procediments de titració fan evidents les cèl·lules infectades mitjançant la tècnica d'immunofluorescència i també, en medis de cultiu.[3]
Epidemiologia
[modifica]El PPV és prevalent als porcs d'arreu del món i les infeccions per PPV són enzoòtiques a la majoria de les explotacions denses de porcs. En aquestes explotacions, aproximadament el 100% dels animals adults de més d'un any són seropositius. A més, una gran proporció de les truges primerenques estan infectades per PPV abans de concebre, i com a resultat desenvolupen una immunitat activa que probablement persisteix al llarg de la vida. En conjunt, les dates de seroepidemiologia indiquen que l'exposició enfront PPV és freqüent. També emfatitzen sobre l'alt risc d'infectar-se i de malaltia reproductiva entre les truges primerenques que no han desenvolupat immunitat abans de concebre. Les rutes més comunes d'infecció postnatal i prenatal són l'oronasal i la transplacentària, respectivament. També hi ha difusió intrauterina a fetus adjacents. Això es demostra per la gradació en la mida dels fetus momificats, corresponent al temps de mort fetal. El virus es transmet també per via orofecal, on les femtes amb virus seran la principal font de transmissió del virus al medi ambient.
Els garrins en néixer són seronegatius, però adquireixen passivament un títol important d'anticossos en mamar del calostre, ric en aquests. Aquest títol decreix progressivament a mesura que passa el temps mitjançant dilucions, ja que el garrí va creixent. Després de l'exposició d'animals seronegatius, el PPV es replica principalment en teixit limfoide i pulmons (concretament als limfòcits i macròfags alveolars), però es pot detectar a tots els teixits excepte al cervell. Els anticossos adquirits passivament protegeixen els garrins de la infecció per PPV entre 3 i 6 mesos si analitzem el sèrum amb el test HI. A vegades, els anticossos adquirits per aquest mètode poden persistir un interval de temps més llarg. La importància dels anticossos adquirits passivament és que interfereixen en el desenvolupament de la immunitat activa. Nivells alts d'aquests anticossos poden prevenir la infecció, i nivells baixos poden minimitzar la disseminació dels porcs infectats.
Les instal·lacions contaminades són probablement el major reservori del PPV. Aquest virus és termoestable, resistent a diferents desinfectants i manté la seva infectivitat durant mesos mitjançant secrecions i excrecions de porcs infectats de forma aguda. Va ser demostrat experimentalment que, tot i que els porcs transmetien el PPV durant només 2 setmanes després de l'exposició, les gàbies on havien estat podien transmetre la infecció durant 4 mesos. La ubiqüitat del PPV augmenta la possibilitat que alguns porcs estiguin persistentment infectats.
El verro susceptible, infectat per primera vegada durant la maduresa sexual, sofreix virèmia i el PPV podrà passar als òrgans genitals i contaminar el semen. Però en aquest cas no es produeix malaltia ni problemes de fertilitat. El virus estarà al semen durant el temps que duri la virèmia. Quan el verro adquireix immunitat s'elimina i, per tant, no produeix excreció permanent del virus. Independentment del seu estat d'immunitat, els verros també poden funcionar com a vehicle de disseminació de PPV entre les femelles susceptibles.
Patogènesi
[modifica]L'única malaltia rellevant, reconeguda i associada amb la infecció porcina per PPV són els trastorns en la reproducció. En truges gestants està influenciada pel temps de gestació en el moment de la infecció i la soca del virus. Si la infecció es dona durant la primera meitat de la gestació provocarà trastorns reproductius. El PPV té la capacitat de travessar la barrera transplacentària arribant així a l'embrió o fetus. La infecció transplacentària requereix de 10 a 14 dies perquè succeeixi i pot haver-hi infecció intrauterina parcial dels garrins. Els fetus moren per dany col·lectiu dels teixits. El virus no afecta els teixits materns, l'única manifestació clínica que s'observa a les truges és el retorn a l'estre, però acostuma a passar desapercebut. Les conseqüències d'infectar-se durant aquest període poden ser mort embrionària i fetal, on hi hauria reabsorció i momificació, respectivament. S'obtenen resultats semblants quan s'inocula directament el fetus amb PPV fins als 70 dies de gestació. Això és degut al fet que al voltant dels 70 dies de gestació els fetus són ja capaços de desenvolupar una resposta immunològica protectora versus el virus.
Taula 1. Etapes i conseqüències de la infecció per PPV en diferents intervals de la gestació.
| Infecció de la truja (dies) | Temps d'infecció del fetus (dies) | Resultat de la infecció | Malaltia clínica |
|---|---|---|---|
| <56 | 10-30 | Mort embrionària i reabsorció. | Moltes truges retornen a l'estre. |
| 30-70 | Mort fetal i momificació. | Ventrades menors amb fetus momificats. | |
| >56 | 70-final | Normalment no hi ha efectes danyins. Fetus immunocompetents infectats produeixen anticossos. | Habitualment cap. |
Quan només part de la ventrada queda infectada via transplacentària, un o més garrins són infectats freqüentment per la subseqüent propagació intrauterina del virus. Passaria el mateix si la infecció inicial es produís per semen contaminat. Com a resultat, qualsevol combinació dels fets indicats a la Taula 1 poden desenvolupar-se en el mateix garrí.
L'efecte del PPV a l'òvul abans de l'ovulació encara no se sap, si és que n'hi ha. El virus s'adhereix a la superfície externa de la zona pel·lúcida de l'òvul fertilitzat i, encara que aparentment no pot travessar aquesta barrera, hi ha especulacions que podria ser una amenaça per a l'embrió després de l'eclosió (Wrathall and Mengeling 1979). La zona pel·lúcida protegeix l'embrió mentre la immunitat local s'està desenvolupant. D'altra banda, el virus podria causar canvis uterins incompatibles amb la gestació. De qualsevol manera, una femella infectada a través del semen proporciona un focus d'infecció per a altres.
Signes clínics i lesions
[modifica]
El PPV causa trastorns reproductius. Després de la penetració a l'organisme es produeix una virèmia generalitzada, amb una replicació extensa. Podem trobar virus a diferents teixits i òrgans, especialment limfàtics i pulmonars. Es pot observar una lleugera leucopènia 10 dies després de la primera exposició al virus.[1]
Les femelles no immunes són susceptibles a la infecció en qualsevol fase de la gestació, i com a conseqüència d'aquesta infecció es dona la transmissió a través de la placenta.[4]
Un dels signes subclínics més importants en resposta a la infecció per PPV és un augment del fracàs reproductiu de les truges. Les seqüeles patològiques dependran del moment en què la truja sigui exposada al virus durant la gestació.
Les infeccions al principi de la gestació (fins al dia 35) provoquen una mort dels embrions i la seva reabsorció. Si la infecció es produeix entre els dies 35 i 70, aquests fetus ja no podran ser reabsorbits, ja que hi haurà una calcificació dels ossos dels fetus, i es produïra la seva mort i/o momificació. En cas de néixer algun garrí viu, ho farà molt debilitat. Per acabar, si la infecció es produeix després del dia 70 de gestació, els garrins neixen vius, ja que, aquests fetus, en el moment de la infecció són ja capaços de crear una resposta immunitària en contra del PPV.
Les truges infectades no presenten cap mena de simptomatologia.
Les lesions fetals inclouen la mort, decoloració hemorràgica, acumulació de líquids a les cavitats corporals, reabsorció de líquids fetals i la momificació. Aquestes lesions no són apreciables en individus que hagin adquirit la capacitat immunitària contra el PPV en el moment de la infecció.[5]
Diagnòstic
[modifica]En una explotació porcina en la que es comença a tenir avortaments, ventrades petites i garrins momificats en diferents estats de desenvolupament 1 i algun de mort de manera que altera el ritme normal de producció, és signe de presència de PPV.
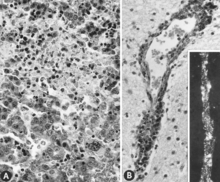
El diagnòstic ha de ser confirmat per la demostració del virus als fetus momificats de menys de 70 dies de gestació, ja que les mares no presenten simptomatologia, 9 mitjançant tècniques que ens permetin detectar la presència de l'antigen del PPV. Es pot testar mitjançant proves específiques - com la immunofluorescència (la pràctica més segura), la immunoperoxidasa o amb sondes de DNA marcades radioactivament - en seccions congelades o talls histològics de pulmó i fetge.[2]
La presència d'antígens del PPV pot ser demostrada als pulmons i al fetge dels garrins momificats, però no en els nascuts morts, en els que es pot trobar els anticossos específics contra el parvovirus als transsudats pleurals i peritoneals.[6]
Diagnòstic al laboratori
[modifica]Per fer un bon diagnòstic al laboratori es necessitarien mostres de fetus momificats i de residus fetals. Una alternativa seria usar el sèrum de truges, tant mares com joves, la primera mostra recollida al moment del fracàs reproductiu i la segona a les 2 o 4 setmanes després - ja que la vida mitjana dels anticossos maternals contra el PPV és d'uns 20 dies aproximadament. El sèrum dels fluids dels fetus, garrins morts o del cordó umbilical dels garrins vius sense que hagin pres calostre, també pot ser útil per a fer el diagnòstic d'anticossos específics del PPV.[1]
Aïllament de l'agent
[modifica]Per detectar el PPV en fetus amb una longitud de corona de "anca" menor a 16 cm per la seva activitat hemaglutinant o per anticossos fluorescents.[7]
Serologia
[modifica]Per detectar els anticossos del PPV en fetus amb una longitud de corona de "anca" major a 16 cm o en truges.[7]
Efectes citopàtics
[modifica]Els efectes citopàtics del PPV als cultius cel·lulars són inclusions intracel·lulars, nuclis picnòtics, granulacions, formes irregulars, replicació lenta i la mort cel·lular.
Reacció en cadena de la polimerasa (PCR)
[modifica]La reacció en cadena de la polimerasa (PCR) és una tècnica amb alta sensibilitat i especificitat per a la detecció de virus en mostres clíniques, inclús millor que l'hemaglutinació. En aquest cas és la tècnica més útil per a la detecció de PPV en teixits fetals, semen i altres mostres - tal com s'ha descrit en nombrosos protocols de PCR.
Proves serològiques
[modifica]Les proves serològiques són útils quan els teixits fetals no es troben amb bon estat.
Com que hi ha una alta prevalença de PPV i el temps entre la infecció i l'observació de pèrdues a la reproducció és llarg, s'usen dues mostres de sang i s'avalua en canvi de concentració d'anticossos (amb els títols) de les dues mostres.[6]
Inhibició de l'hemaglutinació (IH)
[modifica]El PPV té la capacitat d'hemaglutinar els eritròcits, de manera que es pot usar aquesta propietat per detectar la presència d'anticossos que s'uneixen als epítops dels factors d'hemaglutinació del virus, de manera que s'inhibeix l'hemaglutinació.
La inhibició de l'hemaglutinació (IH) és la pràctica més usada per a quantificar els anticossos específics del PPV. Els resultats es poden veure afectats per la temperatura d'incubació o per la font dels eritròcits. El sèrum usat per al diagnòstic és pretractat per inactivació amb calor (56 °C durant 30 minuts) seguit d'una adsorció dels eritròcits per tal d'eliminar les hemaglutinines no específiques i els inhibidors de l'hemaglutinació.
En els tests IH, si la porció hemaglutinant del virus reacciona amb els anticossos específics del sèrum problema, l'hemaglutinació dels eritròcits es bloqueja de manera que veurem un punt d'eritròcits al fons del pou de la microplaca - donant un resultat positiu de la prova, ja que els anticossos contra aquest antigen hi són presents. D'altra banda, si els eritròcits s'aglutinen després d'afegir el sèrum, significarà que el sèrum no contenia els anticossos correctes i veurem una taca al fons del pou de la microplaca.

El sèrum dels porcs ha de ser tractat prèviament per tal d'eliminar les hemaglutinines o els inhibidors de l'hemaglutinació no específics, com hem dit anteriorment, i a les proves s'usa un sèrum inicial diluït al 1:10, i a partir d'aquest, es van fent dilucions per obtenir el títol correcte - màxima dilució del sèrum amb presència d'anticossos perquè la prova sigui positiva.[1]
ELISA
[modifica]L'ELISA és preferible a la IH perquè es pot fer de manera estàndard i automatitzada per a proves d'alt nivell i no requereix un pretractament del sèrum abans de ser testat. ELISA pot distingir els animals vacunats dels animals infectats per PPV.
Les vacunes inactivades només provoquen la producció d'anticossos contra les proteïnes estructurals, mentre que ELISA detecta els anticossos contra les proteïnes no estructurals tipus 1 que expressa el virus durant la seva replicació en els porcs infectats.[1]
Tractament i prevenció
[modifica]No existeix cap tractament contra la infertilitat induïda pel parvovirus porcí (PPV).[3]
Per tal de prevenir la malaltia, mentre hi hagi símptomes de la infecció no es poden comprar nous animals. A més, les truges nulípares han de ser infectades amb PPV o vacunades abans de la primera inseminació.[8] Aquelles truges que hagin superat la infecció es podran seguir utilitzant per a la reproducció sempre que tornin a tenir el cicle estral i quedin gestants. Els animals que ja han passat la infecció seran immunes.[9]
Mètodes d'immunització:
- Immunització natural: Consisteix a infectar a les truges seronegatives a partir de posar-les en contacte amb truges seropositives que estiguin excretant el virus o bé traslladar a les truges joves a una zona que estigui contaminada pel PPV. No és un mètode fiable, però, perquè no es pot assegurar que tots els animals negatius quedin infectats i també és perillós perquè es pot donar la difusió d'altres patògens.
- Vacunació: És l'únic mètode de garantir que les truges joves desenvolupin una immunitat activa enfront al PPV abans de la primera cubrició. Les vacunes tenen l'objectiu d'oferir-li una immunitat abans i durant el període de gestació. No obstant, la vacuna s'ha de realitzar després que desaparegui la immunitat calostral en les nulípares. Per tal de vacunar a les truges s'han de seguir unes pautes vacunals; la primera vacuna s'ha de subministrar en dues dosis separades entre 3-4 setmanes abans de la cubrició i després és necessari realitzar una revacunació en cada lactació uns 7-10 dies després del part.
També és important vacunar els verros, ja que és un mètode preventiu per disminuir la diseminació de la malaltia. S'ha de fer una primera vacuna en dues dosis 4 setmanes abans de la munta i una revacunació cada 4-6 mesos.
Les vacunes clàssiques contra malalties greus causades per parvovirus estan basades en l'ús d'agents químics inactivants com ara l'acetiletileneimina o la propiolactona en el PPV, i la formalina en el virus de l'enteritis del visó (MEV). La capacitat d'autoacoblament de les càpsides de parvovirus en sistemes d'expressió heteròlegs està canviant radicalment aquest escenari cap a vacunes més efectives i segures basades en càpsides buides purificades (partícules similivíriques, o virus-like particles (VLPs) en anglès), obtingudes fonamentalment de vectors de baculovirus.[10] Les vacunes poden ser, doncs, vacunes inactivades (KV), utilitzades quan l'explotació és negativa a PPV; i també vacunes vives modificades (MLV), que indueixen una resposta immune de llarga durada. Totes elles pretenen produir un nivell d'immunitat suficient en les truges gestants per tal de reduir la virèmia a un nivell on és poc probable que el virus pugui travessar la placenta.
Cal recordar que qualsevol vacuna ha de ser administrada sota la supervisió d'un veterinari. La duració de la immunitat no es pot preveure, encara que hi ha estudis que demostren l'eficàcia fins quatre mesos després de l'administració d'una vacuna inactivada.
En general, les respostes serològiques després de la vacunació són més baixes que les de la infecció natural.
Referències
[modifica]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Jeffrey J.Zimmerman, Locke A.Karriker, Alejandro Ramirez, Kent J.Schwartz and Gregory W.Stevenson. Diseases of swine. 10th edition. USA. Wiley-Blackwell; 2012.
- ↑ 2,0 2,1 D.J. Taylor, 7th edition, Pig Deseases, St Edmundsbury Press, Great Britain.
- ↑ 3,0 3,1 3,2 Diseases of Swine. 9th Edition (en anglès). USA: Blackwell Publishing, 2006, p. 1153. ISBN 978-0-8138-1703-3.
- ↑ Gava, D; Wentz, I «Perfil inmunologico del parvovirus porcino frente a dieferentes desadios sanitarios». Revista Avances, 2013.
- ↑ Sanchez Murillo, J.M. «Parvovirosis porcina». Mundo ganadero. 1993-11. (Ministerio de agricultura y medio ambiente), 1993.
- ↑ 6,0 6,1 8th edition, The Merck Veterinary Manual, National Publishing Inc., USA..
- ↑ 7,0 7,1 D.C. Blood, J.A. Henderson, O.M. Radostits, 6th edition, Medicina Veterinaria, Bailliere Tindall, Mexico.
- ↑ «Órgano Oficial de la Asociación de Porcinocultura Científica».
- ↑ «Parvovirosis porcina».
- ↑ Carrasco, Luis; Almendral del Río, José Mª. Virus patógenos. España: Editorial Hélice, 2006, p. 640. ISBN 978-8488562258.
Bibliografia
[modifica]- Jeffrey J.Zimmerman, Locke A.Karriker, Alejandro Ramirez, Kent J.Schwartz and Gregory W.Stevenson. Diseases of swine. 10th edition. USA. Wiley-Blackwell; 2012
- Gava, D., Wentz, I., ‘Perfil inmunologico del parvovirus porcino frente a dieferentes desadios sanitarios'. Revista Avances. 2013. : http://revistaavances.com/perfil-inmunologico-del-parvovirus-porcino-frente-a-diferentes-desafios-sanitarios/’[Enllaç no actiu])
- Sanchez Murillo, J.M. et al., ‘Parvovirosis porcina’. Mundo ganadero. 1993-11. Ministerio de agricultura y medio ambiente. 1993
- D.J. Taylor, 7th edition, Pig Deseases, St Edmundsbury Press, Great Britain
- W.J. Smith, D.J. Taylor, R.H.C Penny, Atlas en color de Patologia Procina, Interamericana McGrau Hill, Espanya
- D.C. Blood, J.A. Henderson, O.M. Radostits, 6th edition, Medicina Veterinaria, Bailliere Tindall, Mexico
- 8th edition, The Merck Veterinary Manual, National Publishing Inc., USA
- (Sanchez Murillo, J.M. et al., ‘Parvovirosis porcina’. Mundo ganadero. 1993-11. (Ministerio de agricultura y medio ambiente. 1993)
- A. D. Leman, Barbara Straw et al., "Diseases of swine". 6th edition, IOWA STATE UNIVERSITY PRESS.
- repositorio.utc.edu.ec/bitstream/27000/816/1/T-UTC-1175%281%29.pdf
- http://issuu.com/instituto_leblu/docs/separata_hipra_75_web
