Pressió de vapor

La pressió de vapor o tensió de vapor[1] és la pressió exercida per un vapor en equilibri termodinàmic amb les seves fases condensades (sòlida o líquida) a una temperatura concreta i en un sistema tancat. La pressió de vapor dona una indicació de la taxa d'evaporació d'un líquid, i explica la tendència de les partícules a escapar-ne. Una substància amb una alta pressió de vapor a temperatures normals se sol qualificar de volàtil.
La pressió de vapor de qualsevol substància augmenta de manera no lineal amb la temperatura segons la relació de Clausius-Clapeyron. El punt d'ebullició a pressió atmosfèrica d'un líquid és la temperatura a la qual la pressió de vapor és igual a la pressió atmosfèrica ambiental. Amb qualsevol augment incremental d'aquesta temperatura, la pressió de vapor esdevé suficient per sobrepassar la pressió atmosfèrica i fer que es comencin a formar bombolles en el líquid. La formació de bombolles al fons del líquid requereix una pressió més elevada i, per tant, una temperatura més elevada, ja que la pressió del fluid augmenta amb la fondària.
El factor més important que determina el valor de la pressió de saturació és la pròpia naturalesa del líquid, trobant-se que, en general, entre líquids de naturalesa similar, la pressió de vapor a una temperatura donada és tant menor com més gran és la massa molecular del líquid.
La pressió de vapor amb la qual un dels components d'una mescla contribueix a la pressió total del sistema s'anomena pressió parcial. Per exemple, l'aire a nivell del mar saturat amb vapor d'aigua a 20 °C té pressions parcials d'uns 23 mbar d'aigua, 780 mbar de nitrogen, 210 mbar d'oxigen i 9 mbar d'argó.
Mesura i unitats
[modifica]La pressió de vapor es mesura en les unitats estàndard de pressió. El Sistema Internacional d'Unitats reconeix la pressió com una unitat derivada del SI amb la dimensió de força per àrea, i designa el pascal (Pa) com la seva unitat estàndard. Un pascal és un newton per metre quadrat (N·m−2 o bé kg·m−1·s−2).
La mesura experimental de la pressió de vapor consisteix en un procediment simple per pressions normals entre 1 i 200 kPa.[2] Els resultats més precisos s'obtenen a prop del punt d'ebullició, i es tenen grans errors de resultat per mesures a pressions més petites que 1 kPa. El procediment sol consistir a purificar la substància de prova, aïllar-la en un contenidor, evacuar qualsevol gas extern i llavors mesurar la pressió d'equilibri de la fase gasosa de la substància en el contenidor a diferents temperatures. S'aconsegueix més precisió prenent cura que tant la substància sencera com el seu vapor es troben a la temperatura desitjada: això se sol aconseguir amb l'ús d'un isoteniscopi submergint el contenidor en un bany líquid.
Estimació mitjançant l'equació d'Antoine
[modifica]L'equació d'Antoine és una expressió matemàtica que relaciona la pressió de vapor i la temperatura d'un líquid pur o de substàncies sòlides (per a mescles de líquids cal fer servir la llei de Raoult; vegeu Mescles de líquids).[3][4] La forma bàsica és:
On P és la pressió de vapor absoluta de la substància, T és la temperatura de la substància, A, B i C són coeficients específics de la substància (altrament dit, constants o paràmetres), i el logaritme sol ser un logaritme de base 10 o un logaritme neperià.[4]
De vegades s'utilitza una forma simplificada de l'equació amb només dos coeficients:
Les sublimacions i vaporitzacions d'una mateixa substància tenen conjunts diferents de coeficients d'Antoine, d'igual manera que els components de mescles.[3] Cada conjunt de paràmetres per un compost específic és tan sols aplicable a un cert rang de temperatures. Generalment s'escullen els rangs de temperatures per tal de mantenir una precisió de l'equació del voltant del 8-10%. Per moltes substàncies volàtils existeixen diferents conjunts de paràmetres per a diferents rangs de temperatura. L'equació d'Antoine presenta una baixa exactitud amb qualsevol conjunt de paràmetres quan s'utilitza a partir del punt de fusió d'un compost fins a la seva temperatura crítica. La precisió també es veu reduïda quan la pressió de vapor es troba per sota dels 10 torr a causa de les limitacions de l'aparell utilitzat per determinar els valors dels paràmetres d'Antoine.
Relació amb el punt d'ebullició
[modifica]
Com a norma general, les pressions de vapor de líquids a temperatura ambient augmenta quan baixen els punts d'ebullició, la qual cosa queda plasmada a les gràfiques de pressió de vapor, la qual mostra la pressió de vapor en funció de la temperatura per una varietat de líquids.[5] Per exemple, a una certa temperatura, el clorur de metil té la pressió de vapor més elevada de qualsevol dels líquids del diagrama de la dreta, i també té el punt d'ebullició normal més baix (−24,2 °C), que és el punt on la corba de la pressió de vapor del clorur de metil (la línia blava) intersecta amb la línia de pressió horitzontal d'una atmosfera (atm) de pressió de vapor absoluta.
Encara que la relació entre la pressió de vapor i la temperatura és no lineal, la gràfica utilitza un eix logarítmic vertical per produir línies poc corbes de tal manera que en un mateix gràfic hi puguin cabre força líquids. S'obté una línia gairebé recta quan el logaritme de la pressió de vapor es representa contra 1/(T+230),[6] on T és la temperatura en graus Celsius.
La pressió de vapor d'un líquid en el seu punt d'ebullició és igual a la pressió ambiental que l'envolta.
Mescles de líquids
[modifica]La llei de Raoult dona una aproximació de la pressió de vapor de mescles de líquids. Postula que l'activitat (pressió o fugacitat) d'una mescla d'una sola fase equival a la suma ponderada per fracció molar de les pressions de vapor dels components de la mescla:
On ptot és la pressió de vapor de la mescla, i representa cadascun dels components de la mescla i Xi és la fracció molar d'aquest component en la mescla líquida. El terme piΧi és la pressió parcial del component i en la mescla. La llei de Raoult és només aplicable a no electròlits (espècies sense càrrega), i és més apropiada per molècules apolars amb només atraccions intermoleculars febles (com ara forces de London).
Els sistemes que tenen pressions de vapor més elevades que les indicades per la fórmula anterior es diu que tenen desviacions positives. Tal desviació suggereix una atracció intermolecular més feble que ens els components purs, de tal manera que es pot entendre com si les molècules es "retinguin" a la fase líquida amb menys força que en el líquid pur. Un exemple és la mescla azeotròpica d'aproximadament el 95% d'etanol i la resta d'aigua: com que la pressió de vapor de la mescla és més elevada que la que prediu la llei de Raoult, la mescla bull a una temperatura inferior a la de qualsevol de la dels punts d'ebullició de qualsevol dels components.
D'altra banda, també existeixen sistemes amb desviacions negatives que tenen pressions de vapor inferiors a les esperades. Aquesta desviació suggereix que hi ha una atracció intermolecular més forta entre els constituents de la mescla que la que existeix en els components purs. Per tant, les molècules són "retingudes" amb més força quan hi ha una segona molècula present. Un exemple és la mescla de triclorometà (cloroform) i 2-propanona (acetona), que bull a una temperatura per sobre de la dels punts d'ebullició de qualsevol dels components.
Les desviacions positiva i negativa es poden utilitzar per determinar els coeficients d'activitat termodinàmica dels components de les mescles.
Sòlids
[modifica]
La pressió de vapor es pot definir com la pressió a la qual una fase condensada es troba en equilibri amb el seu propi vapor. En el cas d'un sòlid d'equilibri, tal com un cristall, es pot definir com la pressio quan la taxa de sublimació del sòlid equival a la taxa de deposició de la seva fase de vapor. Per la majoria de sòlids aquesta pressió és molt baixa, però hi ha algunes excepcions notables com el naftalè, el gel sec (la pressió de vapor del gel sec és de 5,73 MPa o 56,5 atm a 20 °C) i el gel. Tots els materials sòlids tenen pressió de vapor; tanmateix, a causa dels seus valors sovint molt baixos, la mesura pot ser molt difícil. Algunes tècniques són l'ús de la termogravimetria i de la transpiració gasosa.
Existeixen mètodes per calcular la pressió de sublimació (és a dir, la pressió de vapor) d'un sòlid. Un mètode consisteix a estimar la pressió de sublimació a partir de pressions de vapor líquides extrapolades (del líquid superrefredat), si es coneix la calor de fusió, fent servir aquesta forma particular de l'equació de Clausius-Clapeyron:[7]
On:
- és la pressió de sublimació del component sòlid a la temperatura .
- és la pressió de vapor extrapolada del component líquid a temperatura .
- és la calor de fusió.
- és la constant dels gasos.
- és la temperatura de sublimació
- és la temperatura de fusió.
Aquest mètode assumeix que la calor de fusió és independent de la temperatura, ignora temperatures de transició addicionals entre diferents fases sòlides i dona una estimació correcte de temperatures que no s'allunyin gaire del punt de fusió. També demostra que la pressió de sublimació és menor que la pressió de vapor líquida extrapolada (ΔfusH > 0) i que la diferència augmenta quan augmenta la distància al punt de fusió.
Pressió de vapor de l'aigua
[modifica]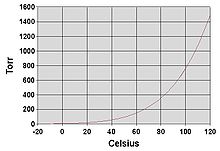
Com tots els líquids, l'aigua bull quan la seva pressió de vapor s'iguala amb la pressió ambiental que l'envolta. A la naturalesa, la pressió atmosfèrica és inferior a elevacions altes, on l'aigua bull a una temperatura menor. La temperatura d'ebullició de l'aigua a una certa pressió atmosfèrica es pot aproximar per la següent expressió (que és l'equació d'Antoine amb els paràmetres corresponents a l'aigua):
Ona la temperatura Tb és el punt d'ebullició en °C i la pressió P és en torr.
Regla de Dühring
[modifica]La regla de Dühring postula que existeix una relació lineal entre les temperatures a les quals dues dissolucions exerceixen la mateixa pressió de vapor.
Llista de valors de pressions de vapor per diferents substàncies
[modifica]La següent taula mostra una llista de diverses substàncies ordenada per la seva pressió de vapor.
| Substància | Pressió de vapor (unitats del SI) |
Pressió de vapor (bar) |
Pressió de vapor (mmHg) |
Temperatura |
|---|---|---|---|---|
| Tungstè | 100 Pa | 0,001 | 0,75 | 3.203 °C |
| Etilenglicol | 500 Pa | 0,005 | 3,75 | 20 °C |
| Difluorur de xenó | 600 Pa | 0,006 | 4,50 | 25 °C |
| Aigua | 2,3 kPa | 0.023 | 17,5 | 20 °C |
| Propanol | 2,4 kPa | 0,024 | 18,0 | 20 °C |
| Etanol | 5,83 kPa | 0,0583 | 43,7 | 20 °C |
| Metil-isobutil-cetona | 2,66 kPa | 0,0266 | 19,95 | 25 °C |
| Freon 113 | 37,9 kPa | 0,379 | 284 | 20 °C |
| Acetaldehid | 98,7 kPa | 0,987 | 740 | 20 °C |
| Butà | 220 kPa | 2,2 | 1.650 | 20 °C |
| Formaldehid | 435,7 kPa | 4,357 | 3.268 | 20 °C |
| Propà | 1,013 MPa | 10,133 | 7.600 | 25,6 °C |
| Sulfur de carbonil | 1,255 MPa | 12,55 | 9.412 | 25 °C |
| Diòxid de carboni | 5,7 MPa | 57 | 42.753 | 20 °C |
Significat en meteorologia
[modifica]En meteorologia, el terme pressió de vapor s'utilitza per referir-se a la pressió parcial del vapor d'aigua a l'atmosfera, fins i tot si no està en equilibri,[8] i la "pressió de vapor d'equilibri" s'especifica d'una manera diferent. Els meteoròlegs també utilitzen el terme "pressió de vapor de saturació" per referir-se a la pressió de vapor d'equilibri de l'aigua o salmorra sobre una superfície plana, per distingir-la de la pressió de vapor d'equilibri, que té en compte la forma i la mida de les gotes de l'aigua i partícules a l'atmosfera.[9]
Referències
[modifica]- ↑ «Pressió de vapor». Cercaterm. TERMCAT, Centre de Terminologia.
- ↑ K. Růžička, M. Fulem, V. Růžička. «Vapor Pressure of Organic Compounds. Measurement and Correlation» (en anglès). Arxivat de l'original el 2016-06-04. [Consulta: 22 gener 2014].
- ↑ 3,0 3,1 What is the Antoine Equation? Arxivat 2012-12-14 a Wayback Machine. (Chemistry Department, Frostburg State University, Maryland)
- ↑ 4,0 4,1 R.K.Sinnot. Chemical Engineering Design (en anglès). 4a ed.. Butterworth-Heinemann, 2005, p. 331. ISBN 0-7506-6538-6.
- ↑ Perry, R.H. and Green, D.W. (Editors). Perry's Chemical Engineers' Handbook (en anglès). 7a ed.. McGraw-Hill, 1997. ISBN 0-07-049841-5. Arxivat 2024-07-15 a Wayback Machine.
- ↑ Dreisbach, R. R.; Spencer, R. S. «Infinite Points of Cox Chart Families and dt/dP Values at any Pressure. Mathematical Formulas» (en anglès). Industrial & Engineering Chemistry, 41, 1, 1-1949, pàg. 176–181. Arxivat de l'original el 2023-05-31. DOI: 10.1021/ie50469a040. ISSN: 0019-7866 [Consulta: 15 juliol 2024].
- ↑ Moller, Bruce; Rarey, Jürgen; Ramjugernath, Deresh «Estimation of the vapour pressure of non-electrolyte organic compounds via group contributions and group interactions» (en anglès). Journal of Molecular Liquids, 143, 1, 9-2008, pàg. 52–63. Arxivat de l'original el 2024-07-15. DOI: 10.1016/j.molliq.2008.04.020 [Consulta: 15 juliol 2024].
- ↑ «Glossary» (en anglès). Developed by the American Meteorological Society. Arxivat de l'original el 2011-04-15.
- ↑ «A Brief Tutorial (An article about the definition of equilibrium vapor pressure)» (en anglès). jhuapl.edu. Arxivat de l'original el 2022-09-22. [Consulta: 31 octubre 2022].













