Ribozim cap de martell

El ribozim hammerhead o cap de martell és un tipus d'àcid ribonucleic que s'autocatalitza (es talla a si mateix) mitjançant un petit motiu d'estructura secundària conservada que s'anomena cap de martell per la seva forma.[1] La majoria de ARNs hammerhead són subconjunts de dues classes d'ARN patogènic vegetal: els ARN satèl·lit dels RNA vírics i dels viroides. Les reaccions autocatalítiques, les quals foren descrites per primer cop el 1986,[2][3] són part d'un mecanisme de replicació cíclica. La seqüència del hammerhead és suficient per a l'autocatalització[4] i actua formant una estructura terciària tridimensional conservada.
Autocatalitzador o enzim?
[modifica]En l'estat natural, un motiu d'ARN hammerhead és una cadena simple (una sola cadena) d'ARN, i tot i que la segmentació és autocatalítica i té lloc en absència d'enzims proteics, l'ARN hammerhead per sí sol no és un veritable enzim en aquest estat, ja que no pot catalitzar múltiples substrats, perquè queda modificat després de la primera catalització. In vitro els hammerhead poden ser modificats per tal que s'estructuri en una doble cadena d'ARN. La cadena segmentada, es pot substituir, se'n proporciona en excés i d'aquesta manera es va demostrar que podia catalitzar una sèrie de reaccions que obeïen la cinètica de Michaelis-Menten, cinètica típica dels enzims proteics. Aquestes construccions o modificacions s'utilitzen per experiments in vitro, i el terme “ARN hammerhead” ha esdevingut a la pràctica un sinònim de “ribozim hammerhead”, que s'utilitza amb més freqüència. La petita seqüència del ribozim hammerhead que és catalíticament activa consisteix en tres cues de parells de bases que flanquegen un nucli central de 15 nucleòtids. Les bases centrals, amb poques excepcions, són essencials per l'activitat catalítica dels ribozims. Aquestes modificacions de ribozims hammerhead mostren una taxa de recanvi d'aproximadament una molècula/minut, i una km de l'ordre de 10 nanomolar. El ribozim hammerhead és el que està millor caracteritzat. La seva mida petita, la seva química catalítica exhaustivament investigada, la seva estructura cristal·lina coneguda, i la seva rellevància biològica fan que els ribozims hammerhead siguin particularment adequats per a la investigació bioquímica i biofísica de la natura fonamental de la catàlisi d'ARN. Els ribozims hammerhead també poden tenir un paper important com a agents terapèutics; com a enzims definits com a seqüències d'ARN, com a biosensors, i per a aplicacions en genòmica funcional i descobriment de gens.[5]
Distribució d'espècies
[modifica]Els ribozims hammerhead es troben en un ampli ventall de viroides de plantes, helmints i, més recentment, en un petit nombre d'arqueobacteris i eubacteris.[6]
- Viroide causant del mosaic latent del presseguer (Peach latent mosaic viroid, PLMV)
- Viroide latent de l'albergínia (Eggplant latent viroid)
- Avocado sunblotch viroid (ASBVd)
- Velvet tobacco mottle virus Satellite RNA
- ADN satèl·lit de l'espècie Schistosoma mansoni (Schistosoma mansoni Satellite DNA)[7]
- DNA semblant al viroide del clavell (Dianthus caryophyllus viroid-like DNA)
- RNA petit i circular de la cirera, semblant al d'un viroide (Cherry small circular viroid-like RNA)
- Tritó
- Grill de cova del gènere Dolichopoda (Dolichopoda cave cricket)
La química de la catàlisi
[modifica]El ribozim hammerhead duu a terme una reacció química simple que resulta en el trencament de la cadena d'ARN substrat, específicament al C17, el nucleòtid de punt de tall. Tot i que sovint ens referim a l'escissió d'ARN com a hidròlisi, de fet el mecanisme empleat no inclou l'addició d'aigua. En realitat, la reacció catalítica d'escissió és simplement una isomerització que consisteix en la redistribució dels enllaços fosfodièster. Químicament és la mateixa reacció que succeeix en la degradació aleatòria mediada per bases de l'ARN, excepte que aquesta és molt més específica i la taxa de plegament és accelerada 10.000 vegades o més.

Escissió per isomerització fosfodièster
[modifica]La reacció d'escissió és una isomerització fosfodièster que s'inicia degut a l'extracció del protó del punt de tall ribosa2'-hidroxil des del 2'-oxigen, el qual esdevé llavors el nucleòfil atacant en una reacció “en línia” o del tipus SN2(P), tot i que no se sap si aquest protó és extret abans o durant el pas de la reacció d'escissió del hammerhead. (Tècnicament, la reacció d'escissió no és biomolecular, però es comporta de la mateixa manera que una reacció SN2(P) verdadera; aquesta és sotmesa a una inversió de la configuració posterior a la formació d'un estat de transició que consisteix en un oxifosforà pentacoordinat). Els oxígens atacants i els de l'anomenat “grup sortint” ocuparan les dues posicions axials en l'estructura d'estat de transició trigonal bipiramidal, tal com es requereix per al mecanisme de la reacció SN2.
El 5'-producte, com a resultat d'aquest mecanisme de reacció catalítica o d'escissió, posseeix un terminal 2'3'-ciclic fosfat, i el 3'-producte té un terminal 5'-OH, de la mateixa manera que en l'escissió alcalina no enzimàtica de l'ARN. Per tant, la reacció és, en principi, reversible ja que el fosfat escindible manté un fosfodièster, i pot ser que d'aquesta manera actuï com a substrat per a lligadures mediades per ARN de hammerheads sense requeriment d'ATP o una font d'energia exògena similar. La reacció catalitzada per ribozims hammerhead, a diferència de la teòricament idèntica escissió alcalina no enzimàtica de l'ARN, és una reacció catalítica d'alta especificitat, amb una taxa de “turnover” (reaccions que pot catalitzar) d'aproximadament 1 molècula de substrat per molècula d'enzim per minut a pH= 7,5 en 10mM Mg2+ (anomenades condicions de reacció estàndard per a la mínima seqüència d'ARN hammerhead), depenent de la seqüència de la construcció del ribozim hammerhead particularment mesurada. Això representa una taxa de plegament 10.000 vegades superior aproximadament respecte a l'excisió no enzimàtica.
Necessitat d'ions metàl·lics divalents
[modifica]En principi es pensava que tots els ribozims eren metal·loenzims, en el sentit que requereixen la presència de cations divalents, com el Mg2+, tant pel plegament com per la catàlisi. Es va suposar que els ions de magnesi hexahidratat, que existeixen en equilibri amb l'hidròxid de magnesi, podrien jugar els papers d'àcid i de base, en un camí anàleg als papers jugats per dos histidines en l'ARNasa. També s'ha proposat com a paper addicional pels ions divalents metàl·lics l'estabilització en forma electroestàtica de l‘estat de transició.
No és un metal·loenzim
[modifica]El 1998 es va descobrir[8] que el ribozim hammerhead, així com el “VS ribozim” i el ribozim “hairpin”, no requerien la presència d'ions metàl·lics per la catàlisi, a condició que hi hagués una concentració suficientment alta de cations monovalents per permetre a l'ARN doblegar-se. Aquest descobriment va suggerir que l'ARN en comptes de servir com un inert esglaó passiu per la unió d'ions metàl·lics divalents químicament actius, estava involucrat en la química de la catàlisi. En els últims resultats estructurals, descrits a continuació, confirmen que dos nucleòtids invariants, el G12 i G8, juguen papers compatibles amb el d'àcid i base en la reacció de segmentació del hammerhead. Estrictament parlant doncs, el riboenzim hammerhead no pot ser un metal·loenzim.
Estructura primària i secundària
[modifica]L'estructura mínima
[modifica]La seqüència mínima de hammerhead que es requereix per a la reacció d'autosegmentació inclou aproximadament 13 nucleòtids principals, la major part dels quals no estan implicats en la formació de parelles de bases de Watson-Crick.
La regió principal està rodejada de les Stems I, II i III, les quals estan generalment fetes de parells de bases Watson-Crick, però per altra banda no estan obligats a respectar la seqüència. La taxa de repetició de catàlisi de l'estructura mínima del ribozim hammerhead és aproximadament 1/min (comunament s'observa un rang de 0.1/min a 10/min, depenent de les seqüències no conservades i de les longituds de les tres cadenes helicoïdals). La major part de la investigació experimental que s'ha fet sobre els ribozims hammerheard han utilitzat l'estructura mínima.
ARN hammerheard tipus I i tipus III
[modifica]Estructuralment el ribozim hammerheard està compost de tres hèlix anomenades I, II, III que juntes formen una triple hèlix. El ribozim es pot classificar en tres tipus diferents segons la localitazació dels extrems 5' i 3' en l'hèlix. Si els extrems 5' i 3' d'una seqüència es troben a la cadena I, aleshores és un ribozim hammerhead del tipus I, i si l'extrem 3' d'una seqüència se situen a la cadena III, aleshores és un ribozim hammerhead tipus III. Dels tres tipus possibles, els tipus I i III són els més comuns. El tipus II ha estat descobert recentment i és bastant abundant en els bacteris.[9]
Cadena completa
[modifica]La cadena completa del ribozim consisteix en una seqüència addicional d'elements en les cadenes I i II que permeten la formació de contactes terciaris addicionals. Aquestes interaccions terciàries estabilitzen la conformació activa del ribozim, donant lloc a taxes de segmentació 1.000 vegades superior que les corresponents de la seqüència mínima.[10]
Estructura terciària
[modifica]Estructura mínima
[modifica]L'estructura mínima del ribozim hammerheard ha estat exhaustivament estudiada per bioquímics i enzimòlegs així com pel cristal·lografiadors de rajos X, i espectròscops de RMN i altres especialistes en tècniques biofísiques reconegudes. La primera informació estructural tridimensional detallada sobre el ribozim hammerheard va aparèixer el 1994 amb l'estructura cristal·lina del ribozim hammerhead unit al subtrat anàleg d'ADN, publicat a Nature pels investigadors Pley, Flaherty i McKay. Posteriorment, tota l'estructura mínima del ribozim hammerhead va ser publicada per Scott, Pinzón y Klug a Cell a principis de 1995.
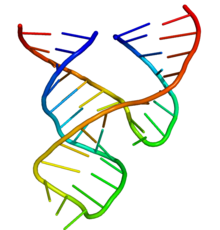
Aquesta estructura mínima està composta per tres hèlix entrellaçades, separades per enllaços curts de seqüències conservades com es mostra a l'estructura de cristall.[11]
Aquestes hèlixs s'anomenen I, II i III. El gir d'uridina conservat uneix les hèlixs I i II i normalment conté la seqüència CUGA. Les hèlixs II i III s'uneixen per una seqüència GAAA. La reacció de segmentació es produeix entre l'hèlix III i la I, i es produeix normalment en una C (citosina). L'estructura del ribozims de cadena completa mostra que hi ha una àmplia interacció entre el llaç de la cadena I i la II.[12] Els ribozims hammerhead poden distribuir-se en tres classes segons quina de les tres cadenes està formada a partir de l'extrem 5' i 3' de la seqüència. Si la cadena III està formada a partir del 5' i el 3' la major part de la seqüència es coneix com a classe III.
Estructura-funció
[modifica]Malgrat les observacions de catàlisi del ribozim hammerhead mínim en un vidre en el qual els enllaços de la xarxa cristal·lina limiten les posicions globals dels extrems distals de les tres cadenes helicoïdals que envolten el centre, molts experiments bioquímics dissenyats per estudiar les interaccions de l'estat de transició i la química de la catàlisi semblen ser incompatibles amb aquestes estructures cristal·lines.
Per exemple, s'ha observat que els residus nuclears invariables G5, G8, G12 i C3, en el mínim ribozim hammerhead són cada un d'ells tan fràgils que canviant un sol grup funcional exocíclic en qualsevol d'aquests nucleòtids dona com a resultat una gran reducció o supressió de l'activitat catalítica. Sembla que alguns d'aquests residus nuclears poden formar ponts d'hidrogen, entre els parells de bases de Watson i Crick (C-G), en qualsevol de les estructures del ribozim hammerhead mínim, excepte una interacció del G-5 en l'estructura del producte.
Un exemple particularment atractiu que es va observar recentment consistia en la identificació del G8 i G12 com a possibles participants d'una catàlisi àcid/base. Un cop demostrat que el ribozim hammerhead no necessitava ions metàl·lics divalents per a la catàlisi, es va anar fent evident de manera progressiva que el mateix RNA, en comptes d'acceptar ions divalents de forma passiva, tenien un paper directe en qualsevol reacció química àcid/base en el lloc actiu del ribozim hammerhead. No obstant, no estava del tot clar la manera en què el G12 i el G8 podien aconseguir això, tenint en compte les estructures mínimes originals del ribozim hammerhead.
Altres preocupacions inclouen un NOE entre el U4 i U7 del ribozim hammerhead segmentat que també s'havia observat durant la caracterització del MNR, la qual cosa suggereix que aquestes bases de nucleòtids han d'acostar-se entre si aproximadament 6 Å almenys, encara que l'enfocament proper de U7 a U4 no sembla possible degut a l'estructura cristal·lina. Finalment, com es va esmentar anteriorment, el nucleòfil atacant en les estructures originals, el 2'-OH del C17, no es trobava en una posició susceptible als atacs en línia sobre el fosfat escindible adjacent.
Potser el més preocupant van ser els experiments que suggerien que l'A-9 i els fosfats escindibles havien d'arribar dintre d'uns 4 Å de distància entre els uns i els altres en l'estat de transició, basant-se en la doble substitució de fosforotioats i experiments de rescat d'ions metàl·lics flexibles; la distància entre aquests fosfats en l'estructura cristal·lina del hammerhead mínim era d'uns 18Å, sense cap mecanisme clar d'enfocament proper si les formes A d'hèlix de la cadena II i cadena I eren tractades com a cossos rígids. En conjunt, aquests resultats suggerien que s'havia de produir un canvi de conformació a gran escala per assolir l'estat de transició de l'estructura del ribozim hammerhead mínim.
Per aquestes raons, les dues sèries d'experiments (bioquímica vs cristal·logràfica) semblaven no només estar en desacord, sinó que també semblaven ser desesperançadorament irreconciliables, cosa que generà una discòrdia considerable en el camp d'estudi. No hi havia cap prova convincent per descartar cap dels dos conjunts de resultats experimentals i per tant mai s'ha fet amb èxit, encara que es van fer moltes afirmacions a favor de cada una.
Llargada de l'estructura
[modifica]
El 2006, es va obtenir l'estructura cristal·lina del ribozim hammerhead amb una resolució de 2,2Å. Aquesta nova estructura sembla resoldre el més preocupant de les discrepàncies anteriors. En particular, el C17 es posiciona en la línia d'atac, i els residus invariants C3, G5, G8 i G12 apareixen tots els implicats en les interaccions de rellevància vital per a la catàlisi.
D'altra banda, es va observar que els fosfats escindibles i l'A9 són a 4,3Å de distància, d'acord amb la idea que, quan es modifiquen, aquests fosfats poden lligar un ió metàl·lic tiofílic.
L'estructura revela com els residus invariables, G-12 i G-8, es posicionen en el centre actiu coincidint amb el seu paper prèviament proposat de catàlisi àcid/base. G12 fa un pont d'hidrogen amb el 2'O del C17, el nucleòfil de la reacció de segmentació, i la ribosa del G8 fa ponts d'hidrogen amb el grup 5'-O, mentre la base nucleòtica del G8 forma una parella de Watson-Crick (o ponts d'hidrogen) amb l'invariable C3. Aquesta disposició permet suggerir que el G-12 és la base general de la reacció de segmentació i el G8 pot funcionar com un àcid, coincidint amb observacions bioquímiques prèvies. El G5 fa ponts d'hidrogen amb l'oxigen de la furanosa situada al C17, que l'ajuda a posicionar-se en la forma activa. Com a conseqüència de la formació de parella de bases entre el G8 i el C3, U4 i U7 es posicionen de manera que el NOE entre les seves bases s'explica fàcilment.
L'estructura cristal·lina de la cadena completa del ribozim hammerhead ensenya les principals preocupacions que amb l'anterior estructura cristal·lina mínima del ribozim hammerhead semblaven inconcebibles.
Estructura i catàlisi
[modifica]
Les interaccions terciàries al llarg de la cadena del ribozim hammerhead estabilitzen una conformació que segurament és l'activa. El nucleòfil, 2'-oxigen del nucleòtid situat al punt de tall, C17, està alineat de forma quasi perfecta formant una línia d'atac (reacció Sn2(P)). El G12 fa un pont d'hidrogen amb aquest nucleòfil, de manera que és capaç de treure un protó del 2'O si el G12 es desprotona. El 2'-OH del G8 forma un pont d'hidrogen amb el 5'O que deixa l'oxigen i així pot suplir la càrrega negativa acumulada subministrant un protó en el 5'O de la ribosa de A1.1.
La millor explicació és que la forma desprotonada del G12 és una base i la ribosa del G8 un àcid. El pKa en la cinètica del hammerhead ribozim és 8,5 mentre que el pKa de la guanosina és 9,5 aproximadament. És possible que aquest pKa de la G12 disminueixi de 9,5 a 8,5 en el centre catalític del ribozim; aquesta hipòtesi és subjecte d'una investigació intensa.

Si l'invariant G8 és canviat pel C8, la catàlisi és aturada. Tot i així, el doble mutant, G8C+C3G, manté la parella de base, G8-C3 (situada al llarg de la cadena), de manera que restaura l'activitat catalítica. S'observa que el 2'-OH del G8 és essencial per a la catàlisi. El reemplaçament d'aquest G8 per una desoxiG8 redueix el grau de la catàlisi induint que el 2'-OH té un paper crucial en el mecanisme catalític.
L'apropament entre l'A9 i el fosfat escindible requereix la presència d'alta concentració de càrregues positives. Això probablement és la raó per la qual els ions metàl·lics divalents requereixen una baixa força iònica que és compensada per altes concentracions de cations monovalents.
D'aquesta manera la reacció implica l'abstracció del protó-2' del C17 que va seguit de l'atac nucleofílic sobre el fosfat adjacent. Llavors l'enllaç entre el fosfat escindible i el 5'-O comença a trencar-se, el protó és subministrat per la ribosa del G8 que tendeix a tornar-se a protonar a costa d'una molècula d'aigua per mantenir el pont d'hidrogen dintre de l'estructura cristal·lina.
Aplicacions terapèutiques
[modifica]Actualment, s'estan utilitzant hammerhead ARN modificats com agents terapèutics.[13] Els ARN sintètics contenen seqüències complementàries al ARNm SOD1 mutant i s'estan estudiant les seqüències necessàries per formar l'estructura catalítica del hammerhead com a possible teràpia per l'esclerosi lateral amiotròfica. També s'està estudiant per saber si es podria utilitzar per trobar línies resistents de VIH en cèl·lules T.
L'ús terapèutic dels ribozims hammerhead amb segmentació trans s'ha vist obstaculitzat per la seva baixa activitat in-vivo. El potencial catalític autèntic del ribozim hammerhead trans pot ser recuperat in-vivo i els derivats terapèutics són susceptibles de complementar altres estratègies terapèutiques d'hibridació d'àcids nucleics. Actualment, hi ha ribozims hammerhead que estan a prop de tenir aplicacions clíniques.[5]
Referències
[modifica]- ↑ Forster AC, Symons RH (1987). "Self-cleavage of plus and minus RNAs of a virusoid and a structural model for the active sites". Cell 49 (2): 211–220. doi:10.1016/0092-8674(87)90562-9 PMID: 2436805
- ↑ Prody GA, Bakos JT, Buzayan JM, Schneider IR, Bruening G (1986). "Autolytic Processing of Dimeric Plant Virus Satellite RNA". Science 231 (4745): 1577–1580. doi:10.1126/science.231.4745.1577 PMID: 17833317
- ↑ Hutchins CJ, Rathjen PD, Forster AC, Symons RH (1986). "Self-cleavage of plus and minus RNA transcripts of avocado sunblotch viroid". Nucleic Acids Res. 14 (9): 3627–3640. doi:10.1093/nar/14.9.3627 PMC 339804. PMID: 3714492
- ↑ Forster AC, Symons RH. (1987). "Self-cleavage of virusoid RNA is performed by the proposed 55-nucleotide active site". Cell 50 (1): 9–16. doi:10.1016/0092-8674(87)90657-X PMID: 3594567
- ↑ 5,0 5,1 a b Hean J and Weinberg MS (2008). "The Hammerhead Ribozyme Revisited: New Biological Insights for the Development of Therapeutic Agents and for Reverse Genomics Applications". RNA and the Regulation of Gene Expression: A Hidden Layer of Complexity. Caister Academic Press. ISBN 978-1-904455-25-7.
- ↑ Perreault, J.; Weinberg, Z.; Roth, A.; Popescu, O.; Chartrand, P.; Ferbeyre, G.; Breaker, R. R. (2011).Wasserman, Wyeth W.. ed. "Identification of Hammerhead Ribozymes in All Domains of Life Reveals Novel Structural Variations". PLoS Computational Biology 7 (5): e1002031. doi:10.1371/journal.pcbi.1002031 PMC 3088659. PMID: 21573207
- ↑ Ferbeyre G, Smith JM, Cedergren R. (1998). "Schistosome satellite DNA encodes active hammerhead ribozymes". Mo. Cell. Biol. 18 (7): 3880–3888. PMC 108972. PMID: 9632772
- ↑ J.B. Murray, A.A. Seyhan, N.G. Walter, J.M. Burke and W.G. Scott (1998). "The hammerhead, hairpin and VS ribozymes are catalytically proficient in monovalent cations alone.". Chem Biol 5 (10): 587–595. doi:10.1016/S1074-5521(98)90116-8 PMID: 9818150.
- ↑ Perreault, J.; Weinberg, Z.; Roth, A.; Popescu, O.; Chartrand, P.; Ferbeyre, G.; Breaker, R. R. (2011). Wasserman, Wyeth W.. ed. "Identification of Hammerhead Ribozymes in All Domains of Life Reveals Novel Structural Variations". PLoS Computational Biology 7 (5): e1002031. doi:10.1371/journal.pcbi.1002031 PMC 3088659. PMID: 21573207 http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=3088659
- ↑ Khvorova A, Lescoute A, Westhof E, Jayasena SD. (2003). "Sequence elements outside the hammerhead ribozyme catalytic core enable intracellular activity". Nat Struct Biol. 10 (9): 708–712. doi:10.1038/nsb959 PMID: 12881719
- ↑ Scott WG, Finch JT, Klug A. (1995). "The crystal structure of an all-RNA hammerhead ribozyme: a proposed mechanism for RNA catalytic cleavage". Cell 81 (7): 991–1002. doi:10.1016/S0092-8674(05)80004-2 PMID: 7541315
- ↑ Martick M, Scott WG (2006). "Tertiary contacts distant from the active site prime a ribozyme for catalysis". Cell 126 (2): 309–320. doi:10.1016/j.cell.2006.06.036 PMID: 16859740
- ↑ Citti L, Rainaldi G. (2005). "Synthetic hammerhead ribozymes as therapeutic tools to control disease genes". Current Gene Therapy 5 (1): 11–24. PMID: 15638708
