Tènia (Taenia solium)
| Taenia solium | |
|---|---|
 escòlex | |
| Dades | |
| Principal font d'alimentació | glucosa, aminoàcid i glicerol |
| Hàbitat | intestí prim, múscul i teixit nerviós |
| Hoste | |
| Longitud | 8 m |
| Taxonomia | |
| Superregne | Holozoa |
| Regne | Animalia |
| Fílum | Platyhelminthes |
| Classe | Cestoda |
| Ordre | Cyclophyllidea |
| Família | Taeniidae |
| Gènere | Taenia |
| Espècie | Taenia solium Linnaeus, 2051 |
Taenia solium, també anomenada tènia de l'home, és un platihelmint paràsit de la classe dels cestodes que pertany a l'ordre dels ciclofil·lideus dins la família de les tènies (Taenidae). Taenia solium infecta a porcs, com a hoste intermediari i a l'ésser humà com a hoste definitiu. Es troba principalment a àrees rurals amb manca d'higiene de països pertanyents a Àsia, Àfrica i Amèrica del Sud.[1] En el seu estadi larvari causa cisticercosi i en fase adulta causa teniosi humana. La teniosi humana també pot estar causada per altres espècies de la família Taenidae com per exemple Taenia saginata, que infecta a bovins com a hostes intermediaris.[2] La teniosi és causada normalment per l'ingestió de carn de porc crua o poc cuinada.[3]
Història
[modifica]La tènia és un dels primers cucs helmints del quals trobem constància i se sap que ja es coneixia en l'antiguitat.[4] Les tènies es coneixien ja a l'antic Egipte, el Papir Ebers que data de l'any 1500 aC conté descripcions d'aquests helmints.[5]
Durant la història de la humanitat hi ha hagut diferents cultures que han considerat el porc com un animal impur o brut, es creu que aquesta visió era probablement deguda a la presència dels cisticercs (fase larvària d'algunes espècies del gènere Taenia) en la carn. La primera referència a la impuritat dels porcs va ser en la Bíblia hebrea i es data al voltant del 600-500 aC, tot i que no s'esmenten els cisticercs. Va ser Aristòtil al voltant del 384-322 aC qui va descriure els cisticercs en els músculs dels porcs.[5] Tot i aquest coneixement no va ser fins al 1558 que es van començar a descriure casos de neurocisticercosi on es van trobar aquestes vesícules, i fins al 1697 que es va descobrir que aquests cisticercs contenien l'escòlex de T.solium tot i que en aquell moment es van considerar no com a una forma del cicle biològic de la tènia sinó com a una espècie diferent.[5]
A finals del segle XIX la cisticercosi es va escampar per tota Europa fins que al 1900 es va avançar en el coneixement del cicle biològic i es van poder adoptar mesures de prevenció.[6] Aquests descobriments van ser en bona part deguts a diferents patòlegs alemanys. Un d'ells, Küchenmeister, finalment va demostrar que la ingestió dels cisticercs presents en els músculs dels porcs era la causa de la teniosi. L'experiment, tot i ser poc ètic, va ser molt efectiu. Küchenmeister va donar menjar infectat amb cisticercs a un home que estava condemnat a mort i posteriorment en va realitzar l'autòpsia on va trobar múltiples tènies a l'interior de l'individu.[5]
Els descobriments de Küchenmeister i altres patòlegs alemanys van ser corroborats als anys 1930 pels experiments de Kozen Yoshino.[5] L'any 1934 Yoshino va publicar un article que describia la infecció experimental amb T.solium d'ell mateix i de tres altres voluntaris. En la seva recerca Yoshino va estudiar els experiments fets per Küchenmeister i altres patòlegs que havien infectat a altres individus amb cisticercs per poder observar els adults posteriorment. En el seu article va descriure la llargada i nombre de proglotis dels cucs que recuperava tant d'ell com dels altres 3 voluntaris. Entre els 4 i 7 mesos després de la infecció es van tractar els tres voluntaris amb àcid filicínic per tal de posar fi a la infecció, però Yoshino va continuar la seva pròpia infecció fins als 15 mesos. Durant aquest temps va descriure acuradament els símptomes de la infecció i els cucs que recollia, que en el seu cas van arribar a mesurar entre 218 i 223 cm. De les diverses conclusions que va extreure, la primera va ser que els cisticercs poden infectar els humans i madurar fins a tènies adultes si s'empassen (amb una efectivitat d'entre un 60 i 100%) i una altra conclusió a remarcar va ser que la simptomatologia variava entre pacients, havent alguns que no mostraven cap símptoma.[7]
Recentment, especialment a partir del final del segle xx, es van popularitzar en determinats llocs la venda d'ous de Taenia per aprimar. Això comporta riscos molt elevats, donades les conseqüències que es poden patir.[8] Els ous s'ingerien en píndoles i en arribar a l'intestí maduraven a tènies adultes, a causa de la tènia les persones perdien pes tot i que en alguns casos també podien provocar vòmits i diarrees. A més depenent de l'espècie de tènia que les persones ingerien podien desenvolupar altres greus problemes com la cisticercosi. No obstant, la indústria de les dietes en va treure gran profit durant uns anys fins que es va regularitzar.[9]
Descripció morfològica i anatòmica
[modifica]En el cicle biològic de l'espècie podem distingir tres estadis morfològics: la forma adulta, l'ou i l'estadi larvari, conegut també com a metacestode o cisticerc.[10]
Forma adulta
[modifica]
La forma adulta es desenvolupa a l'interior de l'hoste definitiu i consisteix en un cuc pla i allargat en forma de cinta, que sol mesurar entre 2 i 7 metres.[11] És de color blanc i opac tot i que en algunes ocasions presenta una coloració més aviat groguenca.[12] El seu cos es pot dividir en tres parts clarament diferenciades: l'escòlex o cap, el coll i l'estròbil. L'escòlex representa la part anterior del cos i conté les estructures necessàries per a la fixació i el manteniment de T. solium al tracte intestinal.[13] Té forma de pom de porta, mesura entre 0.6 i 1 mm d’ample i presenta simetria biradial. A la part apical apareix una estructura en forma de con anomenada rostel, que conté entre 22 i 32 ganxos quitinosos disposats en dues fileres. A la part més ampla s’hi situen 4 ventoses succionadores, uns òrgans de naturalesa muscular.[14] L'estructura de l'escòlex és un tret distintiu entre els membres de Taenia ja que per exemple T. saginata no disposa ni de rostel ni ganxos mentre que T. asiatica sí que té rostel però sense els ganxos.[3][12] La regió central i no segmentada (5-10 mm de llargada) rep el nom de coll.[12] En alguns textos es coneix també com a àrea de proliferació[13] ja que és a partir d’on apareixen les proglotis que configuren l'estròbil.
L'estròbil és la regió més posterior i es troba dividia en mil proglotis o segments disposats en cadena.[12] Les proglotis es poden diferenciar en el seu grau de maduresa segons quina sigui la seva posició en l'estròbil, sent les immadures les més properes al coll i les gràvides les més distals.[10][15] Les diferents proglotis es troben enllaçades les unes amb les altres a través dels músculs longitudinals i els cordons nerviosos.[13]
- Proglotis immadures: són les 200 primeres proglotis de l'estròbil i no contenen cap tipus d’estructura reproductora. Solen ser més petites i de morfologia rectangular.[10]
- Proglotis madures: corresponen a les 450 proglotis centrals i contenen tant els elements de l'aparell reproductor masculí com femení.[16] Com que l’aparell masculí es desenvolupa primer i després apareix el femení, podem dir que T. solium es tracta d’un hermafrodita protàndric.[14] És en aquestes subunitats on es dona la reproducció sexual de la tènia, ja sigui dins de la mateixa proglotis per autofecundació o entre les colindants.[13]
- Proglotis gràvides: representen les 350 proglotis restants.[12] Aquí tots els òrgans reproductors s’han degenerat i només s’hi observa un úter altament ramificat que conté entre 50.000 i 80.000 ous fertilitzats.[12] El nombre de branques laterals s’utilitza com a tret distintiu en el diagnòstic clínic ja que és diferent entre els tres agents causals de la teniosi. T. solium en presenta entre 7-13 per cada banda mentre que T. saginata i T. asiatica en presenten 15 o més.[3] Les proglotis gràvides es van expulsant de forma passiva a la femta en un procés denominat apòlisi. L'apòlisi, a banda de permetre la dispersió del patogen també té com a funció la regulació de la mida del cos, evitant que sigui massa llarg.[13]
No necessiten d’un aparell digestiu ja que absorbeixen directament els nutrients solubles (glucosa, glicerol i aminoàcids) procedents de la digestió de l'aliment consumit per l'hoste. Tampoc tenen aparell respiratori. Tant l’absorció de nutrients com l'intercanvi de gasos es realitzen a través del tegument, és a dir, una capa permeable situada a la part més externa del cos de la tènia. El tegument no és llis, sinó que presenta unes microvellositats per tal d’augmentar la superfície d’absorció.[13][14]
Ou
[modifica]Els ous són producte de la fecundació de la tènia i s'emmagatzemen a les proglotis gràvides en espera de ser expulsats per la femta, ja sigui dins la seva proglotis corresponent o de forma individual si aquesta es trenca en el moment de la defecació. Constitueixen l'estadi dispersiu del paràsit ja que és l'única forma alliberada a l'ambient, servint de pont entre l'hoste definitiu i l'intermediari.[15]

Pel que fa a la seva morfologia, aquesta és compartida entre tots els membres del gènere Taenia.[17] Es tracta d'una esfera d'entre 30 i 40 µm de diàmetre que al seu interior alberga un embrió hexacant (amb tres parells de ganxos) denominat oncosfera. L'oncosfera està protegida per una membrana amb estriació radial o embriòfor.[15][3][18] El conjunt de l'embriòfor i l'oncosfera es troba rodejat per una càpsula o closca molt làbil, que se sol desprendre en contacte amb l'exterior i conseqüentment només és observable en els ous que es troben dins les proglotis.[18][19][10]
La supervivència de l'oncosfera recau, per tant, en l'embriòfor. Aquesta és una estructura altament resistent als desinfectants i a condicions moderades de sequedat.[18] En sòls humits els ous conserven la infectivitat durant aproximadament 6 mesos.[20] En regions on les temperatures són més elevades aquest periode de temps es pot allargar fins als 9 mesos, mentre que en regions més fredes es redueix a 5.[15]
Recentment s'ha descobert al Perú que espècies d'escarabats piloters, entre les quals destaca Ammophores rubripes, poden cultivar i transportar els ous de T. solium, la qual cosa els col·locaria com a vectors de dispersió del cestode.[21]
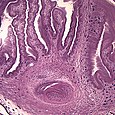
Cisticerc
[modifica]El cisticerc, que també pot rebre el nom de metacestode, correspon a l'estadi larvari del cuc i es desenvolupa a partir de l’oncosfera. Es localitza principalment en forma de quist al teixit muscular estriat de l'hoste intermediari malgrat que també pot envair altres teixits com el nerviós o hepàtic, sent responsable de la cisticercosi humana i porcina.[13]
Consisteix en una vesícula ovalada i translúcida d’aproximadament 10 x 5 mm. A la part més externa s’observa la cutícula, que procedeix de l’acumulació de material protoplasmàtic de l’hoste. La cutícula ve seguida d’una membrana blanca i fina derivada del mesènquima del paràsit. La cutícula i la membrana mesenquimàtica constitueixen la paret del quist, a l’interior del qual es troba un fluid incolor format bàsicament per plasma sanguini de l'hoste. A la part anterior es dona una invaginació en forma de pom de porta que conté un escòlex de color blanc totalment desenvolupat.[3][13][22]
Cicle vital
[modifica]
T. solium presenta un cicle indirecte o heteroxè, en el qual alterna entre l'ésser humà (hoste definitiu) i el porc (hoste intermediari).[23] Primerament l'home esdevé infectat a través de la ingesta de carn crua o poc cuinada contaminada amb cisticercs.[3][10][24] La paret del quist es degrada en el seu pas per l'estómac de manera que l'escòlex pot evaginar-se i fixar-se a la mucosa de l'intestí prim,[10] típicament del jejú,[3] a través de les ventoses i els ganxos.[25] A partir d’aquí la tènia comença a formar les proglotis fins a obtenir un individu adult al cap de 3 mesos.[10] Les proglotis gràvides són arrossegades passivament a les femtes en grups de 3 o 5 i els ous són alliberats a l'exterior cada 2 o 3 dies.[16] La tènia adulta pot romandre a l'intestí durant anys sempre i quan no perdi l'escòlex.[16] En regions on les mesures d’higiene i seguretat són deficients, tant la vegetació com l'aigua poden acabar contaminades per ous de T. solium[26]. Això facilita la infecció del segon hoste, que en la gran majoria de casos és el porc tot i que de manera accidental també ho pot ser l'ésser humà (transmissió feco-oral).[27] L'entorn àcid de l'estómac, conjuntament amb la bilis i altres enzims intestinals, desfà l'embriòfor i allibera l’oncosfera al tracte digestiu.[3] L'oncosfera disposa d’una sèrie de peptidases (aminopeptidases i peptidases de serina i/o cisteïna) que li permeten travessar la mucosa intestinal i així assolir el torrent sanguini.[3] A més s’ha vist que podrien actuar com a mecanisme de defensa ja que in vivo indueixen l'apoptosi dels limfòcits T CD4 procedents de l'hoste.[28][29] Un cop a la sang el paràsit pot disseminar-se a qualsevol òrgan, tot i que té preferència pel múscul i el cervell.[30][3] En algunes instàncies s’estableix a l'ull, el fetge o el pulmó.[12] Serà en aquests òrgans on l’oncosfera es transformi en cisticerc, un procés que pot trigar aproximadament 10 setmanes.[24] El cicle es tanca una vegada l'home torna a ingerir aquesta carn contaminada.[25]
Malalties
[modifica]Teniosi
[modifica]La teniosi és la infecció que es produeix quan la larva de T. solium colonitza el seu hoste. Són parasitacions solitàries, és a dir, només hi ha un únic individu parasitant l'hoste. Majoritàriament, els casos de teniosi humana per T. solium es donen en consumir carn de porc crua o poc cuinada. Encara que la prevenció es el millor mètode per evitar la infecció, moltes vegades es produeix i l'hoste no és conscient de la mateixa degut a la manca de símptomes. Aquesta falta de simptomatologia és especialment freqüent en casos de teniosi per T. solium, doncs aquesta presenta una longitud de aproximadament 3m, davant dels fins 10m que pot presentar la tènia bovina, Taenia saginata.[31]Les complicacions mèdiques només venen quan la infecció per T. solium evoluciona a una cisticercosi, en aquest estadi comença a presentar símptomes més greus. De manera general solen passar anys fins a l'aparició de símptomes i en aquest moment la tènia adulta ja ha mort i no és present en el pacient.[32]

Cisticercosi
[modifica]La cisticercosi és causada per la ingestió dels ous de T. solium procedents de femta humana.[33] Aquesta ingestió pot estar deguda a menjar aliments i aigua contaminats o per haver portat els dits contaminats a la boca després d'haver defecat (autoinfecció). El fet que l'humà ingereixi els ous fa que es converteixi en hoste intermediari i no l'hoste definitiu, per tant, es desenvolupa dins del budell l'estat larvari.[26] Des de la mucosa intestinal les larves es disseminen per altres zones del cos quan passen a la sang i s'adhereixen als teixits formant cisticercs.[34] Quan els cisticercs es troben en el cervell parlem de neurocisticercosi.[26]
Símptomes
[modifica]Teniosi
[modifica]La infecció en la majoria de casos és asimptomàtica i, en cas de presentar-ne, no comporta símptomes greus. Els símptomes depenen molt d’on s’hagi fixat la tènia i en alguns casos poden ser molt greus, sobretot si es desenvolupa la malaltia i es produeix la cisticercosi al cervell, ja que quan està localitzada en altres zones del cos no acostuma a donar simptomatologia. Solen presenten irritabilitat a la zona de l'intestí on es troba la tènia, dolor abdominal, diarrees, nàusees, absorció inadequada dels nutrients i indigestió crònica. És molt habitual la pèrdua de fam i la pèrdua de pes.[35]
Cisticercosi i neurocisticercosi
[modifica]En casos greus on es desenvolupa cisticercosi, els símptomes també depenen del teixit on s’hagin encistat els cisticercs. Es produeixen danys al teixit parenquimàtic del teixit muscular, als ulls i, fins i tot, al cervell provocant neurocisticercosi. A la neurocisticercosi es produeixen signes i símptomes neurològics que poden tenir un efecte devastador pel cervell. El quadre clínic més comú de la neurocisticerosi són els convulsions epilèptiques. De fet, un estudi assegura que en els països endèmics de T.solium un 30% de les persones que pateixen de neurocisticercosi tenen epilèpsia.[36] Els episodis epilèptics varien segons l'estadi en el que es troba T. solium. Les persones amb més recurrència a les convulsions tenen els cisticercs calcificats, és a dir, l'epilèpsia és un símptoma que està relacionat amb la degeneració dels cists. També es produeixen altres símptomes com la cefalea intensa, hipertensió intracranial i deteriorament de les funcions cognitives, en algun cas aïllat es podria arribar a produir demència.[36][37]
La neurocisticercosi també pot presentar edema cerebral al voltant dels cists o al voltant de les lesions calcificades de cists degenerats. Es creu que aquesta acumulació anormal de líquid a les cèl·lules està associada amb pacients que presenten episodis de convulsions. L'edema és una resposta inflamatòria del sistema immunitari i en la majoria de casos es pot tractar amb esteroides. Tot i així s'han vist casos amb una elevada resposta inflamatòria on l'edema no es redueix i els pacients pateixen una encefalitis cisticercòcica.[36][32]
Els cists provoquen la reacció del sistema immunitari que com hem dit pot causar l'edema cerebral, com a conseqüència d'aquest edema el pacient pot desenvolupar una pressió intracranial elevada. A més la posició dels cists pot comportar altres problemes. Quan aquests es troben a prop de l'aqüeducte de Silvi, que és un sistema d'irrigació de líquid cefalorraquidi, poden arribar a obstruir-lo amb el seu creixement.[32][36]
A causa d'aquestes complicacions que es donen al cervell s'ha vist que al voltant d'un 87% dels pacients que pateixen neurocisticercosi poden desenvolupar un dèficit cognitiu com a conseqüència.[32][36]El deteriorament cognitiu es dona de manera més intensa en pacients que tenen una neurocisticercosi activa que no pas en els que només presentes lesions calcificades. Encara no es coneixen en profunditat les causes d'aquest fenomen però hi ha models experimentals que apunten cap a l'afectació de la memòria a curt termini com a conseqüència de l'alteració de l'hipocamp donada per citocines com INF-γ i TNF-α. També pot ser una causa de l'alteració de l'hipocamp l'epilèpsia, que té elevada ocurrència en pacients amb neurocisticercosi en zones endèmiques.[32]
Variant porcina
[modifica]Tot i que els símptomes en porcs estan menys estudiats, alguns dels signes clínics característics són l'aparició de vesícules al revers de la llengua, la hiperestèsia del morro i la pèrdua de capacitats motores o nervioses, segons el lloc on s'hagi inserit el cisticerc.[38][39]
Diagnòstic
[modifica]
Teniosi
[modifica]De forma clàssica el diagnòstic de la teniosi s’ha basat en l’anàlisi microscòpica de les femtes, les quals poden contenir proglotis senceres o ous individuals.[7][40] Les femtes normalment es recullen en un pot amb aigua salina i posteriorment es fixen amb èter de formalina o acetat de formalina. Després es deshidraten amb glicerol i finalment s’observen sota el microscopi òptic.[40] La presència d’ous confirma la teniosi tot i que no permet fer una distinció a nivell d’espècie.[3] En aquest cas és necessari que a la mostra hi hagi proglotis. Si aquest és el cas, prèviament a l’observació es fa una tinció amb tinta xinesa per tal de comptar el nombre de branques laterals uterines.[16] T. solium en presenta entre 7 i 13 a cada banda, mentre que T. saginata o T. asiatica més de 15.[3]
Una forma alternativa de recollir els ous és mitjançant el test de Graham, el qual s’aplica a diversos paràsits intestinals. Aquest mètode consisteix en utilitzar una cinta adhesiva de paper de cel·lulosa i posar-la en contacte amb la zona perianal del pacient. Llavors s’estén per un portaobjectes i es procedeix a fer l’observació.[41]
El diagnòstic microscòpic és el mètode més econòmic de tots però no resulta gaire efectiu. Per una banda, perquè els ous són indistingibles entre espècies i s’alliberen de forma intermitent. Per l’altra, perquè no sempre és possible recuperar les proglotis senceres. A més, es requereix de personal especialitzat capaç de distingir entre les diferents estructures.[42]
Una alternativa és l’aplicació de tècniques moleculars com la reacció en cadena de la polimerasa o PCR (de l’anglès Polymerase Chain Reaction), que permeten la detecció de material genètic del paràsit i la seva distinció a nivell d’espècie.[3][43] En el cas concret de T. solium es basa en l'amplificació del gen que codifica la proteïna Tso31.[16] La sensibilitat i especificitat són superiors a les de la microscòpia però segueixen depenent de la presència d’ous o proglotis a les femtes.[43]
També existeix la possibilitat de detectar coproantígens (Co-Ag) específics mitjançant tècniques d'enzimimmunoassaig o l'ELISA.[16][43][40] Els coproantígens són antígens que es troben en les femtes i presenten l’avantatge que es poden detectar en els estadis primerencs de la infecció; no cal esperar a l’alliberament de les proglotis amb els ous. Per aquesta raó, la detecció de coproantígens representa una bona eina de control epidemiològic en la detecció precoç de teniosi.[43] Alternativament, els portadors es poden discriminar mitjançant la detecció d'anticossos específics de T. solium, ja sigui per ELISA o Immunoblot.[42]
Tot i l'elevada sensibilitat descrita en la detecció d’antigens (95% amb un 1% de falsos positius),[16][43] resulta ser una tècnica relativament cara ja que necessita d’una maquinària (lector d’ELISA) i reactius específics, a més de personal expert en la seva manipulació.[40]
Cisticercosi i neurocisticercosi
[modifica]El diagnòstic de la cisticercosi consta de mètodes de ressonància magnètica en els quals s'observen cisticercs en el parènquima del teixit muscular o cerebral en cas de patir neurocisticercosi. De manera secundària es pot emprar la tomografia axial computaritzada (TAC) ja que, a diferència de la ressonància magnètica, permet observar la lesió parenquimatosa calcificada però no els cisticercs. La TAC se sol utilitzar en centres amb menys recursos perquè la ressonància magnètica requereix d'una major despesa econòmica. Tècniques com L'ELISA o la PCR també serien vàlides per a realitzar el diagnòstic però són menys utilitzades en l'àmbit clínic.[42][44]
El diagnòstic de la cisticercosi també és pot fer mitjançant tècniques immunològiques, detectant els anticossos. La tècnica utilitzada en aquest cas seria un assaig d'immunoelectrotransferència (EITB: enzyme-linked immunoelectrotransfer blot assay). Els antígens que utilitza són glicoproteïnes purificades dels cisticercs i s'ha vist que pot detectar anticossos específics en un 98% dels pacients sense que es doni el fenomen de la reacció creuada. S'ha de tenir en compte que aquest mètode de diagnòstic ha d'estar acompanyat de certa simptomatologia o si més no altres indicis de la malaltia, ja que en zones endèmiques del paràsit poden haver individus seropositius per que hagin passat una infecció o hagin estat exposats al paràsit encara que aquest no hagi infectat la persona.[42]
També cal destacar que tot i no estar sempre relacionat en els països endèmics pot ser útil fer un seguiment de l'epilèpsia. En aquestes regons al voltant d'un 30-40% dels casos d'epilèpsia són causats per la neurocisticercosi i moltes vegades es tracta la malaltia sense anar més enllà. Per tant, patir epilèpsia pot ser un bon indici per a aprofundir més i detectar si l'individu pateix una cisticercosi. En els casos d'epilèpsia relacionats amb la infecció per T.solium el tractament antiparasític pot ajudar a millorar les condicions del pacient.[42]
Variant porcina
[modifica]A diferència del que hem vist per a la cisticercosi humana, el diagnòstic de la variant porcina es realitza principalment post-mortem un cop la carn, que correspon al teixit muscular de l’animal, arriba als escorxadors.[45] Es pot fer a través de la inspecció macroscòpica de les carcasses, prèviament tallades en làmines de 3 a 5 mm,[46] o al laboratori a partir d’una PCR del gen cox1[45] o d’un ELISA per a la detecció de l'antigen HP10.[47][48] En àrees endèmiques, però, el diagnòstic se sol fer inspeccionant la llengua. Es tracta d’un mètode barat que si es fa correctament té una especificitat del 100% però la seva sensibilitat és molt baixa (16%).[47][42]
Tractament
[modifica]Teniosi
[modifica]La gran majoria de casos de teniosi es tracten a base d’una sola dosi de niclosamida (50 mg/kg en adults),[49] el qual té un percentatge d’eficàcia que ronda el 90%.[3] Es tracta d’un antihelmíntic que actua únicament contra la tènia adulta, destruint l'escòlex i les proglotis que s’aniran alliberant a les femtes en un període variable de 5 setmanes.[35] En molts casos se sol subministrar conjuntament amb un laxant salí per tal d’afavorir l’alliberació del cestode i minimitzar el risc que els ous eclosionin a l’interior del pacient i es doni una cisticercosi.[49] De forma alternativa es pot administrar praziquantel (10mg/kg en adults) en una sola dosi.[35] A diferència del presentat anteriorment, aquest fàrmac sí que s’absorbeix a l'intestí prim.[42] La seva disseminació a altres sistemes, sobretot al nerviós central, pot comportar l’activació de quists cerebrals en persones que hagin adquirit de forma simultània una cisticercosi asimptomàtica. En aquests casos els pacients solen patir seqüeles neurològiques que van des d’un simple mal de cap a atacs epilèptics en els casos més greus.[42]
Cisticercosi i neurocisticercosi
[modifica]En el cas de la cisticercosi humana es poden eliminar els quists per intervenció quirúrgica a l’àrea afectada o a través d'antihelmíntics com el praziquantel o l’albendazol[35] (en adults: dosi diària de 800 mg administrada en un període variable d’entre 7 i 30 dies segons la resposta).[50] En casos de neurocisticercosi es recomana que, a banda dels antiparasitaris, s’utilitzin també corticoides per reduir la inflamació. Si el pacient presenta períodes epilèptics llavors se li donarà també una teràpia basada en antiepilèptics.[51]
Variant porcina
[modifica]L'ús del praziquantel o albendazol no està gaire estès en el tractament de la cisticercosi porcina ja que es necessiten subministrar múltiples dosis i en la majoria de casos no s’aconsegueixen eliminar tots els quists. Alternativament es fa servir l'oxfendazol, que amb una única dosi de 30 mg/kg és capaç d’eliminar tots els quists musculars al cap de 3 mesos.[42]
Causes, factors de risc, prevenció i control
[modifica]Causes i factors de risc
[modifica]
La infecció per T. solium ve causada, principalment, per la ingestió dels seus ous o la dels quists presents en la carn del porc. Els ous poden trobar-se tant en aigua com en aliments que hagin entrat en contacte amb les femtes humanes. En les zones endèmiques (regions de l'Àfrica, Àsia i Amèrica del Sud) les condicions deficients d’higiene, de manipulació de femtes i cria de porcs suposen un gran factor de risc a l’hora de contraure les malalties associades. A més, solen tractar-se de zones pobres o amb pocs recursos, la qual cosa dificulta l'administració de medicaments per eliminar els cucs, promovent així la seva transmissió.[52]
Prevenció i control
[modifica]L'educació és un element clau a l’hora de prevenir la teniosi i la cisticercosi. Es parla tant de mesures sanitàries i higièniques com de les relacionades amb la cocció i la preparació de la carn. Les primeres inclouen un bon sistema de purificació de les aigües residuals i el rentat de mans després d’anar al lavabo i abans de manipular els aliments.[53] Pel que fa a la carn de porc, s’ha vist que congelar-la a temperatures de -20 °C durant un mínim de 72 hores abans del seu consum aconsegueix matar tots els cisticercs. En cas que en quedi algun, s'acaba d'eliminar en coure la carn a 70 °C.[15][3][35]
Un control exhaustiu del bestiar dins de les granges i dins dels escorxadors un cop sacrificat també és de vital importància.[12][54] Mantenir els animals en les condicions sanitàries òptimes, igual que el disposar d’un tractament en cas d’infecció, suposa una inversió econòmica elevada. Els països en vies de desenvolupament, d’on T. solium és endèmica, normalment no poden assumir aquests costs. Això fa que deixin els porcs lliures en contacte amb femtes humanes o que s’organitzin llocs de venta il·legal per tal d’esquivar les mesures de control i no haver de fer front a les pèrdues associades a la retirada de carn contaminada.[42][15]
Un altre enfocament per aturar la transmissió del paràsit seria el tractament d’humans infectats per tal de reduir el nombre d’ous que es propaguen al medi. En àrees on la seroprevalença és elevada es recomanen estratègies que involucrin l'administració massiva de fàrmacs o MDA, de l’anglès massive drug administration. En regions on el patògen és menys freqüent s’hauria de fer un cribratge massiu per tal de detectar els portadors de teniosi i així evitar un malbaratament dels medicaments.[54] Aquesta estratègia es pot complementar amb el subministrament, massiu o no segons les dades epidemiològiques de la regió, d'oxfendazol a porcs.[42]
El conjunt d’aquestes mesures resulta ser efectiu i ha permès a nivell europeu i nord americà mantenir controlades les poblacions de T. solium.[55] Estudis realitzats en àrees reduïdes del Perú i l'Equador ho corroboren, de manera que la potencial erradicació del platihelmint només es veu limitada per la manca d'accés a recursos.[42]
Vacuna
[modifica]Ja fa anys que s'estudia llançar al mercat una possible vacuna per a controlar la cisticercosi en els porcs.[3] De tots els dissenys proposats, el de la vacuna TSOL18 és el que presenta una major efectivitat tant in vitro com en estudis de camp. Consisteix en un pèptid sintètic derivat de Taenia crassiceps i s’administraria en 3 dosis.[15] El principal problema que presenta aquesta mesura és el mencionat anteriorment: en cas de comercialitzar-se, les zones més afectades tindrien dificultats a l’hora d’adquirir-la.[42][56]
Epidemiologia
[modifica]La teniosi i la cisticercosi son considerades per la CDC malalties tropicals desateses. Es distribueixen principalment en regions de països pertanyents a Àfrica, Àsia i Amèrica del Sud que tenen un sanejament deficient i els porcs son criats en llibertat i amb accés a les femtes humanes.[57] En aquests països és una de les causes principals d'epilèpsia i la infecció parasítica més important que afecta el sistema nerviós central. En les últimes dècades però, la teniosi i cistercosi s'han estès a nivell mundial degut a l'augment dels viatgers i de les immigracions.[6]
L'estudi de l'epidemiologia de la malaltia pot ser complicat en algunes regions endèmiques d'Àfrica que des de fa anys es troben en una situació d'inestabilitat política. Tot i així es poden veure indicis que ens poden ajudar a especular la presència i persistència del paràsit en aquestes zones. Per exemple a Nigèria s'ha vist que al voltant d'un 20% dels porcs estan afectats per la cisticercosi, tenint en compte aquesta dada i observant la incidència alta d'epilèpsia al país, porta a pensar que la cisticercosi en humans es produeix encara que no hi hagi estudis que ho corroborin.[58] Quant a les regions endèmiques de l'Àsia hi ha una gran variabilitat depenent del país. En països com el Japó, que es troben en creixement econòmic, i països on la majoria d'habitants són musulmans, la infecció és molt rara degut respectivament a la millora de les infraestructures i al no consum del porc per motius religiosos. Mentre que en altres regions la teniosi i cisticercosi són molt més comuns. Un exemple seria l'Índia, la infecció està present en tot el país amb casos de neurocisticercosi i també de cisticercosi ocular.[59]
T. solium afecta a milions de persones cada any i és causant d’un impacte econòmic molt important. L'any 2014, T. solium va ser descrit per experts internacionals com el paràsit alimentari més preocupant a nivell mundial. L'any 2016, en un estudi similar realitzat a Europa es va classificar com el desè paràsit més preocupant, ja que el nombre de casos de cisticercosi humana no és tan elevat a Europa.[60]Tot i així cada any els casos augmenten i des dels anys 70 dècada a dècada s'observa un augment constant de casos de neurocicticercosi, sent la principal causa els viatgers procedents de zones endèmiques i les migracions. No obstant això també s'han descrit alguns casos de transmissió autòctona, és a dir, que s'ha transmès a persones que no han viatjat a cap zona endèmica. De tots els països d'Europa la transmissió autòctona es dona amb més freqüència a Espanya i Portugal degut a la major immigració de persones de països endèmics.[6]
Perspectiva de futur
[modifica]Quan la cisticercosi humana afecta al sistema nerviós central, la condició neurològica que causa és anomenada neurocisticercosi, que provoca una sèrie de manifestacions que potencialment poden provocar la mort. La neurocisticercosi és una de les principals preocupacions de salut pública mundial provocant unes 28.000 morts anuals.[60]La teniosi i cisticercosi formen part del grup de la OMS de control de malalties tropicals desateses, l'any 2012 aquest grup va començar a intentar implementar un mètode validat per a poder fer un control de T.solium però actualment encara no existeix. Tot i així, la OMS té marcats uns objectius en quant al paràsit per l'any 2030. Aquestes perspectives de futur i objectius es podrien assolir, però abans es necessita que els models de dinàmica de transmissió existents tinguin una major capacitat predictiva. Aquesta feina s'està duent a terme per un grup d'epidemiologia, CystiTeam, del qual un dels objectius és millorar els models cystiSim i EPICYST.[61][62][63]
Referències
[modifica]- ↑ García, Héctor H.; González, Armando E.; O’Neal, Seth E.; Gilman, Robert H. «Apuntes y recomendaciones para el establecimiento de programas de control de la teniasis / cisticercosis por Taenia solium en el Perú». Revista Peruana de Medicina Experimental y Salud Pública, 35, 1, 05-04-2018, pàg. 132. DOI: 10.17843/rpmesp.2018.351.3606. ISSN: 1726-4642.
- ↑ «CDC - Taeniasis - Enfermedad» (en castellà), 24-04-2019. [Consulta: 19 novembre 2021].
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 3,15 Wittner, Murray; White, A. Clinton; Tanowitz, Herbert B. Taenia and Other Tapeworm Infections. Elsevier, 2011, p. 839–847.
- ↑ Hoberg, Eric P. «Phylogeny of Taenia: Species definitions and origins of human parasites» (en anglès). Parasitology International, 55, 01-01-2006, pàg. S23–S30. DOI: 10.1016/j.parint.2005.11.049. ISSN: 1383-5769.
- ↑ 5,0 5,1 5,2 5,3 5,4 Del Brutto, Oscar H.; García, Héctor H. «Taenia solium Cysticercosis — The lessons of history» (en anglès). Journal of the Neurological Sciences, 359, 1-2, 12-2015, pàg. 392–395. DOI: 10.1016/j.jns.2015.08.011.
- ↑ 6,0 6,1 6,2 Fabiani, S.; Bruschi, F. «Neurocysticercosis in Europe: Still a public health concern not only for imported cases» (en anglès). Acta Tropica, 128, 1, 01-10-2013, pàg. 18–26. DOI: 10.1016/j.actatropica.2013.06.020. ISSN: 0001-706X.
- ↑ 7,0 7,1 Ito, Akira; Saito, Mika; Donadeu, Meritxell; Lightowlers, Marshall W «Kozen Yoshino's experimental infections with Taenia solium tapeworms: An experiment never to be repeated» (en anglès). Acta Tropica, 205, 5-2020, pàg. 105378. DOI: 10.1016/j.actatropica.2020.105378.
- ↑ «Dieta de los gusanos: El peligroso método para bajar de peso que se populariza en el mundo» (en castellà), 29-08-2014. [Consulta: 18 novembre 2021].
- ↑ «Las dietas más extrañas de la historia» (en castellà), 03-01-2013. [Consulta: 19 novembre 2021].
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 lit., Singh, Gagandeep, ed. lit. Prabhakar, Sudesh, ed.. Taenia solium cysticercosis : from basic to clinical science. CABI, cop. 2002. ISBN 0-85199-628-0.
- ↑ «Taenia solium: un parásito cosmopolita» (en castellà). Ana Flisser, Laura Vargas-Parada y Juan Pedro Laclette, 01-05-2006. [Consulta: 10 octubre 2021].
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 12,7 Laranjo González, Minerva. Taenia Solium Cysticercosis: From Basic to Clinical Science (tesi) (en anglès). Bellaterra: UAB, 2018, p. 181.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 13,6 13,7 L., Kotpal, R.. Modern text book of zoology : Invertebrates : animal diversity- I.. Rastogi Publications, 2014-15. ISBN 978-93-5078-040-4.
- ↑ 14,0 14,1 14,2 R., Mille Pagaza, Silvia. Invertebrados.. Instituto Politécnico Nacional, 2010. ISBN 978-1-4492-2719-7.
- ↑ 15,0 15,1 15,2 15,3 15,4 15,5 15,6 Dixon, Matthew A.; Winskill, Peter; Harrison, Wendy E.; Basáñez, Maria-Gloria. Chapter Four - Taenia solium taeniasis/cysticercosis: From parasite biology and immunology to diagnosis and control (en anglès). 112. Academic Press, 2021, p. 133–217. DOI 10.1016/bs.apar.2021.03.003.
- ↑ 16,0 16,1 16,2 16,3 16,4 16,5 16,6 Alroy, Karen A.; Gilman, Robert H. Tapeworm Infections (en anglès). Elsevier, 2020, p. 932–940. DOI 10.1016/b978-0-323-55512-8.00130-7. ISBN 978-0-323-55512-8.
- ↑ Koul, Parvaiz A «Species identification after treatment for taeniasis». The Lancet, 363, 9425, 6-2004, pàg. 1999. DOI: 10.1016/s0140-6736(04)16420-9. ISSN: 0140-6736.
- ↑ 18,0 18,1 18,2 Kebede, Nigatu. C. bovis: development and evaluation of serological tests and prevalence at Addis Ababa abattoir (tesi) (en anglès). Etiòpia: Addis Ababa University, Gener 2004, p. 74.
- ↑ Smyth, J.D.; Clegg, J.A. «Egg-shell formation in trematodes and cestodes» (en anglès). Experimental Parasitology, 8, 3, 6-1959, pàg. 286–323. DOI: 10.1016/0014-4894(59)90027-X.
- ↑ Ilsøe, Bente; Kyvsgaard, Niels Chr.; Nansen, Peter; Henriksen, Svend Aa. «A Study on the Survival of Taenia saginata Eggs on Soil in Denmark». Acta Veterinaria Scandinavica, 31, 2, 09-08-1989, pàg. 153–158. DOI: 10.1186/bf03547556. ISSN: 1751-0147.
- ↑ Gomez-Puerta, Luis Antonio; Lopez-Urbina, Maria Teresa; Garcia, Hector Hugo; Gonzalez, Armando Emiliano «Longevity and viability of Taenia solium eggs in the digestive system of the beetle Ammophorus rubripes». Revista Brasileira de Parasitologia Veterinária, 23, 1, 3-2014, pàg. 94–97. DOI: 10.1590/s1984-29612014014. ISSN: 1984-2961.
- ↑ «Terrestrial Manual Online Access» (en anglès britànic). [Consulta: 18 novembre 2021].
- ↑ Kniel, K. Progress in intervention programs to eradicate foodborne helminth infections (en anglès). Elsevier, 2013, p. 385–397. DOI 10.1533/9780857098740.4.385. ISBN 978-0-85709-438-4.
- ↑ 24,0 24,1 Mehlhorn, Heinz. Taenia solium (en anglès). Berlin, Heidelberg: Springer Berlin Heidelberg, 2016, p. 2614–2621. DOI 10.1007/978-3-662-43978-4_3093. ISBN 978-3-662-43977-7.
- ↑ 25,0 25,1 Orta Mira, Nieves DIAGNÓSTICO DE LAS TENIASIS INTESTINALES, 2020, pàg. 9.
- ↑ 26,0 26,1 26,2 «Preguntas frecuentes sobre la cisticercosis» (en castellà), 15-04-2019. [Consulta: 15 novembre 2021].
- ↑ «Figure: Ciclo vital de Taenia solium» (en castellà). [Consulta: 15 novembre 2021].
- ↑ Molinari, Jose L.; Mejia, Herlinda; White, A. Clinton; Garrido, Esperanza; Borgonio, Veronica M. «Taenia solium: A Cysteine Protease Secreted by Metacestodes Depletes Human CD4 Lymphocytes in Vitro» (en anglès). Experimental Parasitology, 94, 3, 01-03-2000, pàg. 133–142. DOI: 10.1006/expr.2000.4490. ISSN: 0014-4894.
- ↑ Tato, P.; Fernández, A. M.; Solano, S.; Borgonio, V.; Garrido, E. «A cysteine protease from Taenia solium metacestodes induce apoptosis in human CD4+ T-cells» (en anglès). Parasitology Research, 92, 3, 01-02-2004, pàg. 197–204. DOI: 10.1007/s00436-003-1008-1. ISSN: 1432-1955.
- ↑ León, Nancy; Padilla, Carlos; Pajuelo, Mónica; Sheen, Patricia; Zimic, Mirko «Cisteínoproteasas Catepsinas L de Taenia solium: Rol biológico en la infección y potencial uso para el inmunodiagnóstico de la neurocisticercosis». Revista Peruana de Medicina Experimental y Salud Publica, 30, 3, 7-2013, pàg. 446–454. ISSN: 1726-4634.
- ↑ «CDC - Taeniasis - Preguntas frecuentes sobre la teniasis» (en castellà), 24-04-2019. [Consulta: 5 novembre 2021].
- ↑ 32,0 32,1 32,2 32,3 32,4 Gonzales, I.; Rivera, J. T.; Garcia, H. H. «Pathogenesis of Taenia solium taeniasis and cysticercosis» (en anglès). Parasite Immunology, 38, 3, 2016, pàg. 136–146. DOI: 10.1111/pim.12307. ISSN: 1365-3024.
- ↑ «Cisticercosis: MedlinePlus enciclopedia médica» (en castellà). [Consulta: 15 novembre 2021].
- ↑ Spelman, Denis W.; Aung, Ar Kar «Taenia solium Taeniasis and Cysticercosis in Southeast Asia» (en anglès). The American Journal of Tropical Medicine and Hygiene, 94, 5, 04-05-2016, pàg. 947–954. DOI: 10.4269/ajtmh.15-0684. ISSN: 0002-9637. PMC: PMC4856625. PMID: 26834197.
- ↑ 35,0 35,1 35,2 35,3 35,4 Murray, Patrick R. Microbiologia médica. 9ª̇ ed. Barcelona: Elsevier, 2021. ISBN 978-84-9113-808-2.
- ↑ 36,0 36,1 36,2 36,3 36,4 Garcia, Hector H; Nash, Theodore E; Del Brutto, Oscar H «Clinical symptoms, diagnosis, and treatment of neurocysticercosis» (en anglès). The Lancet Neurology, 13, 12, 01-12-2014, pàg. 1202–1215. DOI: 10.1016/S1474-4422(14)70094-8. ISSN: 1474-4422.
- ↑ Acosta Rodríguez, Ana María; Mateus, Carolina; Baquero, María; Gómez, Paola; Lalinde, Juan «Primer caso de EXIT (tratamiento exútero intraparto) en el Hospital Universitario San Ignacio: presentación de caso». Universitas Médica, 61, 3, 07-05-2020. DOI: 10.11144/javeriana.umed61-3.exit. ISSN: 2011-0839.
- ↑ «B252 - PORCINE CYSTICERCOSIS». Arxivat de l'original el 2021-11-19. [Consulta: 19 novembre 2021].
- ↑ Mattes, O. «Gegenwartsprobleme der einheimischen Parasitologie: Helminthologie». Zeitschrift f�r Parasitenkunde, 22, 2, 1962, pàg. 86–88. DOI: 10.1007/bf00329181. ISSN: 0044-3255.
- ↑ 40,0 40,1 40,2 40,3 Gómez-Morales, M. A.; Gárate, T.; Blocher, J.; Devleesschauwer, B.; Smit, G. S. A. «Present status of laboratory diagnosis of human taeniosis/cysticercosis in Europe» (en anglès). European Journal of Clinical Microbiology & Infectious Diseases, 36, 11, 11-2017, pàg. 2029–2040. DOI: 10.1007/s10096-017-3029-1. ISSN: 0934-9723. PMC: PMC5653711. PMID: 28669015.
- ↑ Willingham, Arve Lee; Engels, Dirk. Control of Taenia solium Cysticercosis/Taeniosis (en anglès). 61. Academic Press, 2006, p. 509–566.
- ↑ 42,00 42,01 42,02 42,03 42,04 42,05 42,06 42,07 42,08 42,09 42,10 42,11 42,12 Gilman, Robert H; Gonzalez, Armando E; Llanos-Zavalaga, Fernando; Tsang, Victor C W; Garcia, Hector H «Prevention and control of Taenia solium taeniasis/cysticercosis in Peru» (en anglès). Pathogens and Global Health, 106, 5, 9-2012, pàg. 312–318. DOI: 10.1179/2047773212Y.0000000045. ISSN: 2047-7724. PMC: PMC4005116. PMID: 23265557.
- ↑ 43,0 43,1 43,2 43,3 43,4 Guezala, Maria-Claudia; Garcia, Hector H.; Gonzalez, Armando E.; Tembo, Alice; Allan, James C. «Development of a Species-Specific Coproantigen ELISA for Human Taenia solium Taeniasis». The American Journal of Tropical Medicine and Hygiene, 81, 3, 01-09-2009, pàg. 433–437. DOI: 10.4269/ajtmh.2009.81.433. ISSN: 0002-9637.
- ↑ Rodriguez, Silvia; Wilkins, Patricia; Dorny, Pierre «Immunological and molecular diagnosis of cysticercosis» (en anglès). Pathogens and Global Health, 106, 5, 9-2012, pàg. 286–298. DOI: 10.1179/2047773212Y.0000000048. ISSN: 2047-7724. PMC: PMC4005112. PMID: 23265553.
- ↑ 45,0 45,1 Gauci, Charles G.; Ayebazibwe, Chrisostom; Nsadha, Zachary; Rutebarika, Chris; Poudel, Ishab «Accurate diagnosis of lesions suspected of being caused by Taenia solium in body organs of pigs with naturally acquired porcine cysticercosis». PLOS Neglected Tropical Diseases, 13, 6, 25-06-2019, pàg. e0007408. DOI: 10.1371/journal.pntd.0007408. ISSN: 1935-2735.
- ↑ Lightowlers, Marshall W. «Diagnosis of Porcine Cysticercosis at Necropsy: When Is Enough, Enough?». Trends in Parasitology, 36, 7, 7-2020, pàg. 575–578. DOI: 10.1016/j.pt.2020.04.006. ISSN: 1471-4922.
- ↑ 47,0 47,1 Kabululu, Mwemezi L.; Johansen, Maria V.; Mlangwa, James E. D.; Mkupasi, Ernatus M.; Braae, Uffe C. «Performance of Ag-ELISA in the diagnosis of Taenia solium cysticercosis in naturally infected pigs in Tanzania». Parasites & Vectors, 13, 1, 27-10-2020, pàg. 534. DOI: 10.1186/s13071-020-04416-4. ISSN: 1756-3305. PMC: PMC7590492. PMID: 33109255.
- ↑ Sciutto, E; Hernández, M; Garcı́a, G; de Aluja, A.S; Villalobos, A.N.M «Diagnosis of porcine cysticercosis: a comparative study of serological tests for detection of circulating antibody and viable parasites». Veterinary Parasitology, 78, 3, 8-1998, pàg. 185–194. DOI: 10.1016/s0304-4017(98)00129-0. ISSN: 0304-4017.
- ↑ 49,0 49,1 «Niclosamida | Asociación Española de Pediatría». [Consulta: 19 novembre 2021].
- ↑ «Albendazol | Asociación Española de Pediatría». [Consulta: 19 novembre 2021].
- ↑ «OMS - Taeniasis - cysticercosis» (en castellà). [Consulta: 5 novembre 2021].
- ↑ Openshaw, John J.; Medina, Alexis; Felt, Stephen A.; Li, Tiaoying; Huan, Zhou «Prevalence and risk factors for Taenia solium cysticercosis in school-aged children: A school based study in western Sichuan, People’s Republic of China» (en anglès). PLOS Neglected Tropical Diseases, 12, 5, 08-05-2018, pàg. e0006465. DOI: 10.1371/journal.pntd.0006465. ISSN: 1935-2735. PMC: PMC5959190. PMID: 29738570.
- ↑ Prevention, CDC-Centers for Disease Control and. «CDC - Cysticercosis - Prevention & Control» (en anglès americà), 15-04-2019. [Consulta: 17 novembre 2021].
- ↑ 54,0 54,1 Thomas, Lian F.; Cook, E. Anne J.; Fèvre, Eric M.; Rushton, Jonathan «Control of Taenia solium; A Case for Public and Private Sector Investment». Frontiers in Veterinary Science, 6, 20-06-2019. DOI: 10.3389/fvets.2019.00176. ISSN: 2297-1769.
- ↑ Gonzalez, Armando E.; García, H. H.; Gilman, Robert H.; Tsang, Victor C. W.; Cisticercosis Working Group in Peru «Control of Taenia solium». Acta Tropica, 87, 1, 6-2003, pàg. 103–109. DOI: 10.1016/s0001-706x(03)00025-1. ISSN: 0001-706X. PMID: 12781384.
- ↑ Gonzalez, Armando E.; Garcı́a, H. H.; Gilman, Robert H.; Tsang, Victor C. W. «Control of Taeniasolium» (en anglès). Acta Tropica, 87, 1, 01-06-2003, pàg. 103–109. DOI: 10.1016/S0001-706X(03)00025-1. ISSN: 0001-706X.
- ↑ Prevention, CDC-Centers for Disease Control and. «CDC - Cysticercosis» (en anglès americà), 07-01-2021. [Consulta: 16 novembre 2021].
- ↑ Zoli, André; Shey-Njila, Oliver; Assana, Emmanuel; Nguekam, Jean-Pierre; Dorny, Pierre «Regional status, epidemiology and impact of Taenia solium cysticercosis in Western and Central Africa» (en anglès). Acta Tropica, 87, 1, 6-2003, pàg. 35–42. DOI: 10.1016/S0001-706X(03)00053-6.
- ↑ Rajshekhar, Vedantam; Joshi, Durga Dutt; Doanh, Nguyen Quoc; van De, Nguyen; Xiaonong, Zhou «Taenia solium taeniosis/cysticercosis in Asia: epidemiology, impact and issues» (en anglès). Acta Tropica, 87, 1, 6-2003, pàg. 53–60. DOI: 10.1016/S0001-706X(03)00055-X.
- ↑ 60,0 60,1 Trevisan, Chiara; Sotiraki, Smaragda; Laranjo-González, Minerva; Dermauw, Veronique; Wang, Ziqi «Epidemiology of taeniosis/cysticercosis in Europe, a systematic review: eastern Europe». Parasites & Vectors, 11, 1, 30-10-2018, pàg. 569. DOI: 10.1186/s13071-018-3153-5. ISSN: 1756-3305. PMC: PMC6208121. PMID: 30376899.
- ↑ Dixon, Matthew A; Braae, Uffe C; Winskill, Peter; Devleesschauwer, Brecht; Trevisan, Chiara «Modelling for Taenia solium control strategies beyond 2020». Bulletin of the World Health Organization, 98, 3, 01-03-2020, pàg. 198–205. DOI: 10.2471/BLT.19.238485. ISSN: 0042-9686. PMC: PMC7047036. PMID: 32132754.
- ↑ CystiTeam Group for Epidemiology and Modelling of Taenia solium Taeniasis/Cysticercosis «The World Health Organization 2030 goals for Taenia solium: Insights and perspectives from transmission dynamics modelling» (en anglès). Gates Open Research, 3, 13-12-2019, pàg. 1546. DOI: 10.12688/gatesopenres.13068.2. ISSN: 2572-4754. PMC: PMC6820453. PMID: 31701092.
- ↑ «Teniasis y cisticercosis» (en castellà). [Consulta: 18 novembre 2021].
Enllaços externs
[modifica]- Taenia solium Genome Project - UNAM Arxivat 2016-03-03 a Wayback Machine..
- Cysticercosi at DPD Arxivat 2013-06-01 a Wayback Machine..
- Taeniasi at Stanford Arxivat 2013-10-02 a Wayback Machine..
- Taenia solium at Bioweb.
- Paràsits en humans.
