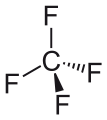
Tetrafluorometà
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 87,994 Da |
| Estructura química | |
| Fórmula química | CF₄ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Moment dipolar elèctric | 0 D |
| Punt de fusió | −183,59 ℃ |
| Punt d'ebullició | −128 ℃ (a 101 Pa) −128,02 ℃ (a 101,325 kPa) |
| Moment dipolar elèctric | 0 D |
| Perill | |
| Potencial d'escalfament global | 7.349 |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El tetrafluorometà, també conegut com a tetrafluorur de carboni, és el més simple dels fluorocarbonis. Té una força d'unió molt alta a causa de la naturalesa de l'enllaç carboni-fluor. També pot ser classificat com un haloalcà o halometà. A causa dels múltiples enllaços carboni-fluor, i l'alta electronegativitat del fluor, el carboni en tetrafluorometà té una càrrega parcial positiva significativa que enforteix i escurça els quatre enllaços carboni-fluor, proporcionant caràcter iònic addicional. Igual que altres fluorocarbonis, és molt estable a causa de la fortalesa dels seus enllaços carboni-fluor. Els enllaços a tetrafluorometà tenen una energia d'enllaç de 515 kJ ⋅ mol-1. Com a resultat, és inert als àcids i als hidròxids. No obstant això, reacciona de forma explosiva amb metalls alcalins. I la descomposició tèrmica o la combustió de CFC 14 produeix gasos tòxics (fluorur de carbonil i monòxid de carboni).[1]
De vegades s'utilitza com a refrigerant de baixa temperatura. També, s'utilitza en l'electrònica de microfabricació o, en combinació amb l'oxigen, com un reactiu d'atac de plasma per al silici, diòxid de silici i nitrur de silici. Per acabar, té usos en detectors de neutrons.
El tetrafluorometà és un dels principals gasos amb efecte d'hivernacle. És molt estable, té una vida atmosfèrica de 50.000 anys, i un alt potencial d'escalfament d'hivernacle de 6500 (que és lliurat pels primers 100 anys d'aquests, el CO₂ té un factor d'1), però, la quantitat baixa en l'atmosfera limita el seu efecte radiatiu global.
Encara que estructuralment són similars als altres CFCs, aquests no esgoten la capa d'ozó. Això és degut al fet que la destrucció de la capa d'ozó és causada pels àtoms de clor en els CFCs, que es dissocien quan incideix la radiació ultraviolada. Enllaços carboni-fluor són més forts i menys propensos a dissociar. Però, tot i no destruir la capa d'ozó, és el gas amb efecte d'hivernacle més persistent.[2]
Galeria
[modifica]-
Geometria CFC 14
-
Fórmula estructural
-
Representació espacial
Referències
[modifica]- ↑ O'Hagan D «Understanding organofluorine chemistry and in cations. An introduction to the C–F bond». Chemical Society Reviews, 37, 2, 2-2008, pàg. 308–19. DOI: 10.1039/b711844a. PMID: 18197347.
- ↑ Lemal, D.M. «Perspective on Fluorocarbon Chemistry». J. Org. Chem., 69, 1, 2004, pàg. 1–11. DOI: 10.1021/jo0302556. PMID: 14703372.