Western blot

El western blot (de vegades anomenat proteïna immunoblot), o western blot, és una tècnica analítica àmpliament utilitzada en biologia molecular i immunogenètica per a detectar proteïnes específiques en una mostra d'homogeneïtzació o extracte de teixits.
En resum, la mostra experimenta una desnaturalització de proteïnes, seguida d'una electroforesi en gel. A sintètic o d'origen animal anticòs (conegut com el anticòs primari) es cregui que reconeix i s'uneix a una proteïna diana específica. La membrana d'electroforesi es renta en una solució que conté l'anticòs primari, abans que es renti l'excés d'anticòs. S'afegeix un anticòs secundari que reconeix i s'uneix a l'anticòs primari. L'anticòs secundari es visualitza mitjançant diversos mètodes com la tinció, la immunofluorescència i la radioactivitat, cosa que permet la detecció indirecta de la proteïna diana específica.
Altres tècniques relacionades inclouen l'anàlisi de transferència de punts, la transferència quantitativa de punts, la immunohistoquímica i la immunocitoquímica, on s'utilitzen anticossos per detectar proteïnes en teixits i cèl·lules mitjançant immunotinció i assaig d'immunosorbents lligats a enzims (ELISA).
El nom de western blot és un joc de paraules amb Southern blot, una tècnica per a la detecció d'ADN que porta el nom del seu inventor, el biòleg anglès Edwin Southern. De la mateixa manera, la detecció d'ARN es denomina Northern Blot.[1] W. Neal Burnette va donar el terme "western blot" el 1981,[2] encara que el propi mètode es va originar el 1979 al laboratori de Harry Towbin a l'Institut Friedrich Miescher de Basilea, Suïssa.[3] Entre el 1979 i el 2019 "s'ha esmentat als títols, resums i paraules clau de més de 400.000 publicacions llistades a PubMed " i pot continuar sent la tècnica d'anàlisi de proteïnes més utilitzada.[4]
Aplicacions
[modifica]El western blot s'utilitza àmpliament en bioquímica per a la detecció qualitativa de proteïnes individuals i modificacions de proteïnes (com ara modificacions post-translacionals). S'estima que almenys el 8-9% de totes les publicacions relacionades amb les proteïnes apliquen western blots. S'utilitza com a mètode general per identificar la presència d'una única proteïna específica dins d'una barreja complexa de proteïnes. Es pot obtenir una estimació semi-quantitativa d'una proteïna a partir de la mida i la intensitat del color d'una banda de proteïnes a la membrana de la transferència. A més, l'aplicació d'una sèrie de dilució d'una proteïna purificada de concentracions conegudes es pot utilitzar per permetre una estimació més precisa de la concentració de proteïnes. El western blot s'utilitza habitualment per verificar la producció de proteïnes després de la clonació. També s'utilitza en diagnòstics mèdics, per exemple, a la prova del VIH o a la prova d' ESB.
La prova de confirmació del VIH utilitza un western blot per detectar anticossos anti-VIH en una mostra de sèrum humà. Les proteïnes de cèl·lules conegudes infectades pel VIH estan separades i esborrades en una membrana com es va esmentar anteriorment. A continuació, el sèrum a provar s'aplica a la fase d'incubació d'anticossos primaris; s'anticipa l'anticòs lliure i s'afegeix un anticòs antihumà secundari lligat a un senyal enzimàtic. Les bandes tenyides indiquen llavors les proteïnes a les quals el sèrum del pacient conté anticossos.
També s'utilitza un western blot com a prova definitiva per a la variant de la malaltia de Creutzfeldt-Jakob, un tipus de malaltia prionial relacionada amb el consum de vedella contaminada del bestiar amb encefalopatia espongiforme bovina (EEB, coneguda habitualment com a "malaltia de les vaques boges").[5]
Una altra aplicació es troba en el diagnòstic de tularèmia. Una avaluació de la capacitat de Western blot per detectar anticossos contra F. tularensis va revelar que la seva sensibilitat és gairebé del 100% i l'especificitat del 99,6%.[6]
Algunes formes de proves de la malaltia de Lyme utilitzen Western Blot.[7] Un western blot també es pot utilitzar com a prova de confirmació de la infecció per hepatitis B i la infecció per HSV-2 (herpes tipus 2) En medicina veterinària, de vegades s'utilitza un western blot per confirmar l'estat de FIV + en gats.
Altres aplicacions de la tècnica western blot inclouen el seu ús per l'Agència Mundial Antidopatge (WADA). El dopatge sanguini és l'ús indegut de certes tècniques i / o substàncies per augmentar la massa de glòbuls vermells, cosa que permet al cos transportar més oxigen als músculs i, per tant, augmentar la resistència i el rendiment. Hi ha tres substàncies o mètodes àmpliament coneguts que s'utilitzen per al dopatge sanguini, a saber, l'eritropoietina (EPO), els portadors d'oxigen sintètics i les transfusions de sang. Cadascun està prohibit segons la llista de substàncies i mètodes prohibits de l'AMA. La tècnica western blot es va utilitzar durant la Copa Mundial de la FIFA 2014 en la campanya antidopatge d'aquest esdeveniment.[8] En total, més de 1000 mostres van ser recollides i analitzades per Reichel, et al. al Laboratori acreditat per l'AMA de Lausana, Suïssa.[9] Investigacions recents que utilitzen la tècnica de Western blot van mostrar una millor detecció d'EPO en sang i orina basada en nous gels horitzontals prefabricats Velum SAR optimitzats per a anàlisis rutinaris.[10] Amb l'adopció de la SAR-PAGE horitzontal en combinació amb els gels Velum SAR suportats per pel·lícula prefabricats, es va millorar significativament la capacitat discriminatòria de l'aplicació de micro-dosis de rEPO.
Procediment
[modifica]El mètode Western blot es compon d'una electroforesi en gel per separar proteïnes natives mitjançant una estructura 3-D o proteïnes desnaturalitzades per la longitud del polipèptid, seguida d'una transferència electroforètica a una membrana (majoritàriament PVDF o nitrocel·lulosa) i un procediment d'immunotinció per visualitzar determinada proteïna a la membrana de la transferència. SDS-PAGE s'utilitza generalment per a la desnaturalització de la separació electroforètica de proteïnes. El SDS s'utilitza generalment com a tampó (així com en el gel) per tal de donar a totes les proteïnes presents una càrrega negativa uniforme, ja que les proteïnes poden estar carregades de manera positiva, negativa o neutral. Aquest tipus d'electroforesi es coneix com a SDS-PAGE (electroforesi en gel de poliacrilamida SDS). Abans de l'electroforesi, sovint es bullen mostres de proteïnes per desnaturalitzar les proteïnes presents. Això garanteix que les proteïnes estiguin separades en funció de la mida i eviti que les proteases (enzims que descomponen les proteïnes) degradin mostres. Després de la separació electroforètica, les proteïnes es transfereixen a una membrana (típicament nitrocel·lulosa o PVDF), on es bloquegen amb llet (o altres agents de bloqueig) per evitar la unió no específica d'anticossos, i després es tenyeixen amb anticossos específics de la proteïna objectiu.[3][11] Finalment, la membrana es tenyirà amb un anticòs secundari que reconeix la primera tinció d'anticossos, que després es pot utilitzar per a la detecció mitjançant diversos mètodes. El pas d'electroforesi en gel s'inclou en l'anàlisi Western blot per resoldre el problema de la reactivitat creuada dels anticossos.
Electroforesi en gel
[modifica]Les proteïnes de la mostra es separen mitjançant electroforesi en gel. La separació de proteïnes pot ser per punt isoelèctric (pI), pes molecular, càrrega elèctrica o una combinació d'aquests factors. La naturalesa de la separació depèn del tractament de la mostra i de la naturalesa del gel.
De llarg, el tipus més comú d'electroforesi en gel utilitza gels de poliacrilamida i tampons carregats amb dodecilsulfat de sodi (SDS). SDS-PAGE (electroforesi en gel de poliacrilamida SDS) manté els polipèptids en estat desnaturalitzat una vegada que han estat tractats amb forts agents reductors per eliminar l'estructura secundària i terciària (per exemple, enllaços disulfurs [SS] a grups sulfhidril [SH i SH]) i permet així la separació de proteïnes per la seva massa molecular. Les proteïnes de la mostra es cobreixen en la SDS carregada negativament, convertint-se efectivament en anióniques, i migren cap a l'ànode carregat positivament (de més tensió) (que normalment té un fil vermell) a través de la malla d'acrilamida del gel. Les proteïnes més petites migren més ràpidament a través d'aquesta malla i, per tant, les proteïnes se separen segons la mida (normalment mesurada en kilodaltons, kDa). La concentració d'acrilamida determina la resolució del gel: com més gran sigui la concentració d'acrilamida, millor serà la resolució de les proteïnes de menor pes molecular. Com més baixa sigui la concentració d'acrilamida, millor serà la resolució de proteïnes de major pes molecular. Les proteïnes només viatgen en una dimensió al llarg del gel per a la majoria de borrons.
Les mostres es carreguen als pous del gel. Un carril sol estar reservat per a un marcador o escala, que és una barreja disponible comercialment de proteïnes de pesos moleculars coneguts, típicament tenyides per formar bandes visibles i de colors. Quan s'aplica tensió al llarg del gel, les proteïnes migren a través d'ell a diferents velocitats en funció de la seva mida. Aquests diferents índexs d'avanç (diferents mobilitats electroforètiques) es separen en bandes dins de cada carril. Les bandes de proteïnes es poden comparar amb les bandes d'escala, cosa que permet estimar el pes molecular de la proteïna.

També és possible utilitzar un gel bidimensional que dissemini les proteïnes d'una sola mostra en dues dimensions. Les proteïnes es separen segons el punt isoelèctric (pH en què tenen una càrrega neta neutra) a la primera dimensió i segons el seu pes molecular a la segona dimensió.
Transferència
[modifica]Per fer les proteïnes accessibles a la detecció d'anticossos, es traslladen des del gel a una membrana feta de nitrocel·lulosa (NC) o difluorur de polivinilidè (PVDF). El mètode més utilitzat per transferir les proteïnes s'anomena electroblotting. L'electrotransferència utilitza un corrent elèctric per arrossegar les proteïnes carregades negativament del gel cap a l'ànode carregat positivament i cap a la membrana PVDF o NC. Les proteïnes es mouen des del gel cap a la membrana mantenint l'organització que tenien dins del gel. Un mètode de transferència més antic consisteix a col·locar una membrana a sobre del gel i a sobre una pila de papers filtrants. Tota la pila es col·loca en una solució tampó que fa pujar el paper per acció capil·lar, portant les proteïnes. A la pràctica, aquest mètode no s'utilitza habitualment a causa del llarg temps del procediment.
Com a resultat de qualsevol procés de transferència, les proteïnes s'exposen sobre una fina capa de membrana per a la seva detecció. Les dues varietats de membrana s'escullen per les seves propietats d'unió a proteïnes no específiques (és a dir, uneixen totes les proteïnes per igual). La unió de proteïnes es basa en interaccions hidròfobes, així com en interaccions carregades entre la membrana i la proteïna. Les membranes de nitrocel·lulosa són més barates que el PVDF, però són molt més fràgils i no poden suportar sondejos repetits.

La tinció total de proteïnes permet visualitzar la proteïna total que s'ha transferit amb èxit a la membrana, cosa que permet a l'usuari comprovar la uniformitat de la transferència de proteïnes i realitzar la normalització posterior de la proteïna objectiu amb la quantitat real de proteïna per carril. La normalització amb l'anomenat "control de càrrega" es va basar en la immunotinció de proteïnes de manteniment en el procediment clàssic, però recentment es dirigeix cap a la tinció total de proteïnes, a causa de múltiples beneficis.[12] S'han descrit almenys set enfocaments diferents per a la tinció total de proteïnes per a la normalització de Western blot: Ponceau S, tècniques sense taques, Sypro Ruby, Epicocconone, Coomassie R-350, Amido Black i Cy5. Per evitar el soroll del senyal, s'ha de realitzar una tinció total de proteïna abans de bloquejar la membrana. No obstant això, també s'han descrit tincions post-anticossos.[13]
Bloqueig
[modifica]Atès que la membrana s'ha escollit per la seva capacitat d'unir proteïnes i com que tant els anticossos com la diana són proteïnes, cal prendre mesures per evitar les interaccions entre la membrana i l'anticòs utilitzat per a la detecció de la proteïna diana. El bloqueig de la unió inespecífica s'aconsegueix col·locant la membrana en una solució diluïda de proteïna - típicament un 3-5% d'albúmina sèrica bovina (BSA) o llet seca sense greixos (ambdós són econòmics) en solució salina tris-buffered (TBS) o I-Block, amb un percentatge mínim (0,1%) de detergent com Tween 20 o Triton X-100. Tot i que es prefereix la llet seca sense greix per la seva disponibilitat, es necessita una solució de bloqueig adequada, ja que no totes les proteïnes de la llet són compatibles amb totes les bandes de detecció.[14] La proteïna de la solució diluïda s'uneix a la membrana en tots els llocs on les proteïnes diana no s'han unit. Així, quan s'afegeix l'anticòs, no es pot unir a la membrana i, per tant, l'únic lloc d'unió disponible és la proteïna diana específica. D'aquesta manera es redueix el fons del producte final de la transferència western, cosa que provoca resultats més nets i s'eliminen els falsos positius.
Incubació
[modifica]Durant el procés de detecció, la membrana "sonda" per a la proteïna d'interès amb un anticòs modificat que està vinculat a un enzim informador; quan s'exposa a un substrat adequat, aquest enzim provoca una reacció colorimètrica i produeix un color. Per diversos motius, això tradicionalment té lloc en un procés de dos passos, tot i que ara hi ha mètodes de detecció d'un pas disponibles per a determinades aplicacions.
Anticòs primari
[modifica]Els anticossos primaris es generen quan una espècie hoste o un cultiu de cèl·lules immunes està exposat a la proteïna d'interès (o una part d'aquesta). Normalment, això forma part de la resposta immune, mentre que aquí es recol·lecten i s'utilitzen com a eines de detecció sensibles i específiques que uneixen directament la proteïna.
Després del bloqueig, s'incuba una solució d'anticòs primari (generalment entre 0,5 i 5 micrograms / ml) diluïda en tampó de rentat PBS o TBST amb la membrana sota una agitació suau durant una hora a temperatura ambient o durant la nit a 4 ° C. la solució d'anticossos s'incuba amb la membrana durant 30 minuts fins a la nit. També es pot incubar a diferents temperatures, amb temperatures inferiors associades a més unió, tant específiques (a la proteïna diana, el "senyal") com no específiques ("soroll"). Després de la incubació, la membrana es renta diverses vegades amb tampó de rentat per eliminar l'anticòs primari no unit i, per tant, minimitzar el fons.[14] Normalment, la solució tampó de rentat es compon de solució salina tamponada amb un petit percentatge de detergent i, de vegades, amb llet en pols o BSA.
Anticòs secundari
[modifica]Després d'esbandir la membrana per eliminar l'anticòs primari no unit, la membrana s'exposa a un altre anticòs conegut com a anticòs secundari. Els anticossos provenen de fonts animals (o cultius d'hibridoma d'origen animal). L'anticòs secundari reconeix i s'uneix a la porció específica de l'espècie de l'anticòs primari. Per tant, un anticòs secundari anti-ratolí s'uneix a gairebé qualsevol anticòs primari d'origen de ratolí i es pot anomenar anticòs "anti-espècie" (per exemple, anti-ratolí, anti-cabrum, etc.).). Per permetre la detecció de la proteïna diana, l'anticòs secundari es relaciona comunament amb la biotina o un enzim informador com la fosfatasa alcalina o la peroxidasa de rave picant. Això significa que diversos anticossos secundaris s'uneixen a un anticòs primari i augmenten el senyal, cosa que permet detectar proteïnes d'una concentració molt inferior a la que seria visible només amb SDS-PAGE.
La peroxidasa de rave picant (HRP) es relaciona comunament amb anticossos secundaris per permetre la detecció de la proteïna diana per quimioluminescència. El substrat quimioluminescent és escindit per HRP, donant lloc a la producció de luminescència. Per tant, la producció de luminescència és proporcional a la quantitat d'anticòs secundari conjugat amb HRP i, per tant, mesura indirectament la presència de la proteïna diana. Es col·loca un full sensible de pel·lícula fotogràfica contra la membrana i l'exposició a la llum de la reacció crea una imatge dels anticossos units a la taca. Un enfocament més barat però menys sensible utilitza una tinció de 4-cloronaftol amb un 1% de peròxid d'hidrogen ; la reacció dels radicals peròxid amb el 4-cloronaftol produeix una taca de color porpra fosc que es pot fotografiar sense utilitzar cap pel·lícula fotogràfica especialitzada.

Igual que amb els procediments ELISPOT i ELISA, l'enzim pot subministrar-se una molècula de substrat que l'enzim convertirà en un producte de reacció de colors que serà visible a la membrana (vegeu la figura següent amb bandes blaves).
Un altre mètode de detecció d'anticossos secundaris utilitza un anticòs lligat al fluoròfor a infrarojos propers (NIR). La llum produïda a partir de l'excitació d'un colorant fluorescent és estàtica, cosa que fa que la detecció fluorescent sigui una mesura més precisa i precisa de la diferència en el senyal produït per anticossos marcats units a proteïnes en un western blot. Les proteïnes es poden quantificar amb precisió perquè el senyal generat per les diferents quantitats de proteïnes de les membranes es mesura en estat estàtic, en comparació amb la quimioluminescència, en què la llum es mesura en un estat dinàmic.[15]
Una tercera alternativa és utilitzar un marcador radioactiu en lloc d'un enzim acoblat a l'anticòs secundari, com ara marcar una proteïna d'unió a anticossos com la proteïna A de Staphylococcus o la Streptavidina amb un isòtop radioactiu de iode. Atès que altres mètodes són més segurs, ràpids i econòmics, aquest mètode ara rarament s'utilitza; tanmateix, un avantatge d'aquest enfocament és la sensibilitat de la imatge basada en la radiografia automàtica, que permet una quantificació de proteïnes molt precisa quan es combina amb un programari òptic (per exemple, Optiquant).
Un pas
[modifica]Històricament, el procés de sondeig es realitzava en dos passos a causa de la facilitat relativa de produir anticossos primaris i secundaris en processos separats. Això proporciona als investigadors i a les empreses enormes avantatges en termes de flexibilitat, reducció de costos i afegeix un pas d'amplificació al procés de detecció. Tenint en compte l'aparició de l'anàlisi de proteïnes d'alt rendiment i els límits inferiors de detecció, hi ha hagut interès en desenvolupar sistemes de sondeig en un pas que permetessin que el procés es produís més ràpidament i amb menys consumibles. Això requereix un anticòs de sonda que reconegui la proteïna d'interès i conté una etiqueta detectable, sondes que sovint estan disponibles per a etiquetes de proteïnes conegudes. La sonda primària s'incuba amb la membrana d'una manera similar a la de l'anticòs primari en un procés de dos passos, i després està preparada per a la detecció directa després d'una sèrie de passos de rentat.
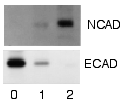
Detecció i visualització
[modifica]Després de rentar les sondes no lligades, el Western blot està preparat per a la detecció de les sondes marcades i lligades a la proteïna d'interès. En termes pràctics, no tots els westerns revelen proteïnes només en una banda d'una membrana. Les aproximacions de mida es prenen comparant les bandes tacades amb la del marcador o escala carregada durant l'electroforesi. El procés es repeteix habitualment per a una proteïna estructural, com l'actina o la tubulina, que no hauria de canviar entre mostres. La quantitat de proteïna diana es normalitza a la proteïna estructural per controlar entre grups. Una estratègia superior és la normalització de la proteïna total visualitzada amb tricloroetanol [16][17] o epicocconona.[18] Aquesta pràctica garanteix la correcció de la quantitat de proteïna total a la membrana en cas d'errors o transferències incompletes. (veure normalització de Western blot)
Detecció colorimètrica
[modifica]El mètode de detecció colorimètrica depèn de la incubació del western blot amb un substrat que reaccioni amb l'enzim informador (com la peroxidasa) que està unit a l'anticòs secundari. Això converteix el colorant soluble en una forma insoluble d'un color diferent que precipita al costat de l'enzim i, per tant, taca la membrana. A continuació, es deté el desenvolupament de la borrosa rentant el colorant soluble. Els nivells de proteïnes s'avaluen mitjançant la densitometria (la intensitat de la taca) o l'espectrofotometria.
Detecció quimioluminiscent
[modifica]Els mètodes de detecció quimioluminiscents depenen de la incubació del western blot amb un substrat que lluminarà quan s'exposi al reporter sobre l'anticòs secundari. A continuació, la llum es detecta mitjançant càmeres CCD que capturen una imatge digital del western blot o de la pel·lícula fotogràfica. L'ús de pel·lícules per a la detecció de Western blot desapareix lentament a causa de la no linealitat de la imatge (quantificació no precisa). La imatge s'analitza per densitometria, que avalua la quantitat relativa de tinció de proteïnes i quantifica els resultats en termes de densitat òptica. Un programari més recent permet anàlisis de dades addicionals, com ara l'anàlisi de pes molecular, si s'utilitzen estàndards adequats.

Detecció radioactiva
[modifica]Les etiquetes radioactives no requereixen substrats enzimàtics, sinó que permeten la col·locació de pel·lícules de raigs X directament contra la transferència occidental, que es desenvolupa a mesura que s'exposa a l'etiqueta i crea regions fosques que corresponen a les bandes proteiques d'interès (veure imatge a dalt). La importància dels mètodes de detecció radioactiva disminueix a causa de la seva radiació perillosa, ja que és molt car, els riscos per a la salut i la seguretat són elevats i l'ECL (quimioluminescència millorada) proporciona una alternativa útil.
Detecció fluorescent
[modifica]La sonda etiquetada amb fluorescència és excitada per la llum i l'emissió de l'excitació és detectada per un fotosensor com una càmera CCD equipada amb filtres d'emissió adequats que capturen una imatge digital del western blot i permeten anàlisis de dades addicionals, com ara l'anàlisi de pes molecular i una anàlisi quantitativa western blot. Es considera que la fluorescència és un dels millors mètodes de quantificació, però és menys sensible que la quimioluminescència.[19]
Sondeig secundari
[modifica]Una diferència important entre les membranes de nitrocel·lulosa i PVDF es relaciona amb la capacitat de cadascuna d'elles per suportar "eliminar" anticossos i reutilitzar la membrana per a posteriors sondes d'anticossos. Tot i que hi ha protocols ben establerts disponibles per a l'extracció de membranes de nitrocel·lulosa, el PVDF més resistent permet un despullament més fàcil i una major reutilització abans de limitar els experiments de soroll de fons. Una altra diferència és que, a diferència de la nitrocel·lulosa, el PVDF s'ha de remullar amb un 95% d'etanol, isopropanol o metanol abans d'utilitzar-lo. Les membranes PVDF també solen ser més gruixudes i més resistents als danys durant l'ús
Electroforesi en gel 2-D
[modifica]SDS-PAGE bidimensional utilitza els principis i tècniques esmentats anteriorment. 2-D SDS-PAGE, com el seu nom indica, implica la migració de polipèptids en 2 dimensions. Per exemple, a la primera dimensió, els polipèptids se separen segons el punt isoelèctric, mentre que a la segona dimensió, els polipèptids se separen segons el seu pes molecular. El punt isoelèctric d'una determinada proteïna està determinat pel nombre relatiu d'aminoàcids carregats positivament (per exemple, lisina, arginina) i negativament (per exemple, glutamat, aspartat), amb aminoàcids carregats negativament que contribueixen a un punt isoelèctric baix i aminoàcids carregats positivament fins a un punt isoelèctric elevat. Les mostres també es podrien separar primer en condicions no reductores mitjançant SDS-PAGE i en condicions reductores en la segona dimensió, que trenca enllaços disulfurs que mantenen juntes les subunitats. SDS-PAGE també es pot combinar amb urea-PAGE per obtenir un gel bidimensional.
En principi, aquest mètode permet la separació de totes les proteïnes cel·lulars en un sol gel gran. Un dels principals avantatges d'aquest mètode és que sovint distingeix entre diferents isoformes d'una proteïna concreta, per exemple, una proteïna que s'ha fosforilat (mitjançant l'addició d'un grup amb càrrega negativa). Les proteïnes que han estat separades es poden retallar del gel i després analitzar-les mitjançant espectrometria de masses, que identifica el seu pes molecular.
Modificacions del western blot
[modifica]- Far-eastern blot
- Far-western blot
- Eastern blot
- Northwestern blot
Referències
[modifica]- ↑ «Method for detection of specific RNAs in agarose gels by transfer to diazobenzyloxymethyl-paper and hybridization with DNA probes». Proceedings of the National Academy of Sciences USA, 74, 12, 1977, pàg. 5350–5354. Bibcode: 1977PNAS...74.5350A. DOI: 10.1073/pnas.74.12.5350. PMC: 431715. PMID: 414220.
- ↑ Burnette WN. «'Western blotting': electrophoretic transfer of proteins from sodium dodecyl sulfate—polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A». Analytical Biochemistry, 112, 2, 1981, pàg. 195–203. DOI: 10.1016/0003-2697(81)90281-5. ISSN: 0003-2697. PMID: 6266278.
- ↑ 3,0 3,1 «Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications». Proceedings of the National Academy of Sciences USA, 76, 9, 1979, pàg. 4350–54. Bibcode: 1979PNAS...76.4350T. DOI: 10.1073/pnas.76.9.4350. PMC: 411572. PMID: 388439.
- ↑ «40 years Western blotting: A scientific birthday toast». Journal of Proteomics, 212, 2020, pàg. 103575. DOI: 10.1016/j.jprot.2019.103575. PMID: 31706026.
- ↑ Ingrosso, Loredana; Vetrugno, Vito; Cardone, Franco; Pocchiari, Maurizio Trends in Molecular Medicine, 8, 6, 01-06-2002, pàg. 273–280. DOI: 10.1016/S1471-4914(02)02358-4. PMID: 12067613.
- ↑ SCHMITT, P.; SPLETTSTÖSSER, W.; PORSCH-ÖZCÜRÜMEZ, M.; FINKE, E.-J.; GRUNOW, R. Epidemiology and Infection, 133, 4, 16-02-2005, pàg. 759–766. DOI: 10.1017/s0950268805003742. ISSN: 0950-2688. PMC: 2870305. PMID: 16050523.
- ↑ Artsob, Harvey The Canadian Journal of Infectious Diseases, 4, 2, 1993, pàg. 115–116. DOI: 10.1155/1993/796390. PMC: 3250769. PMID: 22346434.
- ↑ Baume, Norbert; Jan, Nicolas; Emery, Caroline; Mandanis, Béatrice; Schweizer, Carine British Journal of Sports Medicine, 49, 9, 2015, pàg. 614–622. DOI: 10.1136/bjsports-2015-094762. ISSN: 0306-3674. PMC: 4413745. PMID: 25878079.
- ↑ «Evaluation of AMGEN clone 9G8A anti-Epo antibody for application in doping control». Drug Test Anal, 8, 11–12, 2016, pàg. 1131–1137. DOI: 10.1002/dta.2057. PMID: 27552163.
- ↑ https://precisionbiosystems.com/wp-content/uploads/2016/10/Application_Note_Improvements-for-EPO-detection_Schwenke_2015.pdf
- ↑ «Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure». Proceedings of the National Academy of Sciences USA, 76, 7, 1979, pàg. 3116–20. Bibcode: 1979PNAS...76.3116R. DOI: 10.1073/pnas.76.7.3116. PMC: 383774. PMID: 91164.
- ↑ Moritz, CP. Proteomics, 17, 20, 20-09-2017, pàg. 1600189. DOI: 10.1002/pmic.201600189. PMID: 28941183.
- ↑ Welinder, Charlotte; Ekblad, Lars Journal of Proteome Research, 10, 3, 04-03-2011, pàg. 1416–1419. DOI: 10.1021/pr1011476. ISSN: 1535-3893. PMID: 21186791.
- ↑ 14,0 14,1 Mahmood, Tahrin; Yang, Ping-Chang N Am J Med Sci, 4, 9, 9-2012, pàg. 429–434. DOI: 10.4103/1947-2714.100998. PMC: 3456489. PMID: 23050259.
- ↑ Ambroz K. «Improving quantification accuracy for western blots» (PDF). Image Analysis, 20-09-2006.[Enllaç no actiu]
- ↑ Stennert, E; Arold, R HNO, 21, 10, 1973, pàg. 293–6. PMID: 4769330.
- ↑ Gilda, J. E.; Gomes, A. V. Analytical Biochemistry, 440, 2, 2013, pàg. 186–8. DOI: 10.1016/j.ab.2013.05.027. PMC: 3809032. PMID: 23747530.
- ↑ Moritz, C. P.; Marz, S. X.; Reiss, R; Schulenborg, T; Friauf, E Proteomics, 14, 2–3, 2014, pàg. 162–8. DOI: 10.1002/pmic.201300089. PMID: 24339236.
- ↑ Mathews, Suresh T. «Imaging Systems for Westerns: Chemiluminescence vs. Infrared Detection». A: Protein Blotting and Detection. 536. Humana Press, 2009, p. 499–513 (Methods in Molecular Biology). DOI 10.1007/978-1-59745-542-8_51. ISBN 978-1-934115-73-2.
Vegeu també
[modifica]Enllaços externs
[modifica]- Yang, Ping-Chang; Mahmood, Tahrin North American Journal of Medical Sciences, 4, 9, 2012, pàg. 429. DOI: 10.4103/1947-2714.100998. ISSN: 1947-2714. PMC: 3456489. PMID: 23050259.
- «Western Blotting». YouTube. Bio-Rad Laboratories, 16-10-2012.
- «Blotting Techniques/ The Principle of Western Blotting». YouTube. Biomedical and Biological Sciences, 23-03-2017.
