Annexina A2
L'annexina A2 també denominada annexina II és una annexina que existeix com a monòmer i com a complex heterotetraméric unida al receptor del plasminogen (S100A10). Forma part d'una àmplia família de proteïnes: les annexines. Aquestes van ser descobertes per primera vegada en les cel·lules animals i es troben en tots els organismes vius: s'expressen en vertebrats, invertebrats, fongs i protozous, plantes i protists.
L'annexina A2 és present en els vertebrats, en un gran nombre de cèl·lules, entre elles les endotelials, els monòcits, els macròfags i en la majoria de cèl·lules canceroses. Està constituïda per dues estructures bàsiques: un domini variable del cap amino-terminal i un domini del carboxil homòleg.
Participa en una gran varietat de funcions relacionades amb la membrana com ara l'exocitosi, l'endocitosi, la regulació de transport d'ions (canal d'ions), la reorganització de la membrana, el tràfic vesicular i la regulació redox. El complex A2-S100A10 regula una sèrie de funcions de l'annexina A2 i, per tant, les propietats bioquímiques de l'annexina A2 monomèrica i l'annexina A2 heterotetramèrica són diferents.
Extracel·lularment, funciona principalment com un receptor cel·lular de superfície per a la S100A10. La subunitat S100A10 té un paper clau en el manteniment de la permeabilitat vascular mitjançant la regulació de la generació de la superfície cel·lular de l'enzim proteolític plasmina. En aquest sentit, les funcions S100A10-dependents de generació de plasmina per estimular la descomposició dels coàguls de sang de fibrina (fibrinòlisi). A més, el complex annexina A2-S100A10 participa en l'oncogènesi, també per la regulació de l'activitat proteolítica de la plasmina. Aquesta activitat, a la superfície de la cèl·lula, és utilitzada per les cèl·lules canceroses, i associada a tumors per tal que els macròfags i neutròfils puguin digerir la matriu extracel·lular i altres barreres de teixit.
Estructura
[modifica]
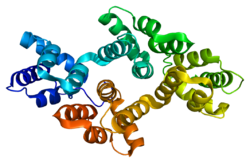
L'annexina A2 és plana i forma un disc lleugerament corbat amb una banda còncava i una de convexa. La unió de calci i fosfolípids i la unió a la membrana es produeixen en el costat convex, mentre que la unió de la proteïna S100A10 es produeix en el costat còncau oposat i s'enfronta al citosol. Aquesta proteïna existeix com a monòmer i com un complex heterotetramèric amb la proteïna del receptor del plasminogen, S100A10.
Com totes les annexines en general, la A2 es compon de dos dominis principals, el domini amino-terminal, que és altament variant, i el domini carboxil-terminal, que es conserva. La regió amino-terminal és el lloc per a la modificació post-traduccional, així com per a les interaccions amb lligands i proteïnes, mentre que la regió de nucli carboxil-terminal conté el lloc d'unió de calci i fosfolípids aniònics, heparina, ADN i F-actina.[5]
El nucli de domini carboxil-terminal es compon de quatre segments de repetició de 70 aminoàcids. Cada segment de repetició conté cinc hèlixs α amb quatre de les hèlixs orientades antiparal·lelament i la cinquena perpendicular a elles.[6]
El domini de cua amino-terminal de l'annexina A2 conté una regió d'hèlix alfa amfipàtica, la superfície hidròfoba de la qual s'uneix a la proteïna S100A10.
Unió amb la proteïna S100A10
[modifica]S100A10 pertany a un grup de proteïnes de petit pes molecular, dimèriques i d'unió a calci. En interaccionar amb l'annexina A2 es forma un complex heterotetramèric, és a dir, una proteïna que conté quatre subunitats unides per enllaços no covalents, i en què les subunitats no són totes idèntiques.
Per una banda, s'ha suggerit que cada molècula de l'annexina A2 s'uneix a una membrana plasmàtica en la posició exterior de l'heterotetràmer, amb S100A10 al centre del complex.[7] Un altre estudi mostra que les dues molècules d'annexina A2 s'uneixen a la mateixa membrana i el dímer S100A10 resideix en el costat exterior de l'heterotetràmer.[8]
Més recentment, es proposa que el complex format per annexina A2 i S100A10 existeix en la superfície interna de la cèl·lula com un octàmer en lloc de com un heterotetràmer.[9]
Regulació
[modifica]L'annexina A2 és regulada a nivell de transcripció i de traducció.
Transcripció
[modifica]La seva transcripció pot ser induïda per factors de creixement com ara la insulina, factors de creixement de fibroblasts i factors de creixement epidèrmic (en cèl·lules canceroses).[10] També s'ha demostrat un augment de l'expressió de l'annexina A2 en cèl·lules endotelials retinals i condròcits. A més, també es veu sobre-regulada en osteoblasts en condicions d'hipòxia.[11][12]
Una altra regulació de l'annexina A2 és a través de l'empalmament alternatiu que produeix isoformes d'annexina A2, diferents en les regions amino-terminal.
En humans, l'ARNm de l'annexina A2 és empalmat alternativament en dues formes, una de més abundant, i l'altra, que ho és menys, conté 18 aminoàcids més a l'extrem amino-terminal. És possible que aquesta última forma no s'assocï amb l'S100A10, ja que no té el residu de serina que és acetilat en la forma més abundant.[13]
Traducció
[modifica]La regió amino-terminal de l'annexina A2 conté llocs específics on es produeixen modificacions post-traduccionals i que serveixen per regular les propietats dels dominis amino i carboxil-terminal. Així el domini amino-terminal té zones específiques per l'acetilació i la fosforilació de certs aminoàcids com la serina i tirosina. [14]
La fosforilació és una modificació post-traduccional important que controla l'activitat i les funcions de diverses proteïnes cel·lulars com ara enzims, receptors, canals iònics i proteïnes reguladores o estructurals. Informes de múltiples laboratoris suggereixen que la fosforilació de l'annexina A2 (induïda per diversos factors de creixement) en diferents residus podria tenir efectes en la seva localització i activació funcional.[15]
Regulació redox
[modifica]Els residus de cisteïna són sovint uns dels aminoàcids sotmesos a reaccions redox reversibles sota condicions fisiològiques. El residu de cisteïna actua com un sensor redox que regula l'estructura i la funció proteica. Les cisteïnes sensibles a reaccions redox a pH neutre són aquelles amb forma (Cys-S-). Per contra, les cisteïnes amb forma (Cys-SH) no són reactives. L'annexina A2 té quatre residus de cisteïna (Cys-8, Cys-132, Cys-261 i Cys-334). Alguns estudis apunten que la Cys-132 i la Cys-261 formen ponts disulfur al monòmer de l'annexina A2. La Cys-8 és coneguda per ser una cisteïna sensible a les reaccions redox esmentades prèviament.[16]
Un petit percentatge del total d'annexina A2 de la cèl·lula es troba al nucli cel·lular. La seqüència d'export nuclear (NES) en l'annexina A2 es localitza a la cua amino-terminal i evita l'acumulació d'aquesta proteïna al nucli. Recentment s'ha demostrat que l'acumulació al nucli d'annexina A2 està relacionat amb la protecció cel·lular contra danys al DNA durant situacions d'estrés oxidatiu. Aquesta acumulació succeeix com a resposta a agents danyins pel DNA com la radiació gamma, la radiació ultraviolada, i l'estrès oxidatiu. Es creu que l'annexina A2 que s'acumula al nucli té el grup tiol de la Cys-8 capaç de reaccionar amb espècies reactives de l'oxigen (ROS) i això fa que sigui un bon agent antioxidant.[17]
Funcions
[modifica]Unió amb l'actina-F
[modifica]L'annexina A2 presenta una gran afinitat per unir-se amb l'actina-F en presència de calci i de forma cooperativa. La unió a aquesta proteïna causa un canvi en la seva conformació amb la qual cosa millora la capacitat per interactuar amb altres molècules que també tendeixen a agrupar-se.
L'activitat d'aquesta unió decreix amb la fosforilació de la Tyr-23, la zona més utilitzada per la tirosina quinasa Src, fet que suggereix un possible paper de la Src en l'associació de l'Annexina A2 amb l'actina.[18] A més, el monòmer és capaç d'unir-se a filaments pre-formats d'actina-F i capaç de regular el creixement dels nous filaments constituïts. Tot i presentar una gran afinitat d'agrupació amb l'actina-F, l'Annexina A2 està associada amb estructures de la membrana dinàmica del citoesquelet, com ara amb micropinosomes o fagosomes. Pot acumular-se damunt de fagosomes rics en actina, produïts quan segments exteriors són interioritzats gràcies als pigments de les cèl·lules epitelials, alliberant-se al mateix temps que l'actina.[19]
Exocitosi i endocitosi
[modifica]L'annexina A2 pot formar enllaços creuats entre diversos grànuls de secreció i la membrana plasmàtica de les cèl·lules neuroendocrines estimulades. Presenta un important paper en l'exocitosi no només per la formació i estabilització de microdominis lipídics a la membrana plasmàtica sinó també per l'organització de la maquinària d'exocitosi de les cèl·lules cromafines.[20] A través de la seva habilitat d'unió amb l'actina, també participa en la formació dels complexos de la membrana del citoesquelet que controlen la formació de lipids rafts i de zones funcionals d'exocitosi.
El seu destí és majoritàriament el compartiment endocític, arribant-hi gràcies a una seqüència específica present al domini de l'amino terminal. Això té lloc a zones de la membrana caracteritzades per un alt contingut en colesterol. Així doncs, l'annexina A2 pot interaccionar amb el colesterol formant plataformes riques en aquest esteroide als endosomes primerencs, fet que implica interaccions amb altres molècules.[21]
L'annexina A2 té també un paper important en l'endocitosi mitjançada per clatrina. Pot interaccionar amb les proteïnes efectores del Rab5, l'APPL1 i l'APPL2. De fet, és necessària per a la localització de l'APPL2 al llarg del Rab5, ja que la seva manca causaria la pèrdua de les proteïnes APPL i dels endosomes APPL.
A més, en les cèl·lules dendrítiques és secretada en exosomes en forma associada de raft. Hi ha exosomes que promouen el creixement de les cèl·lules tumorals i la metàstasi. D'aquí, l'annexina A2 s'ha identificat en exosomes de melanomes, de manera que podria servir com a eina de diagnòstic i com un biomarcador de la progressió i pronòstic del càncer.
Polaritat de les cèl·lules endotelials i epitelials
[modifica]Com a resposta d'estímuls externs, l'annexina A2 pot promoure la polaritat de les cèl·lules epitelials a través de dos processos: l'adhesió cèl·lula-cèl·lula i la formació d'unions adherents. Aquest segon procés el pot dur a terme tant en cèl·lules epitelials com endotelials a través de l'associació amb Cadherina-E epitelial i Cadherina-VE endotelial.
El complex annexina A2 - S100A10 podria ser reclutat al citoesquelet d'actina format per l'acció de les proteïnes d'unió a l'actina-F, les quals s'associen amb la Cadherina-E i amb nectines. Aquest complex reorganitza el citoesquelet d'actina, provocant l'associació dels sistemes de la Cadherina-E i els sistemes de nectina per formar sistemes d'unió adherents.[22]
Unió amb l'ARNm
[modifica]L'Annexina A2 es pot trobar en els complexos RNPm (ribonucleoproteïnes) i pot funcionar com una bastida de proteïnes nuclears per al reclutament d'altres proteïnes. Es pot trobar al nucli associada a l'ADN-Z i forma part del complex de reconeixement de l'encebador que estimula l'activitat de l'ADN polimerasa α.
La unió de l'Annexina A2 a l'ARNm és un procés que necessita calci i s'uneix a l'ARNm del gen oncogènic c-myc regulant la seva traducció. Les modificacions post-traduccionals de l'Annexina A2 afecten la seva unió amb l'ARNm. Quan la proteïna està enllaçada amb fosfolípids no interacciona amb el polinucleòtid, mentre que quan està unida amb l'actina-F sí que pot unir-s'hi.[23]
Processos on està implicada
[modifica]L'annexina A2 és una proteïna multifuncional implicada en la regulació de gens, la transformació cel·lular, la regulació dinàmica de la membrana, en la reordenació citoesquelet i la fibrinòlisi. És per aquests motius que no és estrany veure-la implicada en un gran nombre de patologies.
Paper en la progressió del càncer
[modifica]La recollida de proves demostra una correlació entre la desregulació de l'expressió de l'annexina A2 I la tumorogènesi de molts tipus de càncer diferents. Es creu que l'annexina és capaç de modular els processos principals de la progressió tumoral, concretament els que impliquen la invasió, la metàstasi i la resistència als medicaments. De fet, es creu que aquesta proteïna podria ser un potencial marcador de pronòstic o diagnòstic per la predicció de malignitat del tumor, la recurrència metastàtica i la supervivència del pacient.[24]
Mediadora de la invasió, metàstasi i resistència de medicaments en el càncer de mama
[modifica]El complex d'annexina A2-S100A10 també està potencialment implicat en la promoció de resistència en el càncer de mama. Clínicament, l'annexina A2 pot actuar com a indicador de la resposta patològica de la quimioteràpia en pacients de càncer de mama avançats. Els pacients que donen A2-positiu en el pretractament es prediu que tenen una mala resposta patològica a la quimioteràpia.[25]
Marcador metastàtic del carcinoma de cèl·lules renals (CCR)
[modifica]El carcinoma de cèl·lules renals (CCR) és el càncer més comú i representa el 3% de tots els càncers en adults. L'anàlisi immunohistoquímic mostra que l'annexina A2 regula més en els teixits de CCR a nivell d'ARNm i proteïnes que en teixits del túbul renal normal.[26]
Diana terapèutica en el càncer
[modifica]La unió de l'annexina A2 amb anticossos s'utilitza rutinàriament en investigació per reduir la progressió tumoral i la metàstasi. Un dels anticossos utilitzats és l'anti-annexina A2, que permet reduir la metàstasi i prolongar la supervivència dels subjectes de l'estudi.
Procés d'inflamació
[modifica]L'heterotràmer d'annexina A2-S100A10 té un paper crític en el procés d'inflamació mitjançant la producció de senyals pro-inflamatoris com a resposta a diversos estímuls i també promou la migració dependent de la plasmina i la infiltració dels macròfags.
Referències
[modifica]- ↑ 1,0 1,1 1,2 GRCh38: Ensembl release 89: ENSG00000182718 - Ensembl, May 2017
- ↑ 2,0 2,1 2,2 GRCm38: Ensembl release 89: ENSMUSG00000032231 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ Roth, D.; Morgan, A.; Burgoyne, R.D «Identification of a key domain in annexin and 14-3-3 proteins that stimulate calcium-dependent exocytosis in permeabilized adrenal chromaffin cells.». FEBS Lett, 1993, pàg. 207–210. PMID: 8462687.
- ↑ Liemann, S,; Huber, R. «Three-dimensional structure of annexins». Cell Mol. Life Sci, 1997, pàg. 516–521. PMID: 9230929.
- ↑ «Structural analysis of junctions formed between lipid membranes and several annexins by cryo-electron microscopy.». J. Mol. Biol, 1997, pàg. 42-55.
- ↑ «The molecular arrangement of membrane-bound annexin A2-S100A10 tetramer as revealed by scanning force microscopy.». Chembiochem, 2004, pàg. 1003-1006.
- ↑ Waisman D.; Bharadwaj A.; Bydoun M.; Holloway R. «Annexin II tetramer: Structure and function.». Mol. Cell Biochem, 1995, pàg. 149–150:301–322. PMC: 3634455.
- ↑ Keutzer, J.C.; Hirschhorn, R.R. «The growth-regulated gene 1B6 is identified as the heavy chain of calpactin I.». Exp. Cell Res., 5-1990, pàg. 153-159.
- ↑ Genetos, D.C.; Wong, A.; Watari, S.; Yellowley, C.E. «Hipoxia increases Annexin A2 expression in osteoblastic cells via VEGF and ERK». Bone, 2010, pàg. 1013-1019.
- ↑ Zhao, S.; Huang, L.; Wu, J.; Zhang, Y.; Pan, D. «Vascular endothelial growth factor upregulates expression of annexin A2 in vitro and in a mouse model of ischemic retinopathy». Mol. Vis., 2009, pàg. 1231-1242.
- ↑ Gerke, V.; Moss, S.E. «Annexins: from structure to function». Physiol. Rev., 4-2002, pàg. 71-331.[Enllaç no actiu]
- ↑ Gerke, V.; Creutz, C.E.; Moss, S.E. «Annexins: Linking Ca2+ siganling to membrane dynamics». Nat.Rev.Mol.Biol., 2005, pàg. 449-461.
- ↑ Biener, Y.; Feinstein, R.; Mayak, M.; Kaburagi, Y.; Kadowaki, T. «Annexin II is a novel player in insulin signal traduction. Possible association between annexin II phosphorylation and insulin receptor internalitzation». J. Biol. Chem., 11-1996, pàg. 29489-96.
- ↑ Wang, Y.; Yang, J.; Yi, J. «Redox sensing by proteins: oxidative modifications on cysteines and the consequent events». Antioxid Redox Signal., 4-2012, pàg. 649-57.
- ↑ Madureira, P.A.; Hill, R.; Lee, P.W.; Waisman, D.M. «Genotoxic agents promote the nuclear accumulation of annexin A2: role of annexin A2 in mitigating DNA damage». PLOS One, 2012.
- ↑ Grieve, Adam G.; Moss, Stephen E.; Hayes, Matthew J. «Annexin A2 at the Interface of Actin and Membrane Dynamics: A Focus on Its Roles in Endocytosis and Cell Polarization». International Journal of Cell Biology, 2012, 13-12-2011, pàg. 3,4,5.
- ↑ Law, AL; Ling, Q; Hajjar, KA; Futter, CE; Greenwood, J «Annexin A2 regulates phagocytosis of photoreceptor outer segments in the mouse retina». Mol Biol Cell, 9-2009, pàg. 2,3.
- ↑ Umbrecht-Jenck, E.; Demais, V.; Calco, V.; Bailly, Y. «S100A10-mediated translocation of annexin-A2 to SNARE proteins in adrenergic chromaffin cells undergoing exocytosis.». Traffic, 7-2010, pàg. 1.
- ↑ Valapala, M.; Vishwanatha, JK. «Lipid raft endocytosis and exosomal transport facilitate extracellular trafficking of annexin A2.». J Biol Chem., 9-2011, pàg. 1,2.
- ↑ Yamada, Akio; Irie, Kenji; Hirota, Takeshi «Involvement of the Annexin II-S100A10 Complex in the Formation of E-cadherin-based Adherens Junctions in Madin-Darby Canine Kidney Cells». The journal of biological chemistry, 11-2004, pàg. 5,6.
- ↑ Filipenko, Nolan R.; Macleod, Travis J.; Yoon, Chang-Soon; Waisman, David M. «Annexin A2 Is a Novel RNA-binding Protein». The Journal of biological chemistry, 2003, pàg. 10-13.
- ↑ Madureira, P.A.; Hill, R.; Miller, V.A.; Giacomantonio, C.; Lee, P.W. «Annexin A2 is a novel cellular redox regulatory protein involved in tumorigenesis». Oncotarget, 2011, pàg. 1075-1093. PMC: 3282068.
- ↑ Chuthapisith, S.; Bean, B.E.; Cowley, G.; Samphao, S.; Layfield, R. «Annexins in human breast cancer: Possible predictors of pathological response to neoadjuvant chemotherapy.». Eur. J. Cancer, 2009, pàg. 1274–1281. PMID: 19171478.
- ↑ Domoto T.; Miyama Y.; Suzuki H.; Teratani T.; Arai K. «Evaluation of S100A10, annexin II and B-FABP expression as markers for renal cell carcinoma». Cancer Sci, 2007, pàg. 77–82. PMID: 17083565.