Evaporació

L'evaporació és la vaporització progressiva d'un líquid, a una temperatura inferior a la d'ebullició, o sigui, es pot produir a qualsevol temperatura. És un tipus de canvi d'estat que fa que les molècules d'una substància en estat líquid, com podria ser l'aigua, esdevinguin gasoses, vapor d'aigua en l'exemple. De forma normal, les molècules en un vas d'aigua no tenen prou energia calorífica per escapar del líquid. Amb prou calor, el líquid es tornaria vapor ràpidament (Veure punt d'ebullició). Quan les molècules col·lideixen, transfereixen energia a cada altra molècula en diferent intensitat, basat en com col·lideixen. A vegades la transferència és tant en un sol sentit per a una molècula propera a la superfície que acaba tenint prou energia per escapar del líquid (evapora).
Quan hi ha un espai lliure damunt d'un líquid, una part de les seves molècules està en forma gasosa. En equilibrar-se, la quantitat de matèria gasosa es defineix com la pressió de vapor saturant, la qual no depèn del volum, però varia segons la naturalesa del líquid i la temperatura. Si la quantitat de gas és inferior a la pressió de vapor saturant, una part de les molècules passen de la fase líquida a la gasosa: això és l'evaporació. Quan la pressió de vapor iguala a l'atmosfèrica, es produeix l'ebullició.[1]
A hidrologia, l'evaporació és una de les variables hidrològiques importants al moment d'establir el balanç hídric d'una determinada conca hidrogràfica o part d'aquesta. En aquest cas, cal distingir entre l'evaporació des de superfícies lliures i l'evaporació des del terra. L'evaporació d'aigua és important i indispensable a la vida, ja que el vapor d'aigua, al condensar-se es transforma en núvols i torna en forma de pluja, neu, boira o rosada.
Vista com una operació unitària, l'evaporació és utilitzada per eliminar el vapor format per ebullició d'una solució o suspensió líquida.
Teoria
[modifica]Perquè les molècules d'un líquid s'evaporin, han de trobar-se a prop de la superfície, estar-se movent en la direcció adequada, i tenir la suficient energia cinètica per superar les forces intermoleculars de la fase liquida.[2] Quan poques molècules compleixen aquests requisits, la ràtio d'evaporació és petita. Com que l'energia cinètica d'una molècula és proporcional a la seva temperatura, l'evaporació és més ràpida a temperatures superiors. Quant més ràpidament s'escapen les molècules, les molècules restants tenen una energia cinètica mitjana inferior, i la temperatura del líquid decreix. Aquest fenomen s'anomena refredament evaporatiu. Per això el cos es refreda evaporant suor. L'evaporació tendeix també a ser més ràpida amb majors fluxos gasosos sobre la interfície líquid gas, i amb líquids amb una major pressió de vapor. Tres parts clau per evaporar són la calor, la pressió atmosfèrica (determina la humitat relativa) i el moviment de l'aire. A nivell molecular, no hi ha un lligament estricte entre l'estat líquid i l'estat vapor. En comptes d'això, hi ha la Capa de Knudsen, on la fase no està determinada. Perque aquesta capa només és d'unes poques molècules de gruix, a nivell macroscòpic es veu una clara interfase. Els líquids que no s'evaporen visiblement a una temperatura donada per a un gas donat (ex: l'oli de cuina a la temperatura de 25 °C) tenen molècules que no tendeixen a transferir energia a les altres seguint un patró.
Equilibri evaporatiu
[modifica]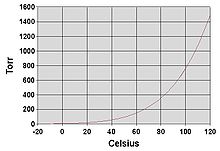
Si l'evaporació té lloc en una zona tancada les molècules que escapen s'acumulen com a vapor per sobre del líquid. Diversos d'aquestes molècules retornen al líquid, sent més freqüents els retorns com més alta és la densitat i la pressió del vapor. Quan el procés d'escapament i retorn arriba a un equilibri.[2] El vapor es diu que ha "saturat", i ja no varia la pressió de vapor ni la densitat. Per a un sistema que consisteix amb un vapor i un líquid purs, l'estat d'equilibri està directament relacionat amb la pressió de vapor de la substància com ens dona la relació de Clausius-Claperyon
On P1, P₂ són les pressions de vapor a les temperatures T1, T₂ respectivament. ΔHvap és l'entalpia de vaporització i R és la constant universal dels gasos. La ràtio d'evaporació per a un sistema obert està relacionat amb la pressió de vapor trobada en el sistema tancat. Si un líquid s'escalfa, quan la pressió de vapor assoleix la de l'ambient el líquid bullirà. L'habilitat per a una molècula d'un líquid per evaporar-se està basada majorment en l'energia cinètica que la partícula individual posseeix. Fins i tot a temperatures baixes, molècules individuals d'un líquid es poden evaporar si tenen més que el mínim d'energia cinètica necessària per a la vaporització
Descripció termodinàmica
[modifica]En el procés d'evaporar, l'entalpia de líquid sotmès a l'evaporació disminueix en una quantitat específica anomenada calor latent del líquid, un fet degut a la pèrdua d'energia cinètica. En els líquids purs (no en el cas de les solucions), aquesta transferència d'energia es produeix de manera isotèrmica, és a dir, sense variació de la temperatura.
A diferència del fenomen de l'ebullició, que es produeix a temperatures característiques per a cada tipus de substància, a una pressió fixa, i involucra tota la massa del líquid, l'evaporació es produeix a qualsevol temperatura, i només afecta la superfície del líquid.
El fenomen de l'evaporació segueix la llei de Dalton:
o en termes d'energia:
Per transformar l'equació en termes de pressió de vapor es pot utilitzar la llei de Boyle:
i, per tant:
- D = difusivitat del vapor d'aigua
- δ = gruix de la capa límit
- ρs = densitat del vapor d'aigua a la superfície evaporant
- ρr = densitat del vapor d'aigua a la interfície capa límit-atmosfera
- λ = calor latent de vaporització
- ψs = pressió de vapor a la superfície evaporant
- ψr = pressió de vapor a la interfície capa límit-atmosfera
- δ/D = Ra (resistència a la difusió)
- Rt = resistència addicional, tenint en compte que l'aigua no està directament en contacte amb l'atmosfera, però es troba dins dels teixits de les plantes
i, per tant:
Factors que influencien la ràtio d'evaporació
[modifica]Concentració de la substància que s'evapora a l'aire
Si l'aire ja té una alta concentració de la substància a evaporar, llavors la substància donada s'evaporarà més lentament.
Concentració d'altres substàncies al aire
Si l'aire ja està saturat amb altres substàncies, pot tenir una menor capacitat per evaporar la substància
El flux d'aire superficial
Si l'aire fred es mou sobre la substància constantment, llavors la concentració de la substància a just a sobre de la interfase té poca tendència a augmentar amb el temps, ja que l'aire desplaçarà les molècules de vapor de la interfase, afavorint l'evaporació a causa d'un augment del gradient de concentració de les molècules.
Forces intermoleculars
quan mes fortes siguin les forces que mantenen les molècules d'un líquid juntes, més energia caldrà per escapar. Això es caracteritza amb la entalpia de vaporització.
Pressió
L'evaporació és més ràpida si s'exerceix menys pressió a la superfície que mantingui a les molècules movent-se entre elles
Àrea superficial
Una substància que tingui una àrea superficial major s'evaporarà més ràpidament, ja que la superfície des de la qual les molècules es poden escapar és molt major.
Temperatura de la substància
Si la temperatura de la substància és superior, llavors les molècules tenen una energia cinètica mitjana superior, i s'evaporaran més ràpidament.
Densitat
Quan més gran es la densitat, més lentament un líquid s'evapora.
Influència de la llum solar ("efecte fotomolecular")
[modifica]El 2019, es va aconseguir produir aerogels extremadament aïllants tèrmicament i pràcticament invisibles (ja que deixen passar més del 95% de la llum solar), a partir de materials comuns, no contaminants i barats (sílex principalment).[3] En un simple col·lector solar tèrmic, un aerogel d'aquest tipus pot, sense lents ni miralls, assolir temperatures molt més altes que amb altres materials; a més, només és car l'assecador de punt crític necessari per fabricar l'aerogel, però essencial per extreure els dissolvents del gel preservant la seva estructura nanomètrica. Això facilita l'alimentació de processos industrials o el processament d'aliments que requereixin temperatures superiors a 200 °C; a la teulada d'un edifici del MIT,
| « | un dispositiu passiu consistent en un material fosc absorbent de calor coberta amb una capa del nou aerogel va ser capaç d'assolir i mantenir una temperatura de 220 °C, en ple hivern de Cambridge quan la temperatura exterior era inferior a 0 °C[3] | » |
. Els investigadors també han observat incidentalment que si l'aigua està continguda en un hidrogel i s'exposa a la llum verda o a la llum solar, s'evapora a una velocitat dues o tres vegades superior a la que és físicament possible sota el sol efecte de la calor (límit tèrmic).
| « | Encara que l'aigua en si no absorbeix gaire llum, com tampoc no ho fa l'hidrogel, quan tots dos es combinen es converteixen en potents absorbents, explica Chen. Això permet al material aprofitar eficaçment l'energia dels fotons solars i superar el límit tèrmic, sense necessitat de tints foscos per a l'absorció[4] | » |
.
Aquest fenomen també es podria produir en configuracions diferents de la de l'aigua atrapada en un hidrogel i podria contribuir a la formació i l'evolució de la boira i els núvols.[5] Aquest fenomen només s'observa a la interfície aire-aigua, on els fotons semblen ser capaços d'arrossegar feixos de molècules d'aigua fora de la superfície i cap a l'aire (a la superfície de l'hidrogel en els exemples anteriors, però un fenomen similar podria passar possiblement a la interfície mar-aire, a l'aerosol marí, o fins i tot a la superfície de les gotes d'aigua o microgotes als núvols o boira). Ja s'estan fent esforços per incorporar aquest paràmetre als models climàtics i a la investigació sobre dessalinització per energia solar; també podria millorar certs processos d'assecatge.[4]
Un prototip format per deu capes superposades d'evaporadors i condensadors solars plans, disposats en una matriu vertical i coberts amb aïllament d'aerogel transparent[6] va ser fabricat i provat a la Xina per investigadors del MIT i de la Universitat Jiao-tong de Xangai.[7] Aquest destil·lador solar multicapa recupera eficaçment l'energia de condensació, millorant considerablement l'eficiència global del dispositiu: així sembla possible augmentar fins a tres o quatre vegades la quantitat d'aigua produïda per un sistema passiu de dessalinització solar, que actualment és de 3,78541 l/h/m² de superfície de captació solar. El prototip, que és una mena de destil·lador multicapa pla, produïa 5,78 lof d'aigua/m²/h en presència de llum solar, és a dir, 1,5 litres d'aigua recuperada a 15 a 20 minuts, el que permet una dessalinització de baix cost capaç de produir aigua potable en zones àrides (aquí es va duplicar amb escreix el rècord anterior de dessalinització solar passiva).[6] Optimitzant el disseny del dispositiu i multiplicant el nombre de capes, es podria esperar eficiències del 700 al 800%; al voltant d'un metre quadrat podria llavors satisfer les necessitats d'aigua potable d'una persona, i els costos de construcció es podrien reduir a uns 100 $/m². A més, fent un ús assenyat del canvi de fase, aquest fenomen també podria permetre la refrigeració solar per evaporació.[6] Altres grups de recerca intenten reproduir o millorar aquests resultats, que al principi van ser rebuts amb escepticisme per ser tan contraintuïtius.
Usos industrials i al laboratori de química
[modifica]Vista com una operació unitària, l'evaporació és utilitzada per eliminar el vapor format per ebullició d'una solució o suspensió líquida per així obtenir una solució concentrada. Es pot fer per escalfament oa pressió reduïda.[1] En la gran majoria dels casos, l'evaporació vista com a operació unitària fa referència a l'eliminació d'aigua d'una solució aquosa.[8]
L'evaporació en buit és usada en la indústria alimentària per a la conservació d'aliments, i en altres indústries, per al recobriment de diversos materials.
Referències
[modifica]- ↑ 1,0 1,1 Operaciones Básicas: Evaporación, fundamento de la técnica, Universitat de Barcelona. (castellà)
- ↑ 2,0 2,1 Silberberg, Martin A. Chemistry. 4th edition. Nova York: McGraw-Hill, 2006, p. 431–434. ISBN 0-07-296439-1.
- ↑ 3,0 3,1 Chandler, David L. «Getting more heat out of sunlight» (en anglès). Massachussetts Institute of Technology, 02-07-2019. [Consulta: 1r setembre 2024].
- ↑ 4,0 4,1 Tu, Yaodong; Zhou, Jiawei; Lin, Shaoting; Alshrah, Mohammed; Zhao, Xuanhe «Plausible photomolecular effect leading to water evaporation exceeding the thermal limit» (en anglès). Proceedings of the National Academy of Sciences, 120, 45, 07-11-2023. DOI: 10.1073/pnas.2312751120. ISSN: 0027-8424. PMC: PMC10636307. PMID: 37903260.
- ↑ Tu, Yaodong; Zhou, Jiawei; Lin, Shaoting; Alshrah, Mohammed; Zhao, Xuanhe «Plausible photomolecular effect leading to water evaporation exceeding the thermal limit» (en anglès). Proceedings of the National Academy of Sciences, 120, 45, 07-11-2023. DOI: 10.1073/pnas.2312751120. ISSN: 0027-8424. PMC: PMC10636307. PMID: 37903260.
- ↑ 6,0 6,1 6,2 Chandler, David L. «Simple, solar-powered water desalination» (en anglès). Massachussetts Institute of Technology, 07-02-2020. [Consulta: 1r setembre 2024].
- ↑ Zhenyuan Xu, Lenan Zhang, Lin Zhao, Bangjun Li «Ultrahigh- desalación eficiente mediante un destilador solar multietapa térmicamente localizado». Energy & Environmental Science, vol. 13, 18-03-2020, pàg. 830-839. DOI: 10.1039/C9EE04122B. ISSN: 1754-5706.
- ↑ Operaciones básicas: Evaporación Arxivat 2012-08-17 a Wayback Machine., OpenCourseWare, Universitat de Sevilla.
Bibliografia
[modifica]- Sze, Simon Min. Semiconductor Devices: Physics and Technology. ISBN 0-471-33372-7. Has an especially detailed discussion of film deposition by evaporation.
Vegeu també
[modifica]Enllaços externs
[modifica]- (anglès) Evaporation Arxivat 2008-06-12 a Wayback Machine., Geotechnical, Rock and Water Resources Library.


![{\displaystyle E=-\left[D{\frac {\left(\rho _{s}-\rho _{r}\right)}{\delta }}\right]\qquad {\frac {\left[g\right]}{\left[cm^{2}\right]\left[min\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b75fbf89dab35e16bccff5699dc131fca9b48df)
![{\displaystyle E\lambda =-\lambda \left[D{\frac {\left(\rho _{s}-\rho _{r}\right)}{\delta }}\right]\qquad {\frac {\left[cal\right]}{\left[cm^{2}\right]\left[min\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22d787bd791b6a4b3b017a5a1d2408da9f23c813)

![{\displaystyle E\lambda =-\lambda \left[D{\frac {2,14\left(\psi _{s}-\psi _{r}\right)}{T}}\right]\delta }](https://wikimedia.org/api/rest_v1/media/math/render/svg/013a0e6d9bb3d82d91097b11721a4411ed8d4bda)
![{\displaystyle E\lambda =-\lambda {\frac {\left[2,14\left(\psi _{s}-\psi _{r}\right)\right]}{T}}R_{a}R_{t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf12442d60d80b17b56e975919c3b619ce60826)
