Fumonisina B1
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 721.83 |
| Trobat en el tàxon | |
| Rol | toxina i cancerigen |
| Estructura química | |
| Fórmula química | C₃₄H₅₉NO₁₅ |
 | |
| SMILES canònic | |
| SMILES isomèric | |
| Identificador InChI | Model 3D |
La fumonisina B1 és la variant més abundant dins de la família de les fumonisines. Es tracta d'un compost del metabolisme secundari dels fongs pertanyents al gènere Fusarium, com ara Fusarium verticillioides un patogen molt comú del panís. El nom prové d'un acrònim del nom científic del fong de qual es va aïllar per primera vegada el compost: Fusarium moniliforme.
Aquesta micotoxina és hepatotòxica i nefrotòxica en totes les espècies testades, inclosa l'espècie humana. El primer canvi histològic que apareix en el fetge o el ronyó dels animals tractats amb fumonisina és l'augment de l'apoptosi seguida de la proliferació cel·lular regenerativa. Si bé la toxicitat aguda de la fumonisina és baixa, és la causa coneguda de dues malalties que es produeixen en animals domèstics amb una aparició ràpida: càncer esofàgic en humans, edema pulmonar en porcs i leucoencefalomalàcia en cavalls. Totes aquestes malalties impliquen un metabolisme esfingolípid alterat i una disfunció cardiovascular.
Història
[modifica]En 1988, un grup d'investigadors sud-africans van aïllar i van purificar les fumonisines de cultius de Fusarium verticillioides quan buscaven l'agent causal de la leucoencefalomalàcia equina, que s'associava amb el consum de panís florit. Aquell mateix any es va dilucidar l'estructura química de les toxines i, des de llavors, s'han descrit més de 60 molècules relacionades estructuralment amb la fumonisina. No obstant això, només certes soques del fong produeixen moltes d'aquestes molècules i en condicions particulars de cultiu. Les fumonisines més abundants d'incidència natural són les del grup B, derivades de la majoria de les soques de F. verticillioides. Les fumonisines B contenen un esquelet lineal de 20 carbons, amb un grup amino en el C-2 i residus d'àcid tricarboxílic esterificats en C-14 i C-15. Aquests compostos difereixen per la presència o absència d'un grup hidroxil en els C-5 i C-10. Dins d'aquesta família predominen les fumonisines B1, B₂ i B₃, però la B1 (FB1) conforma més del 75% del total de les fumonisines; així mateix, és la més estudiada. Els nivells de producció de la toxina FB1 són molt variables entre les soques de F. verticillioides, ja que algunes d'aquests no la sintetitzen, o bé, ho fan a nivells molt baixos; en canvi, unes altres generen grans quantitats de la toxina. S'han trobat diverses soques aïllades en diferents regions geogràfiques, les quals presenten variacions de fins a tres ordres de magnitud en els nivells de FB1.[1]
Biosíntesi de les fumonisines
[modifica]La capacitat de sintetitzar fumonisines depén de la presència d'una sèrie de gens, agrupats en una regió de 46 kpb el cromosoma 1 de F. verticillioides i que formen el locus FUM. Els gens codifiquen els enzims involucrats en la síntesi de les micotoxines i d'altres proteïnes que medien la secreció i la resistència a aquestes.
L'anàlisi de la seqüència dels productes dels gens del locus FUM va permetre predir les funcions d'aquests últims. També va facilitar el disseny d'experiments per a comprovar aquestes funcions mitjançant l'anàlisi funcional i la generació de soques amb mutació en alguns dels gens.
Les fumonisines se sintetitzen a partir d'unitats d'acetat per a formar un policètid lineal dimetilat, que es condensa amb l'aminoàcid L-alanina, seguit de fins a cinc reaccions d'oxigenació i dues esterificacions. El primer pas és catalitzat per una policètic sintasa (PKS). Es tracta d'un enzim modular que té diversos dominis catalítics. Després una aminotranferasa que implica el grup amino de l'alanina al policètic de 18 carbonis, per mitjà de la condensació descarboxilativa. A continuació, ocorren oxidacions en les posicions C-14 i C-15. L'intermediari 3-ceto es redueix a un grup hidroxil per una reductasa.
Els productes d'uns quatre gens participen en l'esterificació dels àcids tricarboxílics. És probable que aquests últims provinguen de derivats de l'àcid cítric, com ara l'àcid aconític, però encara no s'ha demostra de manera concloent. En el locus també s'inclou un transportador del tipus ABC, que podria actuar en l'excreció de la toxina per a evitar la seua acumulació en la cèl·lula del fong, a més d'un cofactor de transcripció, regulador de l'expressió dels gens estructurals del locus.
En la natura sobreviuen soques de F. verticillioides incapaces de sintetitzar fumonisines perquè tenen una mutació en el gen de la policètic sintasa o, bé, manquen del locus FUM. També ocorren mutacions en altres gens del locus, com per exemple en aquells que codifiquen les oxigenases responsables de la hidroxilació en C-10 i C-5 de l'esquelet; l'anterior provoca que no produïsquen FB1 i, llavors, acumulen FB2 i FB3.[1]
Toxicocinètica
[modifica]Pel que fa a la toxicocinètica no hi ha dades humanes disponibles, però se'n saben sobre animals estudiats:
- L'absorció és baixa, normalment només arriba a sang el 5% de la dosi ingerida inicialment. La fracció absorbida és ràpidament distribuïda i eliminada.
- L'eliminació es produeix a través de l'orina i també de la femta. Existeix un cert percentatge (1,4% de la dosi), que entra en el cicle de circulació enterohepàtica, fent que es retarde l'eliminació total de l'organisme.[2]
Es van realitzar diferents experiments amb garrins deslletats per a estudiar l'efecte de la dosi i el temps d'exposició a FB1. Es van incorporar diferents concentracions de FB1 a la dieta i durant diferents períodes: a) 0, 10, 20 i 40 ppm durant 4 setmanes b) 0, 1, 5 i 10 ppm durant 8 setmanes c) 0, 1, 5, i 10 ppm durant 20 setmanes
Cap de les concentracions de la toxina i dels temps d'exposició va tenir cap efecte significatiu sobre el consum d'aliment, el creixement ni l'índex de conversió. Els paràmetres hematològics van estar dins del rang de valors límit. De 10 a 40 ppm de FB1 durant 4 setmanes va causar un edema pulmonar de suau a sever, mentre que dosis més baixes (1-10 ppm) durant 2-20 setmanes va causar fibrosi irreversible en el pulmó (detectat per l'examen macroscòpic i histopatologia). Com pareix demostrar-se, no sempre s'observen efectes evidents del consum de FB1 en els animals, la qual cosa pot tenir conseqüències a llarg termini sobre la salut de les persones si aquestes toxines arriben a acumular-se.[3]
Les proves indiquen que les micotoxines poden penetrar a la pell i a través de la pell, condueixen a la presa de consciència dels riscos per a la salut de les persones que estan exposades dèrmicament a les micotoxines. Tot i que per a la majoria de les micotoxines es va trobar que no presenten un risc general per a la salut en diversos escenaris de la vida real, es recomana sempre que siga possible, evitar o, almenys, limitar l'exposició dèrmica d'aquestes micotoxines, especialment quan hi ha persones en contacte amb solucions que contenen el cancerigen molt genotòxic FB1.[1]
Toxicodinàmica
[modifica]
Per la seua similitud, les fumonisines són capaces d'inhibir les esfingosina-esfinganina-transferases i les sintetases de ceramides i, per tant, són inhibidors competitius de la biosíntesi i del metabolisme dels esfingolípids.
La figura 2 mostra el metabolisme dels esfingolípids (esquemàtic) i la inhibició causada per les fumonisines. La fumonisina B1 inhibeix l'enzim ceramida sintasa (esfingosina N-aciltransferasa), que acila bases esfingues. Això bloqueja la formació de ceramida a través de dues vies. Inhibeix la formació mitjançant esfinganina de nou i acil-CoA grassa i per esfingosina produïda per la ruptura de ceramida per ceramidasa. La inhibició dona lloc a un augment de les concentracions d'esfinganina, esfingosina i els seus metabòlits 1-fosfat i a la disminució de les concentracions d'esfingolípids complexos. L'acumulació d'esfinganina i esfingosina és la causa principal de la toxicitat de la fumonisina B1.[4] L'espinganina i la esfingosina són citotòxiques i tenen efectes inhibidors del creixement. Així mateix, aquestes bases esfingues indueixen l'apoptosi. L'augment d'apoptosi pareix tenir un paper important en els efectes tòxics, inclosa la inducció del tumor.[5] Tot i això, cal esmentar que la reducció concentració de ceramida i la major concentració d'esfingosina-1-fosfat (com a resultat de la ingesta de FB1) provoquen una inhibició de l'apoptosi i promouen la mitosi i la regeneració.[4] L'equilibri entre la concentració intracel·lular de compostos que inhibeixen l'apoptosi i els que la indueixen determinarà la resposta cel·lular.[6] A més, sembla que la disminució de les concentracions d'esfingolípids complexos té un paper en el comportament anormal i la morfologia alterada de les cèl·lules afectades.[7]
Mecanisme d'acció
[modifica]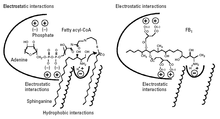
En la figura 3 observem el mecanisme d'acció proposat. La fumonisina B1 ocupa l'espai i les interaccions electroestàtiques tant de l'esfinganina (o esfingosina) com de l'acil-CoA en la ceramida sintasa. La part de FB1 que té similitud estructural amb les bases esfingues (la part aminopentol) pot interactuar amb el lloc d'unió de la esfinganina, mentre que els grups d'àcid tricarbílics carregats negativament poden interactuar amb el lloc d'unió de l'acil-CoA.[5]
Com que FB1 també ocupa l'espai de l'acil-CoA, no està acilat, ja que l'acil-CoA és necessari per a l'acilació; FB1 només inhibeix la ceramida sintasa. Tanmateix, quan els grups d'àcid tricarbílics s'eliminen de la FB1 per hidròlisi, el producte resultant (aminopentol, AP1) no només actua com a inhibidor, sinó també com a substrat de la ceramida sintasa; l'aminopentol és acilat per l'enzim ceramida sintasa per formar N-palmitoyl-AP1. Això dona suport al pensament que l'aminopentol de la FB1 ocupa l'espai d'esfinganina de l'enzim. N-palmitoyl-AP1 és un inhibidor encara més potent de la ceramida sintasa i pot tenir un paper en la toxicitat de fumonisines nixtamalitzades.[4]
Toxicitat
[modifica]Estudis in vivo sobre la toxicitat de la FB1 indiquen que el fetge i els ronyons són els principals òrgans objectiu. Es coneix que les fumonisines estan mal absorbides, s'eliminen ràpidament mitjançant un model de dos o tres compartiments i no es metabolitzen en animals. En rates i porcs, la FB1 està àmpliament distribuïda, però s'han trobat xicotetes quantitats que només s'acumulen en el fetge i els ronyons. S'ha trobat a l'intestí de mones verdes que algunes de les molècules de FB1 acumulades estaven parcialment hidrolitzades.[5]
Toxicitat en humans
[modifica]Els productes d'origen animal no contribueixen significativament a l'exposició humana a les fumonisines. Les intoxicacions per fumonisines en les persones es produeix fonamentalment a través del consum de panís.[2]
Defectes del tub neural
[modifica]En un estudi es van prendre 184 dones amb embarassos afectats amb defectes del tub neural (DTN) i a 225 dones del grup control. Es van dur a terme entrevistes sobre els seus hàbits alimentaris, ambient i posició socioeconòmica. Durant els primers tres mesos d'embaràs es van prendre mostres de "tortillas" (pa de panís) que elles elaboraven a casa. L'exposició postpart a les fumonisines es va realitzar mitjançant l'estimació de la relació esfinganina-esfingosina (Sa/So) en sèrum sanguini. Els resultats van mostrar una elevada relació Sa/So la qual cosa suggereix que l'exposició a fumonisines incrementa el risc de desenvolupar DTN. Nivells mitjans de fumonisines a les tortillas de panís no processat eren de 234 ppm processat (rang entre 0 i 1690). La raó per a demostrar que la fumonisina augmenta el risc de contraure DTN rau en el fet que aquesta micotoxina actua com a possible inhibidor del transport del folat. Dos sistemes o mecanismes diversos s'utilitzen per al transport del folat en les cèl·lules. El primer sistema utilitza una alta capacitat transportadora coneguda com a portador de folat. El segon implica una proteïna d'ancoratge del glicosilfosfatidilinositol (GPI) designada com el receptor del folat. Aquest receptor d'alta afinitat és responsable del transport del folat en les cèl·lules de la placenta, del renyó, de l'estèrnum i d'altres teixits que requereixen d'elevats nivells d'aquesta vitamina. Un acoblament potencial entre fumonisines i deficiència de folat fa que augmente el risc de DTN. En la placenta, el transportador de folat d'alta afinitat és el GPI, la qual és una proteïna d'ancoratge associada a la membrana basal i la qual és enriquida amb el colesterol i els esfingolípids. Les fumonisines, afecten el transportador alterant el seu trànsit endocític, així com la quantitat del receptor que està disponible per al transport.[8]
Aquests resultats proporcionen un marc conceptual pel qual l'exposició a les fumonisines pogueren ser un risc per a l'aparició de DTN per la interrupció de la via del folat a causa de l'esgotament dels esfingolípids, els quals són necessaris per a la funció normal del receptor.[9]
Càncer d'esòfag
[modifica]Estudis epidemiològics en diversos països de diverses regions del món han revelat que la incidència del càncer d'esòfag humà i l'aparició de F. verticillioides pareix ser que estan correlacionades. Així, la incidència del càncer d'esòfag s'ha associat a un estat socioeconòmic baix i a dietes menys variades, que consisteixen principalment en panís o blat. Estudis comparatius realitzats en algunes parts de Sud-àfrica i la Xina demostren que els nivells significativament més elevats de F. verticillioides, així com concentracions tant de FB1 com de FB2, es produeixen en el cultiu de panís en zones amb alta incidència de càncer d'esòfag en comparació amb el panís cultivat en zones de baix risc. A més, sembla que hi ha més risc de desenvolupar càncer d'esòfag per les persones amb una ingesta elevada de panís que les que presenten un aport baix d'aquest cereal. Tendències similars també es van observar en estudis realitzats amb poblacions que viuen en zones amb alta incidència de càncer d'esòfag a l'Iran, Itàlia, Kenya, Zimbabwe, Estats Units i Brasil. Tot i això, un estudi prospectiu sobre la relació entre els nivells d'esfingolípids i la incidència del càncer no va mostrar cap associació significativa entre esfingolípids sèrics i el risc de càncer d'esòfag, tot i que es creu que els nivells d'esfingolípids elevats funcionen com a biomarcadors per a l'exposició a la FB1.[10]
Micotoxicosi aguda
[modifica]El consum humà de sorgo i panís danyat per les pluges a 27 pobles de l'altiplà de Deccan a l'Índia al 1995 va donar lloc a un brot de malaltia transmés pels aliments caracteritzat per dolor abdominal i diarrea. En una enquesta epidemiològica, la micotoxicosi va estar relacionada amb el consum de pa sense llevat. Es va observar que les mostres de panís i sorgo de les llars afectades eren contaminades per fongs dels gèneres Fusarium i Aspergillus, i contenien quantitats elevades de FB1 en comparació amb les mostres recollides de les llars no afectades.[8]
Toxicitat en animals
[modifica]Al llarg de temps i moltes investigacions s'ha vist que poden patir intoxicacions conills, pollastres, cavalls, porcs, remugants, etc. dels quals destaquem:[2]
Leucoencefalomalàcia equina
[modifica]La leucoencefalomalàcia equina és una malaltia neurotòxica dels cavalls. Es caracteritza per lesions necroses liquefactives predominantment en la substància blanca, però també fins a cert punt en la substància grisa, del cervell. La leucoencefalomalàcia és una malaltia fatal, que aparentment només apareix en cavalls. Durant el segle xx, es van produir brots d'aquesta malaltia de manera esporàdica en diversos països. Diversos estudis van demostrar que la FB1 era l'agent causant d'aquesta malaltia.[8] En els animals afectats s'observa: anorèxia, depressió, ceguesa, histèria, pèrdua de l'equilibri, paràlisi glosofaríngea i dels llavis, atàxia, torneig, hiperestèsia, estupor i convulsions.[2]
Edema pulmonar porcí
[modifica]L'edema pulmonar induït per la micotoxina en porcs es va documentar per primera vegada el 1981, després de la seua exposició al panís contaminat per F. verticillioides. L'any 1989 als Estats Units, milers de porcs van morir per edema pulmonar després de la ingesta de panís contaminat amb FB1. Arran d'açò, la malaltia es va anomenar edema pulmonar porcí.[8] En els animals afectats s'observa: anorèxia, disminució del pes, signes d'encefalopatia, hiperplàsia hepàtica nodular, necrosi hepàtica, colèstasi, alteracions dels paràmetres bioquímics hepàtics (transaminases, colesterol, fosfatasa alcalina, etc.)[2]
Toxicitat en animals de laboratori
[modifica]L'alimentació de rates amb FB1 fins a 90 dies, o donar FB1 intraperitonealment durant 4-11 dies, generalment ha donat lloc a nefrotoxicitat. Normalment les rates mascles pareixen ser més sensibles que les femelles, però també es poden detectar diferències de sensibilitat entre diferents soques de rates. El principal símptoma en el ronyó és l'apoptosi, que inicialment es pot observar als túbuls de la medul·la exterior. A més, també s'ha notificat atrofia i regeneració tubular, així com disminució del pes dels ronyons. Els efectes histològics i cel·lulars van anar acompanyats de canvis en l'osmolalitat de l'orina i els nivells d'enzims d'orina. En comparació amb les rates, els ratolins no semblen massa sensibles als efectes nefrotòxics induïts per la FB1. A dosis elevades, s'han observat lleugers canvis histològics en els ronyons del ratolí.
Alguns grups de recerca han reportat efectes histopatològics en el fetge de les rates sotmeses a tractaments de curt i llarg termini amb FB1. El descobriment inicial ha estat l'apoptosi, caracteritzada per petits hepatòcits eosinòfils arrodonits, però també s'han observat hepatòcits necròtics. També reducció del pes hepàtic, l'alanina aminotransferasa sèrica elevada i la vacuolació citoplasmàtica del còrtex suprarenal són signes típics d'hepatotoxicitat. En general, les rates femelles pareixen ser més sensibles que els mascles. També en els ratolins, el fetge és un dels principals òrgans objectiu de la toxicitat induïda per FB1. Les femelles són més sensibles que els mascles, i la patologia era similar a la observada en les rates. Els principals resultats han estat l'apoptosi i la hiperplàsia hepatocel·lular.
Els efectes de la FB1 sobre la reproducció, estudiats en rates i ous de pollastre, indiquen que la FB1 no és teratògena, però possiblement és embriòxic a dosis tòxiques maternals. S'ha avaluat la possible genotoxicitat de FB1 en diversos estudis, cap d'aquests ha indicat efectes mutagènics. Tot i això, la FB1 pot ser capaç de danyar l'ADN de manera indirecta augmentant l'estrés oxidatiu. D'acord amb les troballes en humans, s'ha demostrat que la ingesta d'àcid fòlic es va inhibir dramàticament després de l'exposició a la FB1. L'exposició d'embrions de ratolins a FB1 va inhibir la síntesi i el creixement d'esfingolípids i va provocar la DTN (Defectes del Tub Neural. NTD, sigles en anglès). El cotractament amb àcid fòlic va reduir la DTN en els embrions de ratolins en un 65% en experiments a llarg termini i en quasi un 50% en experiments a curt termini.[8]
Ingesta diària tolerable
[modifica]El risc internacional de la fumonisina B1 ha estat avaluat pel Programa Internacional de Seguretat Química de l'Organització Mundial de la Salut (IPCS) i el Comitè Científic d'Aliments (SCF) de la Comissió Europea. Es va determinar una ingesta diària tolerable (TDI) per a FB1, FB2, FB3, en solitari o en combinació de 2 µg/kg de pes corporal.[5]
Desintoxicació
[modifica]Es creu que la inhibició de la ceramida sintasa per FB1 és reversible, ja que la unió està formada per interaccions no covalents. Factors que probablement induiran aquesta reversibilitat són la reducció de la concentració cel·lular de FB1 i l'augment de les concentracions cel·lulars dels substrats de ceramida sintasa: acetil-CoA i esfinganina.(MERILL) Així mateix, la taxa d'eliminació de l'esfinganina i la esfingosina acumulades afectarà la desintoxicació. La informació sobre el metabolisme i la biotransformació de la FB1 és molt escassa. Tanmateix, el metabolisme es produeix molt probablement a l'intestí ja que es van recuperar FB1 parcialment hidrolitzades i completament hidrolitzades a les femtes, però no a la bilis de mones verdes.[5] La biodisponibilitat de FB1 es pot reduir si es tracta el panís contaminat per fumonisina amb glucomannans extrets de la paret cel·lular del llevat Saccharomyces cerevisiae. Aquests polisacàrids són capaços d'unir certes micotoxines i presenten una capacitat d'unió del 67% amb les fumonisines.[11]
Referències
[modifica]- ↑ 1,0 1,1 1,2 de la Torre-Hernández, María Eugenia (en castellà) Fumonisinas: Síntesis y función en la interacción Fusarium verticillioides-Maíz, 2014, pàg. 17(1), 77–91. DOI: 10.1016/s1405-888x(14)70321-3.
- ↑ 2,0 2,1 2,2 2,3 2,4 https://alimentacion-animal.elika.eus/wp-content/uploads/sites/6/2017/12/FUMONISINAS-2012-maquetado.pdf
- ↑ https://www.3tres3.com/abstracts/efecto-del-tiempo-y-dosis-de-administracion-de-fumonisina-b1-en-cerdos_6316/
- ↑ 4,0 4,1 4,2 4,3 4,4 Merrill, A. (en anglès) Sphingolipid Metabolism: Roles in Signal Transduction and Disruption by Fumonisins, 2001, pàg. 109, 283. DOI: 10.2307/3435020.
- ↑ 5,0 5,1 5,2 5,3 5,4 https://ec.europa.eu/info/departments/health-and-food-safety_en
- ↑ Riley, R. (en anglès) Sphingolipid Perturbations as Mechanisms for Fumonisin Carcinogenesis, 2001, pàg. 109, 301. DOI: 10.2307/3435022.
- ↑ Riley, R. T. (en anglès) Differential Sensitivity of Rat Kidney and Liver to Fumonisin Toxicity: Organ-Specific Differences in Toxin Accumulation and Sphingoid Base Metabolism, 2006, pàg. 335–345. DOI: 10.1093/toxsci/kfj198.
- ↑ 8,0 8,1 8,2 8,3 8,4 Stockmann-Juvala, H. (en anglès) A review of the toxic effects and mechanisms of action of fumonisin B1, 2008, pàg. 799–809. DOI: 10.1177/0960327108099525.
- ↑ https://www.tribunadelinvestigador.com/ediciones/2009/1-2/art-6/
- ↑ https://books.google.cat/books?id=15uD7bddmCAC&lpg=PA98&ots=1m1fb2gCF-&dq=Scientific%20Committee%20on%20Food.%20(2000b).%20Opinion%20on%20Fusarium%20Toxins&hl=ca&pg=PA109#v=onepage&q=Fumonisin%20&f=false
- ↑ Yiannikouris, A. (en anglès) Mycotoxins in feeds and their fate in animals: a review, 2002, pàg. 81–99. DOI: 10.1051/animres:2002012.
