Hexan-1,6-diamina
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 116,131 Da |
| Estructura química | |
| Fórmula química | C₆H₁₆N₂ |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 0,84 g/cm³ |
| Punt de fusió | 42 °C 41 °C 41,5 °C |
| Punt d'ebullició | 205 °C (a 101,325 kPa) |
| Perill | |
| Punt d'inflamabilitat | 93 °C |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
L'hexan-1,6-diamina (hexametilendiamina, 1,6-diaminohexà) és un compost orgànic de la classe de les amines. Està constituït per una cadena de sis carbonis i té dos grups funcionals anomenats amines, situats als carbonis 1 i 6. Aquests grups estan formats per un nitrogen, i units a aquest, dos hidrògens. La seva fórmula molecular és .
Història[modifica]
L'hexan-1,6-diamina va ser aïllada pel metge xilè Adeodato García Valenzuela, que estudiava fisiologia i formava part d'un equip que treballava al laboratori del pare de la bioquímica, el Dr. Felix Hoppe-Seyler el 1894 a la Universitat d'Estrasburg, llavors part de l'Imperi alemany. Es va aïllar en la descomposició del teixit orgànic, en el grup de les ptomaïnes, i va ser coneguda com "substància de García".[1]
Propietats[modifica]
Aquest compost es presenta en forma de líquid transparent i sense color. Es pot arribar a cremar, encara que consta d'esforç perquè s'encengui i és soluble en aigua, i lleugerament soluble en benzè, etanol i èter.[2] L'hexan-1,6-diamina té una massa molar de 116,20 g/mol. La seva densitat varia segons l'estat en què es troba, el compost sòlid té una densitat de 0,84 g/cm3, mentre que en estat gasós quadruplica la densitat de l'aire. El seu punt de fusió es troba als 41 °C, i el punt d'ebullició als 204 °C.[3] Aquest compost s'arriba a descompondre quan arriba als 255 °C. És incompatible amb agents oxidants forts, àcids forts i materials orgànics.[4][2][5]
Preparació[modifica]
L'hexan-1,6-diamina es produeix en indústries mitjançant dos processos diferents, encara que hi ha més alternatives. El primer procés la hidrogenació es du a terme amb àcid adípic amb amoníac, per així obtenir adiponitril.[6] Aquest està a una alta pressió d'uns 250 bar. Els catalitzadors que s'usen estan fets de cobalt i ferro. El rendiment d'aquest procés és bo, però es generen productes secundaris, aquests inclouen 1,2-diaminociclohexà, hexametilenamina i hexametilendiamina.
Un procés alternatiu usa níquel Raney com a catalitzador i adiponitril diluït amb la pròpia hexan-1,6-diamina (on és el dissolvent). En aquest cas no s'usa amoníac i opera a una temperatura de 75 °C i una pressió de 20 bars.[7]
En el segon procés la hidrogenació es realitza a una pressió aproximada de 40 bars. En aquest cas, l'amina se sintetitza per cloració del butadiè, seguida d'una reacció amb cianur de sodi (amb clorur de coure(I) com a catalitzador), que dona lloc a 1,4-dicianobutilè.[2]
En el laboratori es pot sintetitzar a partir del furfural, en la qual el furfural es descarboxila per contacte amb . Una vegada obtengut el furfural, amb l'acció del HCl es pot aconseguir una divisió de l'èter (gràcies al seu caràcter alcadiens). Posteriorment d'una conversió addicional amb cianat de sodi i finalment hidrogenació, també es pot obtenir hexan-1,6-diamina.[8]
Una altra manera de sintetitzar-la és fent reaccionar hexan-1,6-diol amb amoníac. La reacció es du a terme en fase líquida o supercrítica a una temperatura de 140 °C, sent així catalitzada per un complex homogeni que conté ruteni.[9]
Anualment es produeix al voltant d'un milió de tones d'aquest compost.
Usos[modifica]
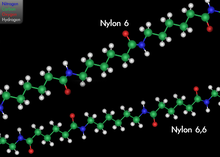
L'hexan-1,6-diamina s'usa quasi exclusivament per la producció de polímers, com pot ser el niló 6,6; ja que s'aprofita la seva estructura. Aquest plàstic es forma com a producte de la condensació d'àcid adípic i hexan-1,6-diamina amb l'eliminació d'aigua. L'etapa intermèdia monomètrica també és anomenada sal AH, degut a les primeres lletres dels components.
Aquesta amina és disfuncional en termes de grups amines i tetrafuncional respecte als hidrògens de l'amina. En cas contrari, es genera dissociat d'hexametilè (HDI) a partir d'aquesta diamina a través de fosfatació com a matèria primera de monòmer en la producció del poliuretà.

A través d'estudis sistemàtics sobre la reacció de la lactosa/lactulosa amb amines, s'ha descobert que l'hexan-1,6-diamina sintetitza un tint vermell molt similar al que produeixen les reaccions de Wöhlk i la prova de Fearon amb solució alcalina, amb un pH 13.[10] Aquesta reacció amb solució d'hexan-1,6-diamina 0,025 molar a una temperatura de 60 °C té un rendiment millor en l'avaluació de riscs que el procés comparable amb amoníac i metilamina. Aquest procediment es pot usar com a reacció de detecció semiquantitativa per a disacàrids amb enllaços 1,4; com poden ser la lactosa, maltosa, cel·lobiosa, lactulosa, etc. S'exclouen els monosacàrids reductors i sucres no reductors (sacarosa).[11]
L'hexan-1,6-diamina s'usa per revestiments, com poden ser lubricants i productes pel tractament d'aigües.[12] I, com totes les diamines primàries, és bivalent en poliamidificacions i tetravalent quan actua com a catalitzador amb resines diepoxídiques.[13]
Aquest compost també s'empra com a precursor de l'azepà, mitjançant una reacció, que té lloc entre els 80 i 150 °C, a 30 mmHg de pressió i usant com a catalitzador níquel o cobalt.[14] Altres materials es poden obtenir a partir de la síntesi d'aquesta diamina, com poden ser la mucoanamida o l'hexan-2t,4t-dienodiamida; nitrils, com poden ser l'hexan-2t,4t-dienodinitril o 3-pentenonitril.[15]
Per últim, aquesta diamina s'ha ofert el seu ús en composicions d'agents antibacterians, els quals destrueixen biopel·lícules, i també que contribueixen al fet que les cèl·lules bacterianes desenvolupin resistència als antibiòtics.[16]
Toxicitat[modifica]
L'hexan-1,6-diamina és moderadament tòxica, no obstant això, igual que altres amines bàsiques, pot causar cremades greus i irritacions severes. Si aquest compost s'inhala, pot causar tossina, dificultat respiratòria i mal a la gola. En cas de contacte amb la pell i ulls pot produir ampolles.[2]
En el cas de riscs mediambientals, aquesta diamina existeix com un catió 2+. A causa del seu baix valor del coeficient de partició del carboni orgànic (Koc = 286),[4] aquesta substància és considerada molt mòbil en sols i la seva elevada solubilitat en aigua suggereix que en la gran majoria es trobarà en fase aquosa. L'hexan-1,6-diamina presenta una toxicitat baixa en peixos d'aigua dolça i només una toxicitat més alta pel microcrustaci Daphnia magna i per espècies d'algues Selenastrum capricornutum.[17]
Referències[modifica]
- ↑ Sapag-Hagar, Mario «La Universidad de Chile crea la Carrera de Bioquímica». Anales de la Universidad de Chile, 0, 12, 07-09-2010. DOI: 10.5354/0365-7779.2000.2523. ISSN: 0365-7779.
- ↑ 2,0 2,1 2,2 2,3 PubChem. «1,6-Hexanediamine» (en anglès). [Consulta: 13 gener 2023].
- ↑ «1,6-hexanodiamina». [Consulta: 13 gener 2023].
- ↑ 4,0 4,1 «1,6-HEXANEDIAMINE | C6H16N2 | ChemSpider». [Consulta: 13 gener 2023].
- ↑ «Hexamethylenediamine | 124-09-4» (en anglès). [Consulta: 13 gener 2023].
- ↑ «Sharing insights elevates their impact». [Consulta: 13 gener 2023].
- ↑ LEFEBVRE, Gilles; CHAUVEL, Alain «Hexaméthylènediamine». Opérations unitaires. Génie de la réaction chimique, 1991-09. DOI: 10.51257/a-v1-j6020-j1563.
- ↑ Sanchez Fernandez, Elena Matilde «Nuevas estrategias en el proceso de enseñanza-aprendizaje de la asignatura experimentación química ii del grado en ingeniería química industrial.». JORNADAS DE FORMACIÓN E INNOVACIÓN DOCENTE DEL PROFESORADO, 1, 2018, pàg. 766–783. DOI: 10.12795/jdu.2018.i01.43. ISSN: 2659-5117.
- ↑ Walther, Guido; Deutsch, Jens; Martin, Andreas; Baumann, Franz-Erich; Fridag, Dirk «α,ω-Functionalized C19 Monomers». ChemSusChem, 4, 8, 07-06-2011, pàg. 1052–1054. DOI: 10.1002/cssc.201100187. ISSN: 1864-5631.
- ↑ Paz Olivas, Youmi. Síntomas de intolerancia a la lactosa en consumidores de leche deslactosada comparada con la leche sin lactosa del hospital Hipólito Unanue del 2015 (tesi). Universidad San Ignacio de Loyola S.A..
- ↑ Martínez Florido, Elizabeth. La enseñanza de la formulación y nomenclatura química en 4º de ESO. Problemática y propuesta didáctica (tesi). Editorial de la Universidad de Granada.
- ↑ «Alfa Aesar catalogue». Materials Today, 14, 1-2, 2011-01, pàg. 50. DOI: 10.1016/s1369-7021(11)70028-1. ISSN: 1369-7021.
- ↑ MOLLARD, Georges «Polyamide 6-6». Opérations unitaires. Génie de la réaction chimique, 1997-06. DOI: 10.51257/a-v1-j6515.
- ↑ «Hexamethyleneimine». U.S. Pharmacopeial Convention. [Consulta: 13 gener 2023].
- ↑ «hexane-1,6-diamine (124-09-4) Precursors-Molbase». [Consulta: 13 gener 2023].
- ↑ «Immunocontraceptive compositions containing sperm antigens, and methods of use (JD Bleil et al, US)». Biofutur, 1998, 178, 1998-05, pàg. 46. DOI: 10.1016/s0294-3506(98)80097-5. ISSN: 0294-3506.
- ↑ De San Luis, Revista de El Colegio «Primera época - Año X, Número 28, enero-junio de 2008». Revista de El Colegio de San Luis, 28, 08-11-2018. DOI: 10.21696/rcsl102820081086. ISSN: 2007-8846.



