Hormona estimulant dels melanòcits
L'hormona estimulant dels melanòcits (MSH), o també hormona estimulant dels melanòfors, és una hormona de la família de les melanocortines. Va ser aïllada per primera vegada el 1954 per l'equip d'Aaron B. Lerner. L'article es va publicar a l'Associació Mèdica Nord-americana.[1]
La seva síntesi es produeix a partir de les propioomelanocortines. D'aquest precursor se'n deriven tres tipus diferents de MSH: la α-MSH, la β-MSH i la γ-MSH.
La MSH és sintetitzada principalment a l'hipotàlem. Tot i això, també s'ha identificat la seva producció en altres localitzacions com els melanòcits de la pell. La seva funció principal és l'estimulació dels melanòcits per tal que produeixin melanina i així oferir protecció a la llum ultraviolada. Generalment en aquest procés la radiació ultraviolada és l'estímul que indueix el nostre organisme a produir la MSH. Tot i això, també es troba involucrada en altres funcions, en les quals és activada per estímuls diferents.
La MSH pot tenir aplicacions clíniques diverses com el diagnòstic de melanoma, tractaments dermatològics o potenciador del desig sexual femení.
Tipus i estructura
[modifica]Hi ha tres tipus d'hormona estimulant dels melanòcits. La α-MSH, la β-MSH i la γ-MSH. Es distingeixen entre elles per la seva unió preferent a diferents receptors de melanocortina (MCR), a través dels quals exerceixen els seus efectes, i per la seva estructura, ja que s'origina cadascuna des d'una regió diferent de POMC. El pèptid α-MSH es deriva de la regió mitjana de POMC, la β-MSH es deriva de l'extrem C-terminal (l'extrem que conté un grup carboxil) i el γ-MSH del N-terminal (l'extrem que conté un grup amino). Es creu que les diferents seqüències d’aminoàcids dels pèptids MSH expliquen la seva capacitat per activar un tipus de MCR o un altre.[2]
L'α-MSH, la més important, és un pèptid de tretze aminoàcids. L'α-MSH estimula la síntesi i distribució de melanina en els melanòcits, dels mamífers, i, en els melanòfors, de les anamniotes. D'aquesta manera, en els mamífers, a través de la sang arriba als melanòcits que sintetitzen i segreguen la melanina, causant de la coloració de la pell. És produïda al glòbul intermedi de la hipòfisi i a l'hipotàlem.[3][4][2]
La β-MSH és un pèptid de vint-i-dos aminoàcids. És produïda al glòbul intermedi de la hipòfisi i a l'hipotàlem.[4][2]
La γ-MSH és un pèptid d'onze aminoàcids. És produïda al glòbul intermedi de la hipòfisi i a l'hipotàlem.[4][2]
| Tipus | Seqüència d’aminoàcids | Nom IUAPC | Fórmula molecular | Massa Molar |
|---|---|---|---|---|
| α-MSH[5] | Ac-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH₂ | N-acetil-L-seril-L-tirosil-L-seril-L-metionil-L-alfa-glutamil-L-histidil-L-fenilalanil-L-arginil-L-triptofil-glicil-L-lisil-L- prolil-L-valinamida | C77H109N21O19S | 1664,884 g/mol |
| β-MSH[6] | H-Ala-Glu-Lys-Lys-Asp-Glu-Gly-Pro-Tyr-Arg-Met-Glu-His-Phe-Arg-Trp-Gly-Ser-Pro-Pro-Lys-Asp-OH | DL-alanil-DL-alfa-glutamil-DL-lisil-DL-lisil-DL-alfa-aspartil-DL-alfa-glutamil-glicil-DL-prolil-DL-tirosil-DL-arginil-DL-metionil-DL- àcid alfa-glutamil-DL-histidil-DL-fenilalanil-DL-arginil-DL-triptofil-glicil-DL-seril-DL-prolil-DL-prolil-DL-lisil-DL-aspàrtic | C118H174N34O35S | 2660,91596 g/mol |
| γ-MSH[7] | H-Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe-Gly-OH | DL-tirosil-DL-valil-DL-metionil-glicil-DL-histidil-DL-fenilalanil-DL-arginil-DL-triptofil-DL-alfa-aspartil-DL-arginil-DL-fenilalanil-glicina | C74H99N21O16S | 1570,77396 g/mol |
| Estructura 2D (α-MSH)[5] | Estructura 2D (β-MSH)[6] | Estructura 2D (ɣ-MSH)[7] |
|---|---|---|
 |
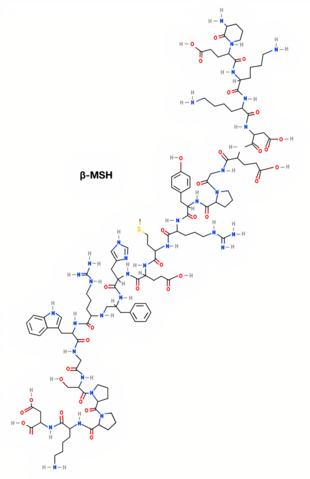 |
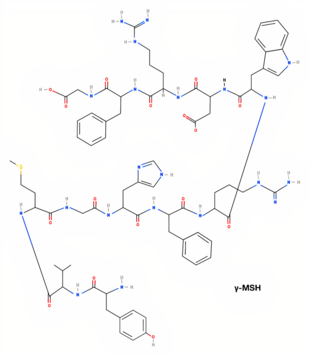 |
Biosíntesi
[modifica]On se sintetitza
[modifica]
El precursor de la MSH, la POMC, es troba en la hipòfisi, l’hipotàlem, el sistema nerviós central, la placenta i la pell. El POMC és sotmès a un extens processament post-traduccional en què s'eliminen seqüències d'aminoàcids irrellevants. D'aquesta manera, el seu trencament difereix segons el tipus de teixit i genera, en cada cas, diferents tipus de pèptids implicats en diverses funcions biològiques, entre ells l'hormona estimulant dels melanòcits (MSH).[9][4]
La POMC és sintetitzada per: cèl·lules corticòtropes de l'adenohipòfisi, cèl·lules melanotropes del lòbul intermedi de la hipòfisi, a prop de 3000 neurones en el nucli arcuat de l'hipotàlem, les poblacions més petites de les neurones en l'hipotàlem dorsomedial i el tronc cerebral i, finalment, els melanòcits a la pell. Cada teixit aprofita segments de tall del POMC per originar diferents pèptids. Així, la regulació de la seva expressió és específica de cèl·lules i teixits. Concretament la α-MSH se sintetitza a la glàndula pituïtària en el glòbul intermedi i l’hipotàlem. L'ACTH (producte de la POMC) també és sintetitzada a la hipòfisi però per un altre tipus de cèl·lula.[4]
Cèl·lules de la pell on és manifestada la α-MSH: queratinòcits, melanòcits, monòcits de cèl·lules Langerhans, macròfags, cèl·lules endotelials, fibroblasts i mastòcits.[8]
Procediment
[modifica]La síntesi de pèptids derivats de POMC comença amb el procés de traducció de l'ARNm en un polipèptid precursor inactiu, seguit de proteòlisi post-traduccional per alliberar diferents productes. En el cas de POMC, s'aconsegueix mitjançant l'acció de diferents convertases prohormona (PC). Un cop codificada a partir de l'ARNm, la POMC segueix el trànsit intracel·lular d'una proteïna secretada a través del complex de Golgi, i finalment arriba als grànuls secretors on s'emmagatzemen els productes finals abans de ser secretats per exocitosi o aprofitats per la cèl·lula. Durant aquest procediment, POMC es processa proteolíticament en una sèrie de pèptids fisiològicament diferents, que inclouen α-MSH, β-MSH i γ-MSH entre altres.[9][4]
El processament post-traduccional hipotalàmic de la POMC consta de 3 exons dels quals es dona la traducció de l'exó 2 i 3. Les convertases prohormones PC 1 / 2 / 3 trenquen la POMC original en pèptids successius mitjançant l'escissió d'aminoàcids dibàsics emparellats (carregats positivament) que consisteixen en lisina (K) i / o arginina (R). És a dir poden fer talls: lys-arg, lys-lys, arg-lys o arg-arg. Depenent del teixit, la proteòlisi de la POMC s’atura en un pas o un altre aconseguint diferents concentracions dels productes del precursor segons el tipus de cèl·lula i teixit.[11][4][12]

Un cop transcrits els exons de l’ADN per donar lloc a l’ARNm es dona la traducció i s’obté la prePOMC, per l’acció de PC 1 / 3 es forma la Proopiomelanocortina (POMC) que podrà seguir tres vies proteolítiques diferents per arribar a formar α-MSH, β-MSH o ɣ-MSH. Així, la POMC inicial és trencada per P1 per obtenir N-POMC (Pro-ɣ-MSH), corticotropina (ACTH) i β-lipotropina (LPH).
En la síntesi de la γ-MSH, sobre el segment N-POMC (Pro-ɣ-MSH) actua la PC 2 obtenint N-POMC i JP. Addicionalment, gràcies a l’acció de PC 2 es forma l'hormona estimulant dels melanòcits gamma (ɣ-MSH).
En la síntesi de la β-MSH, sobre el segment β-lipotropina (LPH) actua la PC 2 per obtenir ɣ-lipotropina i β-endorfina. La PC 2 trenca la ɣ-lipotropina arribant així a l'hormona estimulant dels melanòcits beta (β-MSH).
En la síntesi de la α-MSH la POMC és escindida inicialment per PC1 per generar corticotropina (ACTH). L'ACTH s'escindeix encara més per generar ACTH (1-17) i CLIP. Després, l'enzim carboxipeptidasa E (CPE) elimina els aminoàcids bàsics C-terminals d'ACTH (1-17) obtenint α-MSH (1-14) i l'enzim peptidil α-monooxigenasa amidant (PAM) amida el pèptid per generar desacetil α-MSH (1-13), un pèptid de 13 aminoàcids. Finalment, es dona l'acetilació de desacetil α-MSH (1-13) a acetil α-MSH (1-13) (la forma més activa de α-MSH) per un enzim N-acetiltransferasa (NAT). Per una altra banda, la prolilcarboxipeptidasa (PRCP) convertirà acetil α-MSH (1-13) en el producte inactiu acetil-α-MSH (1–12).[14][13]
Factor inhibidor de MSH
[modifica]Les hormones de l'escorça suprarenal (cortisol, adrenalina, noradrenalina) inhibeixen la secreció de la MSH així com per la neurohormona hipotalàmica (MIF), també coneguda com a Pro-Leu-Gly-NH₂, melanostatina o hormona inhibidora de l'alliberament de MSH.
La MSH és obtinguda pel precursor POMC, per tant, la inhibició de la proopiomelanocortina té efectes directes sobre l'hormona estimulant dels melanòcits. La síntesi i activitat de la POMC augmenta durant l’alimentació i en dejú s’inhibeix. Aquesta activació està regulada per hormones com la leptina i insulina i nutrients com la glucosa. Aquestes són lligands dels receptors de membrana de les neurones POMC, localitzades a l'hipotàlem. L’activació de la POMC per la leptina desencadena la producció i alliberació de l’hormona estimulant dels melanòcits α-MSH i també l’activació dels receptors de melanocortina MC3R i MC4R, cosa que comporta una supressió de la ingesta d’aliments i un augment de la despesa energètica. Una producció inadequada de α-MSH pot induir l’aparició d’obesitat. L’alteració d’enzims implicats en la maduració d’α-MSH (per exemple les prohormones convertases) afecta la regulació del metabolisme.[13]
Per una altra banda, així com es coneixen els passos que segueix la síntesi de la α-MSH, també se sap que la seva inhibició és, en part, responsabilitat de l'enzim prolilcarboxipeptidasa (PRCP) que catalitza l'eliminació del residu de valina C-terminal, produint un pèptid de 12 aminoàcids inactiu α-MSH (1-12). L'enzim PRCP pertany a la família de les carboxipeptidases i conté en el seu centre actiu residus de serina, histidina i asparagina, aminoàcids essencials per la seva activitat catalítica. En gen PRCP es troba en els cromosomes 11 i 7 en els humans i el producte codificat és una proteïna de cadena única d’aproximadament 58 kD.[13]
Regulació i transport
[modifica]
L’hormona estimulant dels melanòcits (MSH) se sintetitza a la hipòfisi mitjana, que queda per sota de l'hipotàlem. Quan ens exposem a la radiació solar l’hipotàlem s’activa i estimula la hipòfisi mitjançant senyals elèctrics perquè produeixi la MSH, que s’encarregarà d’activar la resposta pertinent a aquest estímul. La síntesi de la MSH comença amb la divisió de les proopiomelanocortines i les seves cèl·lules diana seran els melanòcits, als quals estimularà per tal que alliberin melanina.
Pel fet que la MSH és una hormona proteica, el seu transport a través de la sang es podria produir o bé sense cap altra proteïna de transport o bé amb l'albúmina. Aquesta suposició es pot fer partint de la base que l’albúmina és una proteïna de transport no específica que es troba involucrada en el transport de la gran majoria d’hormones proteiques, com ho és la MSH.
Un cop la MSH arriba al melanòcit activa una proteïna receptora de membrana: el receptor de melanocortina tipus I (MC1R). Així doncs, la MSH actua de lligand de la MC1R i el seu reconeixement es produeix gràcies al tetrapèptid (His-Phe-Arg-Trp) que presenta. Aquesta seqüència particular d'aminoàcids és la principal reguladora de la pigmentació i per això no és exclusiva de la MSH. Altres molècules involucrades en processos similars també la presenten com, per exemple, la proteïna Agouti (AgRP) o la corticotropina (ACTH). Malgrat això, existeixen diferències funcionals entre aquestes biomolècules.
Per altra banda, la MC1R pot presentar polimorfismes genètics que són els responsables de les diferències ètniques en la pigmentació i també per les diferents respostes produïdes per l'exposició a la radiació ultraviolada.[16]
La MSH també està relacionada amb altres processos com per exemple estímuls d’estrès, ansietat i de l’apetit. En el cas de l'estrès es creu que el control i regulació de l’hormona pot ser duta a terme a partir de la reacció amb els autoantígens IgG autoAbs. La connexió entre aquestes dues biomolècules és que amb l'exposició a situacions d’estrès el nivell d’afinitat entre les dues incrementa. D'aquesta manera, quan ens trobem en situacions d'estrès, els IgG autoAbs augmenten la capacitat per reaccionar amb la MSH i activar-la per tal que produeixi una resposta a l'estímul.[17] Pel que fa a la regulació de l’apetit, la MSH és considerada una hormona anorexigènica (causa pèrdua de la gana) i en aquesta via metabòlica es torna a trobar relacionada amb la proteïna Agouti (AgRP), que presenta la funció antagònica (augmenta la gana).[18]
La producció a la glàndula pituïtària de la MSH resulta insuficient per l’activació de la melanogènesi. Per això, segurament existeixen altres vies de senyalització involucrades en l'estimulació dels melanòcits. La AgRP i la MSH, per exemple, són dues molècules que s'encarreguen d'activar la producció de la feomelanina en els melanòcits. Alhora en aquesta senyalització també hi podem trobar la cysteinyldopa que té la funció d'activar la producció de l'eumelanina, un pigment amb diferent protecció vers l'exposició solar.
Finalment cal afegir que la síntesi de la MSH també es produeix en altres localitzacions a part de l'hipòfisi. Mentre que en aquest primer cas parlem d'una comunicació a distància pel sistema endocrí, en el nostre organisme aquest procés també té lloc a través d'una comunicació local amb senyalització paracrina i, fins i tot, autocrina. Aquesta alternativa a la regulació de la MSH es produeix a través dels queratinòcits i els mateixos melanòcits. Aquest fet ens permet entendre que els nivells normals de MSH circulants en sang siguin baixos. En el cas dels queratinòcits, com que són limítrofs amb els melanòcits, la MSH no cal que sigui transportada a través de la sang. Aquesta via de producció de l'MSH es regula gràcies al gen p53 que indueix la transformació de les POMC a MSH.[16][19][20]
Els receptors de melanocortines (MCR)
[modifica]Els MCR són receptors acoblats a proteïnes G, proteïnes que travessen set vegades la membrana i que estan unides a la proteïna transductora de senyal G. Concretament, són de la família de les rodopsines. S'han detectat cinc tipus diferents de MCR en humans i els seus agonistes endògens són els HMS i una quarta hormona anomenada ACTH, també derivada de la POMC. La transducció del senyal és deguda a l'activació de la liasa adenilat ciclasa, la qual desencadena la cascada de senyalització intracel·lular dependent de l'AMP cíclic.
MCR de tipus 1 (MCR1)
[modifica]Síntesi de melanina
[modifica]El MCR1 és present principalment en el melanòcits i la seva principal funció és induir la melanogènesi. La unió de l'α-MSH amb el receptor desencadena un mecanisme on l'AMP cíclic activa l'expressió de l'enzim tirosinasa. Aquesta oxidasa catalitza la reacció de la tirosina en dopaquinona, un intermediari comú entre la feomelanina i l'eumelanina,[21] dos tipus de melanina. Aquest pigment té una importància cabdal en la protecció de l'epidermis contra la radiació ultraviolada i la coloració de cabell i ulls en mamífers. Els MSH també permeten un canvi ràpid de color mitjançant l'activació dels melanòfors,[22] els equivalents dels melanòcits en amfibis, peixos i alguns tipus de cefalòpodes i crustacis.
Funció antiinflamatòria
[modifica]Els MCR1 també són presents en cèl·lules del sistema immunitari, com en leucòcits i macròfags, i s'ha observat una funció antiinflamatòria. Les melanocortines inhibeixen NFκB54, un factor de transcripció que regula la síntesi de mediadors inflamatoris implicats en diverses respostes immunitàries, com les quimiocines i linfocines. El mecanisme d'acció que segueix encara està poc aclarit, però se sap que la proteïna quinasa A s'activa amb la inducció de l'AMP cíclic. Les quinases A fosforilen i, conseqüentment, inactiven la glucogen sintasa quinasa 3 (GSK-3). Aquesta proteïna sembla que controla la fosforilació específica de NFκB, crucial per a la seva funcionalitat.[23] A més, també s'ha demostrat que α-MSH té activitat immunosupressora unint-se als MC1R de monòcits i limfòcits B.[23]
MCR de tipus 2 (MCR2)
[modifica]El lligand exclusiu de MCR2 és la melacortina ACTH. MCR2 és també conegut com a receptor de l'hormona adrenocorticotròpica o receptro d'ACTH. És el menys conegut de tots els MCR, però se sap que afecta diverses etapes de l'esteroidogenesi i del creixement de l'escorça suprarenal,[23] a més de tenir un paper en el metabolisme de la glucosa i en la funció immunitària.[24]
MCR de tipus 3 (MCR3)
[modifica]MCR3 és present en diverses regions del cervell, com el nucli arquejat de l'hipotàlem i el sistema límbic, i en altres òrgans com l'intestí, el cor i el ronyó, fet que suggereix una involucració en la regulació de l'hemodinàmica i la natriuresi. Se sap que el ronyó és un important target de les melacortines,[23] però encara no s'ha pogut determinar amb exactitud els tipus de MCR que predominen en aquest òrgan.
Aquest receptor té especial afinitat amb ɣ-MSH[25] i la seva localització en les cèl·lules del ronyó revelen el paper de les melanocortines en la regulació de la natriuresi. Una dieta amb excés de sodi fa que la hipòfisi incrementi la síntesi de POMC, el qual serà alliberat als vasos sanguinis en forma de ɣ-MSH. En interactuar amb el MCR3 dels ronyons, s'estimula l'excreció de sodi en orina. La comprensió d'aquest mecanisme encara està per estudiar.
MCR3 es troba també en el sistema nerviós central (SNC), regula funcions erèctils i té un paper important en la regulació del metabolisme juntament amb MCR4.
MCR de tipus 4 (MCR4)
[modifica]S'ha demostrat que el sistema de les melanocortines té un paper important en l'homeòstasi energètica i la regulació del metabolisme, però encara no s'ha pogut determinar tots els derivats de la POMC que hi interactuen.[26] Són especialment rellevants l' α-MSH i la β-MSH, agonistes dels receptors MC4R. A més, s'ha observat que en augmentar la concentració d'α-MSH en ratolins s'incrementa la lipòlisi del teixit adipòs.[27] Es creu que l'α-MSH indueix l'oxidació d'àcids grassos en unir-se als MCR4 dels adipòcits.
S'ha determinat que MCR4 té com a cofactor l'ió Ca2+'. S'uneix a residus tant del receptor com del lligand, augmentant l'afinitat amb α-MSH.[28]
MCR5 en glàndules exocrines
[modifica]El MCR5 va ser l'últim receptor de melacortines en ser descobert. Estimulen la secreció en glàndules com l'harderiana, la lacrimal, prepucial, clitoral i submandibular.[29] MC5R és necessari per a la producció normal de seu.
| Receptor | Lligands | Principals funcions biològiques | Localització |
|---|---|---|---|
| MCR1 | ACTH, α-MSH, β-MSH, γ-MSH | Melanogènesi, antiinflamació | Melanòcits, sistema immunitari |
| MCR2 | ACTH | Esteroidogenesis | Escorça suprarenal |
| MCR3 | ACTH, α-MSH, β-MSH, γ-MSH | Natriuresi, regulació del metabolisme, regulació de comportaments sexuals | SNC, ronyó |
| MCR4 | ACTH, α-MSH, β-MSH, γ-MSH | Homeòstasi energètica, regulació del metabolisme | SNC |
| MCR5 | ACTH, α-MSH, β-MSH,γ-MSH | Secreció | Glàndules exocrines |
Aplicacions mèdiques
[modifica]Dels tres tipus diferents d'hormones estimulants dels melanòcits, només les α-MSH s'han pogut utilitzar com a tractaments mèdics en humans. De fet, les α-MSH, en sí, no s'utilitzen, sínó que s’han desenvolupat molècules sintètiques anàlogues a aquestes, per motius que més endavant en el text es tracten. Dues de les molècules sintètiques més conegudes i ben estudiades són: la afamelanotide i la bremelanotide, però n’existeixen d’altres com ara la modimelanotide i la setmelanotide.
L’afamelanotide o melanotan I, venuda i testada per l'empresa farmacèutica Clinuvel Pharmaceuticals sota el nom de SCENESSE ®, ha demostrat ser eficaç en diferents malalties dermatològiques com ara la protoporfiria eritropètica (EEP), la urticària solar, l'erupció de llum polifòrmica (PMLE), vitiligo i acne, entre d’altres. En el cas de la protoporfiria eritropètica, l’afamelanotide va ser aprovada el 2015 per la Unió Europea com a medicament per a la prevenció de la fototoxicitat en pacients adults. L’afamelanotide, que s’administra de manera subcutània com a implant biodegradable de 16 mg, permet als pacients estar més hores exposats al sol sense dolor i també millores en la seva qualitat de vida.[30][31]
La bremelanotide, testada i venuda per l'empresa Palatin Techonologies sota el nom de Vyleesi™, és un actiu metabòlic de la melanotan II (molècula sintètica anàloga a l’α-MSH) amb una alta afinitat als receptors de tipus 4 de la melanocortina, coneguts per ser importants en les funcions sexuals en les dones. La bremelanotide, ha estat recentment aprovada als Estats Units per l’Administració de menjar i drogues (FDA) com a teràpia pel trastorn hipoactiu del desig sexual (HSDD) en dones premenopàusiques i menopàusiques amb baix desig sexual. Cal remarcar, que es recomana l'ús d'aquest tractament sempre que el baix desig sexual en les dones no sigui resultat de cap problema ginecològic, trastorn psicològic o problemes amb la parella. La bremelanotide s’autoadministra amb una injecció subcutània a l’abdomen o a la cuixa, 45 minuts abans de mantenir relacions sexuals. Tot i que té alguns efectes secundaris, com per exemple nàusees i mal de cap, ha demostrat incrementar el desig sexuals en dones premenopàsiques i menopàusiques.[32][33][34]
També s’està investigant les α-MSH com a potencials candidates per al diagnòstic del melanoma. Per tal de poder detectar amb exactitud els melanomes cutanis, les possibles metàstasis i lesions en el pacient, es pot fer servir la tècnica de la gammagrafia. Aquesta tècnica requereix radiofàrmacs altament específics per poder detectar els tumors i lesions en el pacient. Tant els melanomes melanòtics com els amelanòtics sobreexpressen els receptors de la melanocortina-1 (MC1R), aleshores, si s’obtenen derivats a partir de les α-MSH, que són els lligands de les MC1R, es podrien detectar els tumors. S’ha demostrat a partir d’experiments amb rates,[35] que octapèptids derivats de les α-MSH,[36] tenen una alta afinitat a les MC1R, una biodistribució favorable en el tumor, és a dir que s’acumulaven preferentment en les lesions del melanoma, i, finament un ràpida eliminació en la sang a través dels ronyons. Al cap de 4 hores després d’haver injectat l’octapèptid, es poden veure imatges clares del melanoma.[37]
Cal destacar que, cm anteriorment en el text s'ha mencionat, que s’aconsegueixen derivats peptídics de les α-MSH perquè aquestes poden induir una lenta melanogènesi en els melanòcits dels tumors, cosa que és evidentment desfavorable.
Per poder localitzar els melanomes, també s’han realitzat investigacions en què és conjuguen els octapèptids amb fotosensibilitzadors no selectius i s’utilitza una llum LED d’alta precisió i en tàndem molt propera a l’infraroig (que té una lata capacitat de penetrar la pell), que disminueix els danys colaterals. Això podria conduir a una tecnologia potencialment més eficaç, no tòxica i sofisticada per a la toxicitat específica.[38]
Referències
[modifica]- ↑ Lerner, Aaron Bunsen; Shizume, Kazuo; Fitzpatrick, Thomas B.; Mason, Howard S. «MSH: THE MELANOCYTE-STIMULATING HORMONE» (en anglès). A.M.A. Archives of Dermatology and Syphilology, 70, 5, 01-11-1954, pàg. 669–674. DOI: 10.1001/archderm.1954.01540230119017. ISSN: 0096-5979.
- ↑ 2,0 2,1 2,2 2,3 «Melanocyte-stimulating hormone» (en anglès). Charles H. Emerson, 22-11-2018. [Consulta: 3 novembre 2020].
- ↑ «Melanotropina». [Consulta: 3 novembre 2020].
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Millington, George WM «The role of proopiomelanocortin (POMC) neurones in feeding behaviour». Nutrition & Metabolism, 4, 1, 2007, pàg. 18. DOI: 10.1186/1743-7075-4-18. PMC: PMC2018708. PMID: 17764572.
- ↑ 5,0 5,1 5,2 PubChem. «alpha-MSH» (en anglès). [Consulta: 31 octubre 2020].
- ↑ 6,0 6,1 6,2 PubChem. «beta-Melanocyte-stimulating hormone» (en anglès). [Consulta: 31 octubre 2020].
- ↑ 7,0 7,1 7,2 PubChem. «g-Melanotropin» (en anglès). [Consulta: 31 octubre 2020].
- ↑ 8,0 8,1 Luger, Thomas; Grabbe, Stephan; Scholzen, Thomas «The Role of -Melanocyte-Stimulating Hormone in Cutaneous Biology». Journal of Investigative Dermatology Symposium Proceedings, 1997, pàg. 87-93 [Consulta: 31 octubre 2020].
- ↑ 9,0 9,1 9,2 Raffin-Sanson, Ml; de Keyzer, Y; Bertagna, X «Proopiomelanocortin, a polypeptide precursor with multiple functions: from physiology to pathological conditions». European Journal of Endocrinology, 149, 2, 01-08-2003, pàg. 79–90. DOI: 10.1530/eje.0.1490079. ISSN: 0804-4643.
- ↑ Cawley, Niamh X; Li, Zhaojin; Loh, Y Peng «60 YEARS OF POMC: Biosynthesis, trafficking, and secretion of pro-opiomelanocortin-derived peptides». Journal of Molecular Endocrinology, 56, 4, 5-2016, pàg. T77–T97. DOI: 10.1530/JME-15-0323. ISSN: 0952-5041.
- ↑ Raffin-Sanson, ML; Keyzer, Y; Bertagna, X «Proopiomelanocortin, a polypeptide precursor with multiple functions: from physiology to pathological conditions». European Journal of Endocrinology, 2003, pàg. 79-90 [Consulta: 31 octubre 2020].
- ↑ Alberts, Bruce, et altera. «13». A: Molecular Biology of THE CELL. 6th Edition. Garland Science, 2015, p. 744. Arxivat 2020-11-27 a Wayback Machine.
- ↑ 13,0 13,1 13,2 13,3 D’Agostino, Giuseppe; Diano, Sabrina «alpha-Melanocyte stimulating hormone: production and degradation» (en anglès). Journal of Molecular Medicine, 88, 12, 12-2010, pàg. 1195–1201. DOI: 10.1007/s00109-010-0651-0. ISSN: 0946-2716. PMC: PMC3936413. PMID: 20617297.
- ↑ Li, Qing; Jia, Yang; Burris, Walter R; Bridges, Phillip J; Matthews, James C «Forms of selenium in vitamin–mineral mixes differentially affect the expression of genes responsible for prolactin, ACTH, and α-MSH synthesis and mitochondrial dysfunction in pituitaries of steers grazing endophyte-infected tall fescue1» (en anglès). Journal of Animal Science, 97, 2, 01-02-2019, pàg. 631–643. DOI: 10.1093/jas/sky438. ISSN: 0021-8812.
- ↑ Litwack, Gerald. «15 - Polypeptide Hormones». A: Human Biochemistry (en anglès). Los Angeles, CA, United States: Academic Press, 2018, p. 427-465.
- ↑ 16,0 16,1 Videira, IF; Moura, DF; Magina, S «Mechanisms regulating melanogenesis.». Anais brasileiros de dermatologia, 88, 1, 1-2013, pàg. 76-83. DOI: 10.1590. PMID: 23539007.
- ↑ Sinno, Maria Hamze; Rego, Jean Claude Do; Coëffier, Moïse; Bole-Feysot, Christine; Ducrotté, Philippe; Gilbert, Danièle; Tron, François; Costentin, Jean; Hökfelt, Tomas; Déchelotte, Pierre; Fetissov, Sergueï O. «Regulation of feeding and anxiety by α-MSH reactive autoantibodies». Psychoneuroendocrinology, 34, 1, 1-2009, pàg. 140–149. DOI: 10.1016/j.psyneuen.2008.08.021.
- ↑ Vehapoğlu, Aysel; Türkmen, Serdar; Terzioğlu, Şule «Alpha-Melanocyte-Stimulating Hormone and Agouti-Related Protein: Do They Play a Role in Appetite Regulation in Childhood Obesity?». Journal of Clinical Research in Pediatric Endocrinology, 8, 1, 01-03-2016, pàg. 40–47. DOI: 10.4274/jcrpe.2136. PMID: 13085727.
- ↑ Cui, Rutao; Widlund, Hans R.; Feige, Erez; Lin, Jennifer Y.; Wilensky, Dara L.; Igras, Viven E.; D'Orazio, John; Fung, Claire Y.; Schanbacher, Carl F.; Granter, Scott R.; Fisher, David E. «Central Role of p53 in the Suntan Response and Pathologic Hyperpigmentation». Cell, 128, 5, 3-2007, pàg. 853–864. DOI: 10.1016/j.cell.2006.12.045. PMID: 17350573.
- ↑ Wiriyasermkul, Pattama; Moriyama, Satomi; Nagamori, Shushi «Membrane transport proteins in melanosomes: Regulation of ions for pigmentation». Biochimica Et Biophysica Acta. Biomembranes, 1862, 12, 01-12-2020, pàg. 183318. DOI: 10.1016/j.bbamem.2020.183318. ISSN: 1879-2642. PMC: 7175901. PMID: 32333855.
- ↑ «Pigmentación de la piel (I). Melaninas: conceptos generales e implicaciones cosméticas». [Consulta: 6 novembre 2020].
- ↑ Hadley, M. E.; Heward, C. B.; Hruby, V. J.; Sawyer, T. K.; Yang, Y. C. «Biological actions of melanocyte-stimulating hormone». Ciba Foundation Symposium, 81, 1981, pàg. 244–262. DOI: 10.1002/9780470720646.ch14. ISSN: 0300-5208. PMID: 6268380.
- ↑ 23,0 23,1 23,2 23,3 Gong, Rujun «Leveraging melanocortin pathways to treat glomerular diseases». Advances in chronic kidney disease, 21, 2, 3-2014, pàg. 134–151. DOI: 10.1053/j.ackd.2013.09.004. ISSN: 1548-5595. PMC: 3950821. PMID: 24602463.
- ↑ «ACTH - Clinical: Adrenocorticotropic Hormone, Plasma». [Consulta: 10 novembre 2020].
- ↑ Ni, Xi-Ping; Kesterson, Robert A.; Sharma, Shubh D.; Hruby, Victor J.; Cone, Roger D. «Prevention of reflex natriuresis after acute unilateral nephrectomy by melanocortin receptor antagonists». American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 274, 4, 01-04-1998, pàg. R931–R938. DOI: 10.1152/ajpregu.1998.274.4.R931. ISSN: 0363-6119.
- ↑ «Central administration of β-MSH reduces body weight in obese male Pomctm1/tm1 mice» (en anglès). Biochimica et Biophysica Acta (BBA) - General Subjects, 1864, 10, 01-10-2020, pàg. 129673. DOI: 10.1016/j.bbagen.2020.129673. ISSN: 0304-4165.
- ↑ Gan, Lu; Liu, Zhenjiang; Chen, Yizhe; Dan Luo; Feng, Fei «α-MSH and Foxc2 promote fatty acid oxidation through C/EBPβ negative transcription in mice adipose tissue». Scientific Reports, 6, 07-11-2016. DOI: 10.1038/srep36661. ISSN: 2045-2322. PMC: 5098202. PMID: 27819350.
- ↑ Bank, RCSB Protein Data. «RCSB PDB - 6W25: Crystal structure of the Melanocortin-4 Receptor (MC4R) in complex with SHU9119» (en anglès americà). [Consulta: 10 novembre 2020].
- ↑ Young, Juan I. Estudio de la regulación transcripcional y funcional del gen de proopiomelanocortina en el sistema nervioso central de ratones transgénicos (Tesi). Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales, 1998.
- ↑ Kaddurah, Hisham; Braunberger, Taylor L.; Vellaichamy, Gautham; Nahhas, Amanda F.; Lim, Henry W. «The Impact of Sunlight on Skin Aging». Current Geriatrics Reports, 7, 4, 29-10-2018, pàg. 228–237. DOI: 10.1007/s13670-018-0262-0. ISSN: 2196-7865.
- ↑ Langendonk, Janneke G.; Balwani, Manisha; Anderson, Karl E.; Bonkovsky, Herbert L.; Anstey, Alexander V. «Afamelanotide for Erythropoietic Protoporphyria» (en anglès). New England Journal of Medicine, 373, 1, 02-07-2015, pàg. 48–59. DOI: 10.1056/NEJMoa1411481. ISSN: 0028-4793.
- ↑ Kingsberg, Sheryl A.; Clayton, Anita H.; Portman, David; Williams, Laura A.; Krop, Julie «Bremelanotide for the Treatment of Hypoactive Sexual Desire Disorder: Two Randomized Phase 3 Trials» (en anglès). Obstetrics & Gynecology, 134, 5, 11-2019, pàg. 899–908. DOI: 10.1097/AOG.0000000000003500. ISSN: 0029-7844.
- ↑ Clayton, Anita H; Althof, Stanley E; Kingsberg, Sheryl; DeRogatis, Leonard R; Kroll, Robin «Bremelanotide for Female Sexual Dysfunctions in Premenopausal Women: A Randomized, Placebo-Controlled Dose-Finding Trial» (en anglès). Women's Health, 12, 3, 6-2016, pàg. 325–337. DOI: 10.2217/whe-2016-0018. ISSN: 1745-5065.
- ↑ Dhillon, Sohita; Keam, Susan J. «Bremelanotide: First Approval» (en anglès). Drugs, 79, 14, 9-2019, pàg. 1599–1606. DOI: 10.1007/s40265-019-01187-w. ISSN: 0012-6667.
- ↑ Varga, Balazs; Gesztelyi, Rudolf; Bombicz, Mariann; Haines, David; Szabo, Adrienn Monika «Protective Effect of Alpha-Melanocyte-Stimulating Hormone (α-MSH) on the Recovery of Ischemia/Reperfusion (I/R)-Induced Retinal Damage in A Rat Model» (en anglès). Journal of Molecular Neuroscience, 50, 3, 7-2013, pàg. 558–570. DOI: 10.1007/s12031-013-9998-3. ISSN: 0895-8696.
- ↑ Eberle, Alex N.; Bapst, Jean-Philippe; Calame, Martine; Tanner, Heidi; Froidevaux, Sylvie. MSH Radiopeptides for Targeting Melanoma Metastases. 681. Nova York, NY: Springer New York, 2010, p. 133–142. DOI pmid: 21222266. 10.1007/978-1-4419-6354-3_11. pmid: 21222266.. ISBN 978-1-4419-6353-6.
- ↑ Froidevaux, Sylvie; Calame-Christe, Martine; Sumanovski, Lazar; Tanner, Heidi; Eberle, Alex N. «DOTA α-Melanocyte-Stimulating Hormone Analogues for Imaging Metastatic Melanoma Lesions» (en anglès). Annals of the New York Academy of Sciences, 994, 1, 6-2003, pàg. 378–383. DOI: 10.1111/j.1749-6632.2003.tb03203.x.
- ↑ Bigliardi, Paul Lorenz; Rout, Bhimsen; Pant, Aakanksha; Krishnan-Kutty, Viknish; Eberle, Alex N. «Specific Targeting of Melanotic Cells with Peptide Ligated Photosensitizers for Photodynamic Therapy» (en anglès). Scientific Reports, 7, 1, 12-2017, pàg. 15750. DOI: 10.1038/s41598-017-15142-w. ISSN: 2045-2322.
