Proteïna Tamm Horsfall
La proteïna Tamm Horsfall (TPH o uromodulina) és la proteïna més abundant en l'orina normal, una glicoproteïna que en l'ésser humà està codificada pel gen UMODE.[6][7] La seva excreció en l'orina depèn del trencament (proteòlisi) dels ectodominis de l'ancoratge glicosil-fosfatidil-inositol, que es troba a la superfície luminal de les cèl·lules de l'ansa de Henle i al túbul C distal. La uromodulina pot actuar com a inhibidor de la cristal·lització constitutiva del calci en els líquids renals. La uromodulina a l'excreció de l'orina pot proporcionar una defensa contra les infeccions del tracte urinari causades per bacteris patògens.
Genòmica
[modifica]
Els defectes en aquest gen estan associats a trastorns autosòmics dominants a nivell renal, com ara la malaltia renal quística medul·lar-2 (MCKD2) i la nefropatia hiperuricèmica juvenil familiar (FJHN). Aquests trastorns es caracteritzen per l'aparició d'hiperuricèmia, gota i insuficiència renal progressiva.
La mutació en el gen UMODE determina l'acumulació de la uromodulina mutada formant masses globulars dins del citoplasma de les cèl·lules epitelials de la branca gruixuda ascendent de la nansa de Henle i del túbul C distal.
Aquests dipòsits d'uromodulina expliquen que l'excreció urinària de la proteïna mutada s'hagi trobat disminuïda en els pacients amb nefropatia familiar associada a una mutació en el gen UMODE. Aquesta mutació al no ocasiona una disminució en la síntesi de la proteïna sinó que afecta el transport intracel·lular de la mateixa fins a la membrana plasmàtica. La troballa de dipòsits de la proteïna mutada en el reticle endoplasmàtic recolza aquesta hipòtesi. Els cúmuls intracitoplasmàtics de la proteïna, quan s'analitzen mitjançant microscòpia electrònica, apareixen com a material fibril·lar al reticle endoplasmàtic distribuït en zones poc extenses al voltant dels mitocondris. També s'han descrit dipòsits intersticials d'uromodulina. El dipòsit de la proteïna en les cèl·lules tubulars ocasiona la seva apoptosi i l'alliberació dels dipòsits d'uromodulina a l'interstici renal. La uromodulina pot tenir un potencial inflamatori i pot desencadenar una resposta inflamatòria i nefritis a nivell intersticial.
D'altra banda, s'ha hipotetitzat que la uromodulina podria ser responsable de la impermeabilitat l'aigua característica de la branca gruixuda ascendent de la nansa de Henle, per la seva capacitat de formar una estructura reversible de tipus gel. La uromodulina mutada no podria formar aquesta barrera perquè no arriba a la membrana plasmàtica, el que donaria lloc a una incapacitat per concentrar l'orina.
Tot i que poden existir diverses variants de transcripció d'aquest gen, només dues han estat descrites completament fins ara. Aquestes dues representen les principals variants d'aquest gen i codifiquen la mateixa isoforma.[7]
Estructura
[modifica]
La proteïna de Tamm-Horsfall és una glicoproteïna àcida ancorada al GPI. No deriva de plasma sanguini, però és produïda per la branca ascendent gruixuda de la nansa de Henle del ronyó dels mamífers. Presenta una subunitat monomèrica amb un pes molecular d'uns 68-78 kD, però tendeix a formar macroagregats de diversos milions de D (Grases, Costa-Bauzá, Llobera, 1995). Tot i que el seu monòmer té un pes molecular tan baix, és fisiològicament present a l'orina en estat molt agregat. Quan aquesta proteïna es concentra a pH baix, es forma un gel. La proteïna de Tamm-Horsfall és la proteïna més abundant en l'orina dels mamífers i constitueix la matriu de cilindres urinaris derivats de la secreció de les cèl·lules tubulars renals.
Història
[modifica]La glicoproteïna va ser purificada per Tamm i Horsfall a partir de l'orina d'individus sans (Tamms I & Horsfall FL, 1950). Més tard va ser detectada a l'orina de tots els mamífers estudiats.
Funció
[modifica]La uropontina, la nefrocalcina i la uromodulina són les 3 glicoproteïnes urinàries conegudes que intervenen en la formació les pedres del ronyó (càlculs) contenidors de calci.
La funció de THP encara no està ben entesa. Estudis realitzats en ratolins deficients en THP van revelar que la THP pot estar involucrada en la fisiologia reguladora, i de fet participa en la funció de transport.[9] Altres estudis suggereixen que la THP té un paper en la unió i la retenció de bacteris. Així hi ha estudis que demostren que l'E. coli que expressa pili MS (manosa-sensibles) o fímbries pot quedar atrapat per la proteïna de Tamm-Horsfall a través de les seves cadenes laterals amb manoses. La proteïna de Tamm-Horsfall forma part de la matriu en els càlculs renals, però el seu paper en la formació de càlculs renals continua en discussió i controvèrsia. Els anticossos contra la proteïna de Tamm-Horsfall s'han vist en diverses formes de nefritis (per exemple, a la nefropatia dels Balcans), però, no acaba de quedar clar si hi ha alguna importància fisiopatogènica en aquestes troballes.

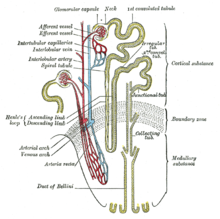
1. Càpsula renal, 2. Còrtex renal, 3. Columna, 4. Medul·la renal: 5. Piràmide i 6. Papil·la de la piràmide.
7. Pelvis renal, 8. Calze major, 9. Calze menor, 10. Urèter.
11. Corpuscle (del nefró)
Sistema vascular: 12. Arteriola i vènula interlobel·lars, 13. Artèria i vena arcuades, 14. Artèria i vena interlobulars, 15. Artèria renal, 16. Vena renal.
17. Hili renal, 18. Pol del ronyó (inferior) , 19. Greix del si renal.
Importància clínica de l'estudi de molècules anormals en orina
[modifica]En condicions normals, les proteïnes es troben a l'orina en quantitats molt petites, sempre en funció del volum eliminat.
Les proteïnes que trobem a l'orina són bàsicament:
- Albúmina
- Globulines
- Proteïna de Tamm-Horsfall (proteïna viscosa que no es troba al plasma)
- Altres proteïnes: Transferrina i Ig A, ambdues procedents de secrecions urinàries
La detecció d'anticossos anti-THP, que presenta un bon nivell d'especificitat en pacients majors d'un any d'edat, és indicatiu d'infecció renal. Tot i així, la laboriositat i complexitat de la prova la fa molt poc accessible a la pràctica pediàtrica.
Referències
[modifica]- ↑ «Malalties que s'associen genèticament amb proteïna Tamm Horsfall, vegeu/editeu les referències a wikidata».
- ↑ 2,0 2,1 2,2 GRCh38: Ensembl release 89: ENSG00000169344 - Ensembl, May 2017
- ↑ 3,0 3,1 3,2 GRCm38: Ensembl release 89: ENSMUSG00000030963 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ Jeanpierre C, Whitmore SA, Austruy E, Cohen-Salmon M, Callen DF, Junien C (Mar 1993). "Chromosomal assignment of the uromodulin gene (UMOD) to 16p13.11". Cytogenet Cell Genet 62 (4): 185-7. PMID: 8382593
- ↑ 7,0 7,1 "Entrez Gene: UMOD uromodulin (uromucoid, Tamm-Horsfall glycoprotein)". http://www.ncbi.nlm.nih.gov/sites/entrez?Db=gene&Cmd=ShowDetailView&TermToSearch=7369
- ↑ Ruddock i Molinari (2006) Journal of Cell Science 119, 4373-4380
- ↑ Bachmann S, Mutig K, Bates J, Welker P, Geist B, Gross V, Luft FC, Alenina N, Bader M, Thiele BJ, Prasadan K, Raffi HS, Kumar S (2005). "Renal effects of Tamm-Horsfall protein (uromodulin) deficiency in mice". Am. J. Physiol. Renal Physiol. 288 (3): F559–67. PMID: 15522986 doi:10.1152/ajprenal.00143.2004
Bibliografia
[modifica]- Fundamentos y técnicas de análisis bioquimico. Ed: Paraninfo. Autores. Ocon Navaza, Garcia Saavedra,Vicente Garcia.
- http://www.revistanefrologia.com/mostrarfile.asp?ID=2990[Enllaç no actiu].
- http://www.tesisenxarxa.net/TESIS_UV/AVAILABLE/TDX-0624109-104729//arasa.pdf Arxivat 2012-09-02 a Wayback Machine.
- Scolari F, Viola BF, Ghiggeri GM, et al. (2003). "Towards the identification of (a) gene(s) for autosomal dominant medullary cystic kidney disease.". J. Nephrol. 16 (3): 321–8. PMID: 12832729.
- Rindler MJ, Naik SS, Li N, et al. (1991). "Uromodulin (Tamm-Horsfall glycoprotein/uromucoid) is a phosphatidylinositol-linked membrane protein.". J. Biol. Chem. 265 (34): 20784–9. PMID: 2249987.
- Muchmore AV, Decker JM (1985). "Uromodulin: a unique 85-kilodalton immunosuppressive glycoprotein isolated from urine of pregnant women.". Science 229 (4712): 479–81.
doi:10.1126/science.2409603. PMID: 2409603.
- Pennica D, Kohr WJ, Kuang WJ, et al. (1987). "Identification of human uromodulin as the Tamm-Horsfall urinary glycoprotein.". Science 236 (4797): 83–8. doi:10.1126/science.3453112. PMID: 3453112.
- Hession C, Decker JM, Sherblom AP, et al. (1987). "Uromodulin (Tamm-Horsfall glycoprotein): a renal ligand for lymphokines.". Science 237 (4821): 1479–84. doi:10.1126/science.3498215. PMID: 3498215.
- Prasadan K, Bates J, Badgett A, et al. (1995). "Nucleotide sequence and peptide motifs of mouse uromodulin (Tamm-Horsfall protein)--the most abundant protein in mammalian urine.". Biochim. Biophys. Acta 1260 (3): 328–32. PMID: 7873609.
- Huang ZQ, Kirk KA, Connelly KG, Sanders PW (1994). "Bence Jones proteins bind to a common peptide segment of Tamm-Horsfall glycoprotein to promote heterotypic aggregation.". J. Clin. Invest. 92 (6): 2975–83. doi:10.1172/JCI116920. PMID: 8254051.
- Rhodes DC, Hinsman EJ, Rhodes JA (1994). "Tamm-Horsfall glycoprotein binds IgG with high affinity.". Kidney Int. 44 (5): 1014–21. doi:10.1038/ki.1993.343. PMID: 8264130.
- Fukushima K, Watanabe H, Takeo K, et al. (1993). "N-linked sugar chain structure of recombinant human lymphotoxin produced by CHO cells: the functional role of carbohydrate as to its lectin-like character and clearance velocity.". Arch. Biochem. Biophys. 304 (1): 144–53.
doi:10.1006/abbi.1993.1332. PMID: 8323280.
- Thomas DB, Davies M, Peters JR, Williams JD (1993). "Tamm Horsfall protein binds to a single class of carbohydrate specific receptors on human neutrophils.". Kidney Int. 44 (2): 423–9. doi:10.1038/ki.1993.260. PMID: 8397318.
- Badgett A, Kumar S (1999). "Phylogeny of Tamm-Horsfall protein.". Urol. Int. 61 (2): 72–5. doi:10.1159/000030292. PMID: 9873244.
Enllaços externs
[modifica]- Tamm-Horsfall protein deposition Arxivat 2007-06-24 at Archive.is





