Reacció de Ramberg-Bäcklund
La reacció de Ramberg-Bäcklund és una reacció orgànica on es converteix un α-halosulfona en un alquè en presència d'una base amb l'extrusió de diòxid de sofre (SO₂).[1] La reacció deu el seu nom als químics suecs Ramberg Ludwig i Birger Bäcklund.
El carbanió format per desprotonació produeix diòxid de tiirà, el qual és inestable i es descompon amb l'eliminació de diòxid de sofre. Aquest pas d'eliminació és considerat com una cicloeliminació concertada.

La transformació global de la reacció és la conversió dels enllaços de carboni-sofre a un enllaç doble carboni-carboni. El procés original implica l'halogenació d'un sulfur, seguida de l'oxidació a la sulfona.

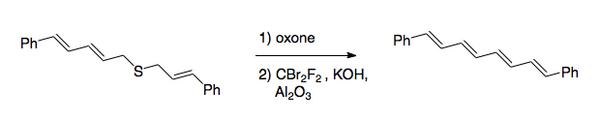
Recentment, el mètode preferit és el que resulta d'invertir l'ordre dels passos. Després de l'oxidació, el que es fa normalment amb un peràcid, es duu a terme la halogenació en condicions bàsiques mitjançant l'ús de dibromodifluorometà (CBr₂F₂) per al pas de la transferència d'halogen.[2] Aquest mètode va ser utilitzat per sintetitzar 1,8-difenil-1,3,5,7-octatraè.
La reacció de Ramberg-Bäcklund té diverses aplicacions. A causa de la naturalesa de l'eliminació, aquesta pot ser aplicada a anells petits, i anells grans amb un doble enllaç.[3]

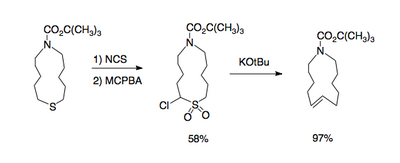
Les α-halosulfones necessàries per a la reacció són disponibles a través de l'oxidació dels corresponents α-halosulfurs amb peràcids, com ara l'àcid meta-cloroperbenzoic (mCPBA); l'oxidació dels sulfurs es duu a terme de manera selectiva amb la presència d'alquens i alcohols. Els α-halosulfurs al seu torn poden ser sintetitzats a través del tractament de sulfurs amb halògens electrofílics com la N-clorosuccinimida o la N-bromosuccinimida.[4]
El grup sulfona conté un protó àcid en una de les α-posicions que s'extreu a través d'una base forta. La càrrega negativa generada en aquesta posició (de manera formal, un carbanió) és transferida a l'halogen residint en l'altra α-posició, en una substitució nucleofílica formant-se temporalment una sulfona heterocíclica de tres membres. Aquest intermediari és inestable i s'allibera diòxid de sofre per formar l'alquè. Generalment s'obtenen mescles d'isòmers cis i trans.[5]

Aquesta reacció permet sintetitzar el 1,2-dimetilenciclohexà.[6]

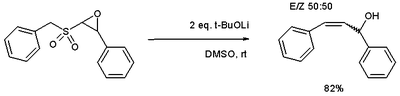
S'ha informat una variació per obtenir alcohols al·lílics per mitjà d'epòxids.[7]
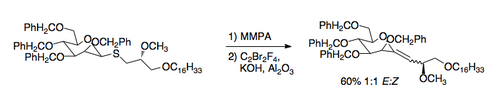
Una aplicació de la reacció de Ramberg-Bäcklund és la síntesi de C-glucòsids. El tioèter necessari es pot preparar fàcilment mitjançant un intercanvi amb un tiol. L'aplicació de les condicions de Ramberg-Bäcklund condueix a un èter vinílic exocíclic que es pot reduir al C-nucleòsid desitjat.[8]
Referències
[modifica]- ↑ L. Ramberg, B. Bäcklund Ark. Chim., Mineral Geol., 1940, 27 Vol 13A, 1- 50.
- ↑ T.-L. Chan, S. Fong, Y. Li, T.-O. Mau, and C.-D. Poon, "J. Chem. Soc., Chem. Commun"., 1771 (1994); X.-P. Cao, "Tetrahedron", 58, 1301 (2002) doi:[1]
- ↑ I. MaGee and E. J. Beck, "Can. J. Chem.," 78, 1060 (2000).
- ↑ Böhme, H.; Gran, H. J. Ann. Chem. 1952, 577, 68.
- ↑ Paquette, L. Org. React. 1977, 25 1. doi:10.1002/0471264180.or025.01
- ↑ Cyclohexane, 1,2-bis(methylene)- Eric Block and Mohammad Aslam Organic Syntheses, Coll. Vol. 8, p.212 (1993); Vol. 65, p.90 (1987) Article
- ↑ The Epoxy-Ramberg-Bäcklund Reaction (ERBR): A Sulfone-Based Method for the Synthesis of Allylic Alcohols European Journal of Organic Chemistry Volume 2006, Issue 7, Date: April 2006, Pages: 1740-1754 Paul Evans, Paul Johnson, Richard J. K. Taylor Abstract
- ↑ F. K. Griffin, D. E. Paterson, P. V. Murphy, and R. J. K. Taylor, "Eur. J. Org. Chem.," 1305, (2002)
